Распределение вещества между двумя несмешивающимися жидкостями. Закон Нернста- Шилова.
Если в систему, состоящую из двух взаимно нерастворимых жидкостей, добавить третий компонент, то оно распределяется в них определенным образом по закону распределения Нернста- Шилова- отношение равновесных концентраций трех компонентов в двух взаимно нерастворимых жидкостях есть величина постоянная при данной температуре называется коэффициентом распределения.
С1/С2= К
С1- концентрация третьего компонентов в первой жидкости
С2- концентрация третьего компонента во второй жидкости
К –коэффициент распределения (зависит от природы и температуры)
Если компонент в жидкостях подвергается диссоциации или ассоциации, то
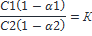
α1 и α2- степень диссоциации или ассоциации
Понятие об экстракции, её применение.
Экстракция- это процесс извлечения вещества растворенного в первом растворителе другим растворителем (экстрагентом), который не смешивается с первым и лучше растворяет извлекаемое вещество. Применяют в фармации для извлечения из растительного сырья эфирных масел, алкалоидов и других веществ.
Тепловые эффекты процессов растворения газов, жидких и твердых веществ.
Растворение вещества в воде сопровождается, во-первых, разрушением химических связей между молекулами (межмолекулярные связи в ковалентных веществах) или между ионами (в ионных веществах), и, таким образом, частицы вещества смешиваются с водой (в которой также разрушается часть водородных связей между молекулами). Разрыв химических связей совершается за счет тепловой энергии движения молекул воды, при этом происходит затрата энергии в форме теплоты. Во-вторых, попав в воду, частицы (молекулы или ионы) вещества подвергаются гидратации. В результате образуются гидраты – соединения неопределенного состава между частицами вещества и молекулами воды. Такой процесс сопровождается выделением энергии в форме теплоты за счет образования новых химических связей в гидратах. Алгебраическая сумма энергии кристаллической решетки (или энергии разрыва связей) растворяемого вещества и энергии гидратации ионов определяет суммарный тепловой эффект растворения. Растворение мб экзотермическим (растворение в воде серной кислоты, гидроксидов натрия может вызвать даже вскипание раствора), эндотермическим (стакан с водой, в котором быстро растворяют нитрат аммония, примерзает к влажной подставке) или термонейтральным (растворение бромида натрия практически не сопровождается изменением температуры).
Термодинамика процессов растворения. Энтропийный и энтальпийный факторы растворения твердых, жидких и газообразных веществ в жидкостях.
Согласно второму началу термодинамики при р, Т = const вещества самопроизвольно могут растворяться в каком-либо растворителе, если в результате этого процесса энергия Гиббса системы уменьшается, т. е.
ΔG = (ΔН – TΔS) < 0.
Величину ΔН называют энтальпийным фактором, а величину TΔS – энтропийным фактором растворения.
При растворении жидких и твердых веществ энтропия системы обычно возрастает (ΔS > 0), так как растворяемые вещества из более упорядоченного состояния переходят в менее упорядоченное. Вклад энтропийного фактора, способствующий увеличению растворимости, особенно заметен при повышенных температурах, потому что в этом случае множитель Т велик и абсолютное значение произведения TΔS также велико, соответственно возрастает убыль энергии Гиббса.
При растворении газов в жидкости энтропия системы обычно уменьшается (ΔS < 0), так как растворяемое вещество из менее упорядоченного состояния (большого объема) переходит в более упорядоченное (малый объем). Снижение температуры благоприятствует растворению газов, потому что в этом случае множитель Т мал и абсолютное значение произведения TΔS будет тем меньше, а убыль энергии Гиббса тем больше, чем ниже значение Т.
Стремление системы к минимальному содержанию внутренней энергии, т.е. к снижению энтальпии (энтальпийный фактор)
Стремление системы к увеличению энтропии (энтропийный фактор)
Дата добавления: 2020-04-25; просмотров: 678; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
