Механизм действия гемоглобин- оксигемоглобинового буфера.
Самая мощная буферная система. На ее долю приходится 75% всей буферной емкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислоты.
Состав гемоглобинового буфера можно выразить так: [HHb/KHb] [HHbO2/KHbO2]
Гемоглобиновая буферная система состоит из HHb гемоглобина, который является слабой кислотой и его калиевой соли [HHb/KHb] и оксигемоглобиновой буферной системы [HHbO2/KHbO2]
Системы гемоглобина и оксигемоглобина взаимопревращающиеся системы и работают как единое целое.
При насыщении гемоглобина кислородом гемоглобин становится более сильной кислотой – HНbО2 и увеличивает отдачу в раствор ионов водорода.
В капиллярах легких, гемоглобин присоединяет кислород и превращается в оксигемоглобин:
HHb + О2  HНbО2
HНbО2
Образование оксигемоглобина приводит к некоторому подкислению крови, вытеснению части угольной кислоты из бикарбонатов:
HНbО2 + КНСО3  КНbО2 + Н2СО3 (CO2 + H2O)
КНbО2 + Н2СО3 (CO2 + H2O)
Щелочной резерв крови понижается.
В периферических капиллярах большого круга кровообращения калиевая соль оксигемоглобина диссоциирует и гемоглобин эритроцитов отдает кислород тканям:
КНbО2  О2 + КНb
О2 + КНb
В результате способность гемоглобина связывать ионы водорода увеличивается. Одновременно в эритроциты поступает углекислый газ. Под влиянием фермента карбангидразы углекислый газ взаимодействует с водой с образованием угольной кислоты:
СО2 + Н2О  Н2СО3
Н2СО3
За счет угольной кислоты возникает избыток ионов водорода, который связывается с калиевой солью гемоглобина, отдавшей кислород:
КbHb + Н2СО3  К+ +
К+ + 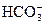 + HHb
+ HHb
В результате этого процесса накапливаются анионы 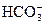 , которые выходят из эритроцитов в плазму. В обмен на ионы
, которые выходят из эритроцитов в плазму. В обмен на ионы 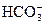 в эритроциты поступают ионы хлора, а натрий остается в плазме. В плазме повышается содержание бикарбоната и это способствует восстановлению щелочного резерва крови.
в эритроциты поступают ионы хлора, а натрий остается в плазме. В плазме повышается содержание бикарбоната и это способствует восстановлению щелочного резерва крови.
Значение фосфатного буфера для различных сред организма. Уравнение Гендерсона- Гассельбаха.
ФОСФАТНЫЙ БУФЕР
Под этим названием объединены свойства многих органических молекул, содержащих фосфатные группы: нуклеотиды, нуклеиновые кислоты, фосфосахара. Входящие в их состав остатки фосфорной кислоты способны протонироваться при ацидозе (закисление среды) и депротонироваться при алкалозе (защелачивание среды), обеспечивая эффективное поддержание рН в цитоплазме и ядре клеток. Например, ДНК состоит из тысяч нуклеотидов, объединенных в цепи. В каждом нуклеотиде есть фосфатная группа, несущая отрицательный заряд при физиологических рН, и готовая принять протоны при ацидозе. Органические фосфаты работают только внутри клеток.
СОСТАВ ФОСФАТНОГО НЕОРГАНИЧЕСКОГО БУФЕРА
NaН2РО4 Na2НРО4
Дигидрофосфат гидрофосфат натрия
кислотная компонента основная компонента
Этот буфер играет важную роль в поддержании рН внеклеточной жидкости и, особенно, слюны.
Н2РО4- -анионывыполняют роль слабой кислоты
НРО42- -анионы выполняют роль соли.
Так как рКа (Н2РО4-) = 6,86 в плазме крови при 36,6°С и
[НРО42-] = 1,6
[Н2РО4-]
из уравнения Гендерсона-Гассельбаха следует, что рН = 6,86 + lg1,6, т.е.
рН = 7,4.
Отношение [НРО42-] при рН = 7,4
[Н2РО4-]
не изменяется, т.к. при избыточном накоплении одного из компонентов, он выделяется с мочой.
Особенности фосфатного буфера. Буферная емкость фосфатной системы меньше, чем карбонатной:
bк = 1-2 ммоль-экв/л bщ = 0,5 ммоль-экв/л
Буферная емкость по кислоте и основанию имеет близкие значения, поэтому фосфатная система принимает участие в нейтрализации как кислых, так и основных продуктов метаболизма. В связи с малым содержанием фосфатов в плазме крови она менее мощная, чем гидрокарбонатная.
Основная роль фосфатного буфера заключается в выведении H+ в мочу. В почках:
НРО42-+ H+ = Н2РО4-
Образующийся дигидрофосфат-анион выделяется в мочу. Ежесуточно из организма экскретируется 30-40 ммоль ионов H+.
рН= рКа- lg(C(NaH2PO4)/ C(Na2HPO4))
Дата добавления: 2020-04-25; просмотров: 1528; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
