Окислительно-восстановительные потенциалы редокс-пар (редокс-потенциалы, электродные окислительно-восстановительные потенциалы)
· Стандартный ОВ потенциал – такой потенциал редокс пары, когда все участники ОВР находятся в стандартных состояниях, т.е. их активности равны единице.
1. Если Е0> 1В, то Ох-формы обладают системы обладают сильными окислительными свойствами.
2. Если Е0 < 1В, то Red-форма системы обладает сильными восстановительными свойствами.
3. Если Е0 = 1В, то система амфотерна, проявляет и восстановительные и окислительные свойства.
· Реальный условный ОВ потенциал – потенциал редокс пары при условии, что участники реакции находятся в реальных условиях, а не в стандартных состояниях.

· Электродный потенциал редокс-пары – это ЭДС гальванической цепи, составленной из данного ОВ электрода и стандартного водородного электрода.
Потенциал реакции (электродвижущая сила реакции)
ЭДС – величина, равная разности ОВ потенциалов редокс-пар (т.е. их электродных потенциалов)
ЭДС = Е0Ох - Е0 Red
Направление протекания Red - Ox реакции
Если потенциал Е ОВР больше нуля (Е=Е1-Е2>0), то реакция протекает в прямом направлении.
Если Е=Е1-Е2<0, то реакция протекает в обратном направлении.
Если Е=Е1-Е2=0, т.е. Е1=Е2, то система находится в состоянии устойчивого химического равновесия.
Влияние различных факторов на значения окислительно-восстановительных потенциалов и направление протекания окислительно-восстановительных реакций.
1. Посторонние электролиты.
· Увеличение ионной силы
|
|
|
· Уменьшение коэффициента активности (Если изменение коэфф. активности окисленной и восстановленной форм идут не одинаково, то Е изменяется)
· Влияют на скорость (Могут быть катализаторами)
2. Влияние рН среды
· Если в реакции принимают участие Н+
3. Влияние температуры (По уравнению Нернста)
4. Образование малорастворимых соединений
· Уменьшение концентрации окисленной и восстановленной форм
5. Комплексообразование
· Осиленные или восстановленные формы могут вместе связываться в комплекс, либо соединяются с ионами в присутствующем растворе
Глубина протекания окислительно-восстановительных реакций.
Чем больше стандартный потенциал реакции, тем выше ее константа равновесия и тем больше глубина протекания реакции. Другими словами, глубина протекания ОВР определяется разностью стандартных окислительно-восстановительных потенциалов редокс-пар, участвующих в реакции, т.е. разностью Е0=Е1-Е2
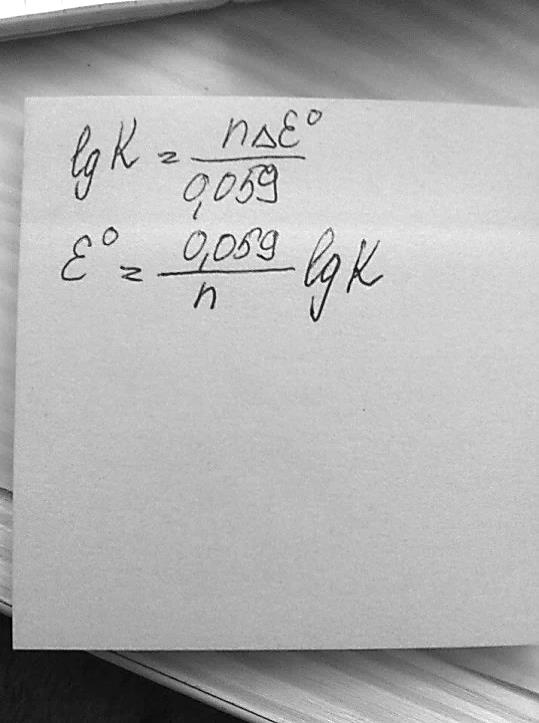
Использование окислительно-восстановительных реакций в химическом анализе
· В качественном анализе (например, при открытии одновалентных солей ртути)
· В количественном анализе (например, при гравиметрическом определении железа)
13. Общая характеристика комплексных (координационных) соединений металлов. Равновесия в растворах комплексных соединений. Константы устойчивости и константы нестойкости комплексных соединений. Условные константы устойчивости комплексов….
|
|
|
Комплексом называют частицу, образованную в результате донорно-акцепторного взаимодействия атома (иона), называемого центральным атомом или комплексообразователем и лигандами.
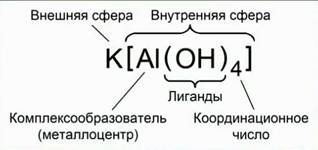
КЧ – количество связей, которые образует центральный атом со своими лигандами.
Дентантность – это число координационных связей, образуемых одним и тем же лигандом с одним атомом металла-комплексообразователя.
· Монодентатные лиганды.
· Бидентатные лиганды
· Полидентатные лиганды
Константа нестойкости
ML = M+L, Kн = [M][L]/[ML]
Kн = K1*K2*K3…
Полная константа нестойкости равна произведения констант ступеней.
Чем меньше Кн, тем прочнее комплекс.
Константа устойчивости
М+L = ML, K1 = [ML]/[M][L]
ML + L = ML2, K2 = [ML2]/[ML][L]
Произведение констант ступенчатого комлексообразования равно полной константе образования комплекса
К=К1 * К2 * К3…
Чем больше константа устойчивости, тем прочнее комплекс.
Дата добавления: 2020-04-25; просмотров: 1667; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
