Химическое равновесие. Константа химического равновесия (истинная термодинамическая, концентрационная). Условная константа химического равновесия.
Состояние химического равновесия характеризуется постоянством соотношения равновесных концентраций всех продуктов реакции и исходных веществ при постоянной температуре, динамичностью, подвижностью, возможностью самопроизвольного достижения равновесия с разных сторон – либо со стороны исходных веществ, либо со стороны продуктов реакции.
Принцип Ле-Шателье: если на систему, находящуюся в состоянии устойчивого химического равновесия, оказывать внешнее воздействие, то в системе начнут самопроизвольно осуществляться процессы в таком направлении, которое ослабляет влияние внешнего воздействия, а само равновесие сместиться в том же направлении.
Закон действующих масс: скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ, возведенных в степень их стехиометрических коэффициентов.

Условная константа в отличие от концентрационной зависит не только от температуры, но и от концентрации реагентов, ионной силы, концентрации других веществ, присутствующих в растворе, от рН раствора.
8. Гетерогенные равновесия в аналитической химии…
Гетерогенное равновесие – равновесие, устанавливающее на границе фаз (два типа: осадок какого-либо вещества, находящийся в равновесии с насыщенным раствором того же вещества и две равновесные жидкие фазы: водный раствор и орг. растворитель)
| Способы выражения растворимости малорастворимых электролитов
| |||
| Массовая растворимость вещества (Сm) – это масса растворенного вещества в граммах, содержащаяся в одном литре его насыщенного раствора. Сm = m/V (г/л) | Молярная растворимость вещества( S ) – количество растворенного вещества, содержащееся в 1 литре его насыщенного раствора. S = m/MV (моль/л) | ||
Произведение растворимости малорастворимого сильного электролита – это величина, равна произведению равновесных активностей (или равновесных концентраций) ионов данного электролита в его насыщенном растворе в степенях, равных соответствующим стехиометрическим коэффициентам.
BaSO4 = Ba2+ + SO42- (в растворе)
ПР (BaSO4) = а(Ba2+)а(SO42-) = [Ba2+][ SO42-]f(Ba2+)f(SO42-)
Условие образования осадков малорастворимых сильных электролитов
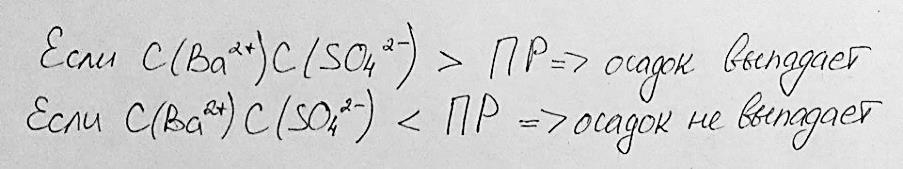
Дробное осаждение – последовательное осаждение ионов из анализируемого раствора при действии какого-либо общего реагента вследствие различной растворимости образующегося в результате реакции малорастворимого соединения. 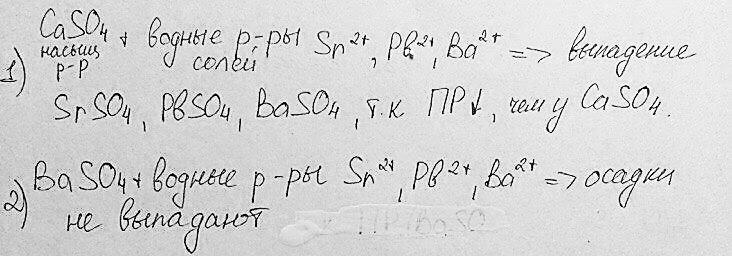
Дробное растворение – последовательное растворение ионов из осадка.
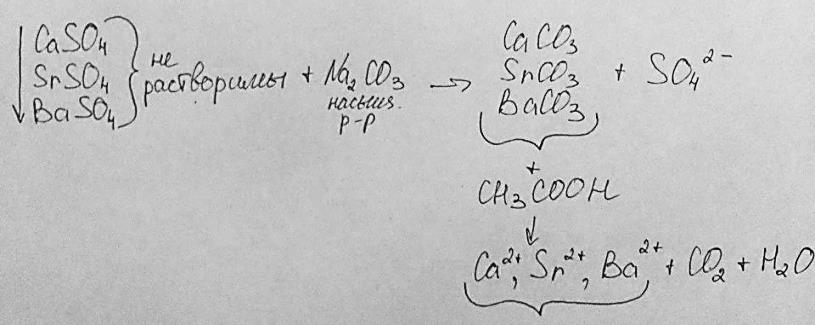
Перевод одних малорастворимых электролитов в другие
Дата добавления: 2020-04-25; просмотров: 730; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
