Эксергетический анализ процессов химической технологии.
В химической технологии, так же как и в теплотехнике, низкотемпературной технике применяемые процессы состоят, в основном, из ограниченного числа повторяющихся частных процессов. Поэтому изучение каждого из них в отдельности с точки зрения эксергетического анализа даст возможность получить базу для рассмотрения разнообразных технических систем.
Наиболее часто встречающиеся процессы могут быть сведены в следующие группы:
1. Сжатие газов и жидкостей.
2. Расширение газов и жидкостей.
3. Теплообмен.
4.Разделение смесей.
5.Сжигание топлива.
Рассмотрим последовательно каждую из перечисленных групп, используя методику анализа, представленную ранее.
Сжатие жидкостей и газов.
Сжатие рабочего тела в технических системах может происходить в различных температурных условиях:
1.Сжатие газа от начальной температуры, равной или близкой к T0. В этих условиях τе 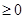 . Процесс характерен для химических технологий.
. Процесс характерен для химических технологий.
2.В паровых холодильных машинах сжатие производится от температуры ниже T0 и в конце процесса может не достигнуть T0 или переходит в область T>T0. Поэтому τе может быть как больше, так и меньше нуля.
3.При сжатии горячих газов температура в течение всего процесса выше T0 и τе>0.
4.В низкотемпературных (криогенных) установках весь процесс сжатия протекает при температурах, значительно более низких, чем T0. Здесь τе<0.
Для всех процессов сжатия, независимо от условия их проведения действительно уравнение эксергетического баланса:
|
|
|
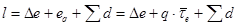
Работа l, затраченная в компрессоре или насосе, расходуется на повышение эксергии рабочего тела 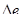 , на тепло (отвод от газа или подводимое к нему), эксергия которого равна
, на тепло (отвод от газа или подводимое к нему), эксергия которого равна 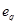 , и частично теряется на потери
, и частично теряется на потери  . Если процесс обратим
. Если процесс обратим 
Рассмотрим первый случай (τе  ):
):
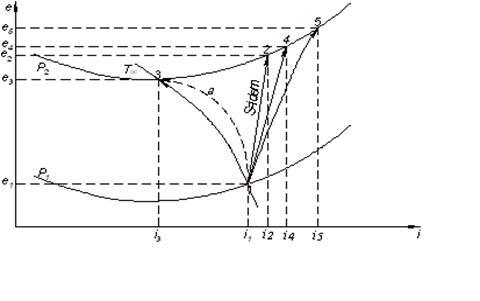
Рис.10.1. Процессы сжатия при τе  (Т≥Т0 )
(Т≥Т0 )
1-3 – обратимый изотермический процесс, температура остается постоянной, равной Т0. Эксергия eq, отводимая от газа в окружающую среду, eq = 0, т.к τе = 0
В необратимом изотермическом процессе температура газа отличается от Т0 в течение процесса. Но в начале и конце процесса температура равна Т0 (соблюдение конечных параметров). Следовательно, eq = 0.
Поэтому для изотермического процесса уравнение в общем случае получает вид:
lиз = Δе3-1 + Σd
В частности, когда процесс обратим, Σd = 0 и , следовательно,
lиз = Δе3-1
Таким образом, величина работы lиз обратимого изотермического процесса может быть без вычислений снята с i-e диаграммы рабочего тела, как разность значений эксергии в начальной и конечной точках процесса.
|
|
|
Определив расчетным или опытным путем действительную работу l изотермического одноступенчатого компрессора, можно по величине Δе3-1, подсчитать его изотермический КПД, равный
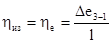
Величина потерь от необратимости определяется по следующей формуле:
Σd = l - Δе3-1
Величины е1 = 0, еq = 0 показаны условно линиями со стрелками.
При адиабатном сжатии баланс эксергии аналогичен балансу при изотермическом сжатии. В обратимом адиабатическом процессе теплообмен с окружающей средой отсутствует. Поэтому уравнение
l = Δe + eq + ∑d = Δe + q 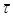 e + ∑d
e + ∑d
сохраняет вид.
Обратимое адиабатное сжатие изображается на рисунке прямой 1-4, идущей по линии s=const. Величина минимальной работы равна Δe1-4 = Δi1-4
На диаграмме видно, что Δe41 > Δe31. Превышение адиабатической работы над изотермической равно Δe3-4.
В реальном адиабатическом процессе часть работы компрессора затрачивается на трение и переходит в тепло, которое передается газу. Поэтому эксергия газа в конце процесса возрастает (точка 5). Однако, величина Δe5-3 не равна работе реального адиабатного процесса, а соответствует суммарной эксергии, которую нужно подвести к газу в виде работы и эксергии тепла, чтобы провести процесс 1-5 обратимо.
|
|
|
Действительная работа адиабатного процесса Δi5-1 больше, чем Δe5-1, т.к. тепло, сообщаемое газу, получается за счет работы, что ведет к потере эксергии.
Процесс сжатия 1-2 занимает промежуточное положение между изотермой и изоэнтропой и в отличие от процесса 1-5 проходит с отводом тепла.
Работа реального процесса 1-2 не может быть снята с диаграммы, так же как и работа, нужная для проведения любого необратимого процесса, за исключением адиабатного, когда δq = 0.
Количество затраченной работы при одном и том же начальном и конечном состояниях может быть больше или меньше: соответственно изменится только отвод тепла в окружающую среду.
Второй случай (τе >< 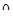 ):
):
Различные процессы сжатия показаны в е-i диаграмме.
Рис.10.3. Процессы сжатия при τе >< 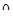
1-3 -адиабатическое сжатие;
1-4 -процесс сжатия, идущий при температуре T<T0;
4-3-процесс сжатия при температуре выше окружающей среды (τе > 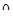 ).
).
Величина работы, необходимая для сжатия, равна Δe31
Так же как и в предыдущем случае, часть работы, затраченная на повышение температуры вещества на участке 4-3 бесполезно теряется, т.к. для дальнейшего процесса рабочее тело нужно будет снова охлаждать до Т0 (точка 5).
|
|
|
Поэтому более рационально вести процесс сжатия от точки 4 по изотерме 4-5. В этом случае будет сэкономлена работа Δe3-5. Общая затрата работы на сжатие в этом случае будет равна Δe5-1. Таким образом для второго случая, когда (τе >< 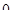 ) идеальным процессом сжатия будет адиабатное сжатие до точки Т0 и затем изотермическое сжатие до конечного давления.
) идеальным процессом сжатия будет адиабатное сжатие до точки Т0 и затем изотермическое сжатие до конечного давления.
КПД процесса
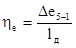 , где
, где
lд зависит от характера ведения процесса.
Третий случай: (τе>0)

Рис.10.4. Процессы сжатия для условия τе>0
1-2 – процесс изотермического сжатия. Обратимая работа этого сжатия может быть найдена по величинам е1 и е2 и формуле 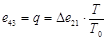
Тепло q, отводимое от сжимаемого газа при T>T0, может быть использовано для получения работы, величина которой в идеальном случае составит eq = qτe. Эта работа может быть реализована с целью уменьшения затрат на сжатие.
Общая минимальная работа, необходимая для проведения идеального процесса 1-2, составит
Δe2-1 = l - eq
Адиабатный обратимый процесс сжатия изображен линией 1-4.
При этом минимальная работа сжатия Δe4-1 = Δi4-1 больше, чем Δe2-1.
При необратимом адиабатном сжатии затрата работы l определяется величиной l = i5 – i1, а потеря
d=i5 –i1 – Δe5-1
Эксергетический КПД для адиабатной ступени определяется как
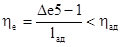
Действительный процесс сжатия с охлаждением компрессора изображается линией 1-3. Работа этого реального процесса по диаграмме определена быть не может, т.к. сжатие необратимо и сопровождается отводом тепла.
Четвертый случай (τе<0).
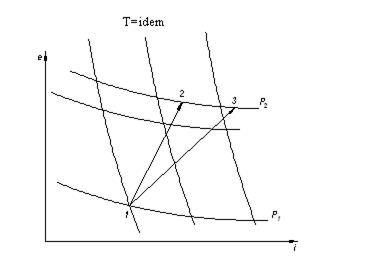
Рис. 10.5. Адиабатное сжатие при τе<0
Приведённые на рис. 10.5. изотермы соответствуют температурам значительно более низким, чем Т0.
Для обеспечения процесса сжатия при Т0 необходимо наличие охлаждающего устройства для отвода тепла от рабочего тела при T<Т0 и передачи его в окружающую среду. Такое сжатие в компрессоре с отводом тепла при Т<T0 в низкотемпературной технике не применяется.
Обратимое адиабатное сжатие соответствует линии 1-2 по изоэнтропе.
Реальный адиабатный процесс изображается линией 1-3.
КПД процесса определяется по формуле

Все изложенные закономерности в равной степени относятся и к сжатию жидкостей.
Лекция 7
Эксергетический анализ процессов расширения газов и жидкостей.
Процессы расширения по своему назначению и по термодинамическим характеристикам существенно различаются.
1.Расширение в высокотемпературных процессах предназначено для получения механической или электрической работы за счет уменьшения энтальпии рабочего тела.
Расширение без отдачи внешней работы – дросселирование используется только для регулирования и с термодинамической точки зрения нежелательно, т. к. всегда приводит к потерям.
2.В низкотемпературных системах расширение предназначено для охлаждения, получение работы является побочным результатом. Теплообмен с окружающей средой приводит не к понижению энтальпии, а к её повышению. Дросселирование во многих важных системах является основным процессом, обеспечивающим действие системы и в ряде случаев более эффективно, чем все другие известные методы.
1.Процессы расширения в высокотемпературных ( теплотехнических) системах
Расширение газов и паров при T>T0 с отдачей внешней работы применяется в различного рода турбинах (паровых, газовых). Во всех этих устройствах происходит получение электрической или механической работы за счет уменьшения как энтальпии так и эксергии потока газа или пара.
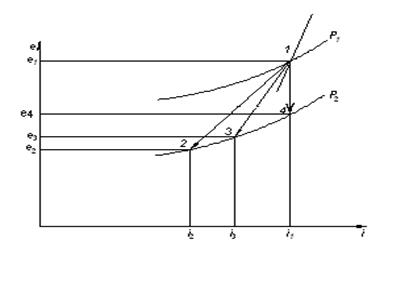
Рис.11.1. Процессы расширения рабочего тела при T>T0.
На рисунке 11.1. показаны различные процессы расширения рабочего тела. Процессы, протекающие при высоких температурах и давлениях в интервале P1 – P2, показаны линиями 1-2, 1-3, 1-4.
Процесс 1-2 представляет собой обратимое изоэнтропное расширение, при котором отводится работа (эксергия),
l1-2 = i1 – i2 = e1 – e2.
Процесс 1-3 - необратимое расширение, проходящее с увеличением энтропии и более быстрым падением эксергии.
Здесь отводится внешняя работа l1-3 < l1-2, которая определяется разностью энтальпий i1 - i3.
Снижение энтальпии  i1-3, равное отводимой работе l1-3, меньше, чем снижение эксергии
i1-3, равное отводимой работе l1-3, меньше, чем снижение эксергии  е1-3 (линия 1-3 проходит круче изотермы, для которой
е1-3 (линия 1-3 проходит круче изотермы, для которой  е =
е =  i)
i)
Процесс 1-4, протекающий по вертикальной прямой, полностью необратим. Это адиабатное дросселирование, при котором  i1-4 = 0 и внешняя работа вообще не отводится.
i1-4 = 0 и внешняя работа вообще не отводится.
Величина потери d возрастает от первого процесса к третьему. В первом (1-2) d1-2 = (e1 – e2) – (i1 – i2) =  е1-2 – l = 0; во втором (1-3) d1-3 =
е1-2 – l = 0; во втором (1-3) d1-3 =  е1-3 -
е1-3 -  i1-3 ; в третьем (1-4) d1-4 =
i1-3 ; в третьем (1-4) d1-4 =  е1-4 . Следовательно, в первом процессе вся эксергия переходит в работу; во втором в работу преобразуется только часть её, равная
е1-4 . Следовательно, в первом процессе вся эксергия переходит в работу; во втором в работу преобразуется только часть её, равная  е1-3 –d ; в третьем процессе вся израсходованная эксергия теряется и полученная работа равна нулю.
е1-3 –d ; в третьем процессе вся израсходованная эксергия теряется и полученная работа равна нулю.
КПД процесса расширения определяется отношением:
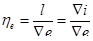 ;
;
Для процесса 1-2 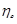 =1; для 1-4
=1; для 1-4 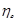 =0; для 1-3
=0; для 1-3 
Для практики наибольший интерес представляет реальный процесс 1-3, в котором 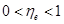
Процессы расширения в низкотемпературных системах.
Общая черта всех процессов расширения в низкотемпературных системах – это преобразование эксергии давления ер в эксергию ет, связанную с охлаждением.
В зависимости от способа расширения такое преобразование протекает по-разному. Оно может сопровождаться отводом энергии как в форме работы (адиабатный детандер), так и в форме тепла (неадиабатная вихревая труба); отводом энергии в виде работы с одновременным подводом энергии от охлаждаемого объекта в форме тепла (неадиабатный детандер); может вообще происходить без энергетического обмена (адиабатное дросселирование).
Эксергетический метод позволяет вывести единый для всех этих процессов КПД, позволяющий сравнивать их в сопоставимых условиях.
Эффектом всех процессов расширения является эффект охлаждения. В общем виде процесс расширения при низких температурах (Т<Toc,τе < 0) показан на рис. 11.2 в координатах е-i.
Рабочее тело из состояния, соответствующего точке 1 и давлению р1, расширяется до точки 2 (давление р2); его температура снижается от Т1 до Т2.
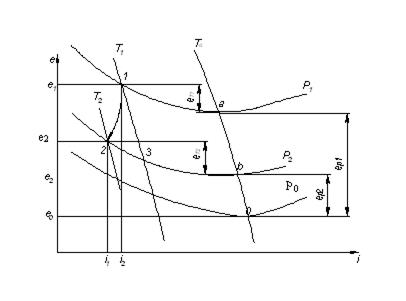
Рис.11.2. Обобщённый процесс расширения при Т<Toc
Эксергия рабочего тела уменьшалась от е1 = ет1 + ер1 до е2 = ет2 + ер2
При этом величина ер уменьшается от ер1 до ер2 величина ет возрастает от ет1 до ет2.. Такое превращение ер в ет возможно потому, что в области Т<Toc изобары имеют наклон, противоположный тому, который характерен для высокотемпературной области.
Эксергетический КПД превращения ер в ет составит:
 ηе = ∆ет / eр = (ет2 - ет1 ) / ( е р1 - ер2)
ηе = ∆ет / eр = (ет2 - ет1 ) / ( е р1 - ер2)
Преобразуем это уравнение к более удобному виду:
▼ eр = ер,1 - ер,2 = ▼еа,0 - ▼ еb,0 = ▼еа,b
∆ет = е Т,2 - еТ,1 = ∆е2,b - ∆е1,а = ∆еа,b - ∆е1,2
Отсюда
ηе = (∆еа,b - ∆е1,2 ) / ▼еа,b
Практически для вычисления КПД процессов расширения при Т<Toc целесообразно заменить величину ▼еа,b близкой ей величиной▼е1,3 – разностью эксергий между заданными давлениями по изотерме Т1 вместо То.с.. В этом случае
ηе = ∆е2,3 / ▼е1,3
Дросселирование
В теплотехнике сравнительно небольшое нагревание газа при дросселировании не находит технического применения, т.к. такой эффект всегда может быть получен более простым путём.
В технике низких температур охлаждение, полученное при дросселировании, служит основой большинства низкотемпературных процессов.
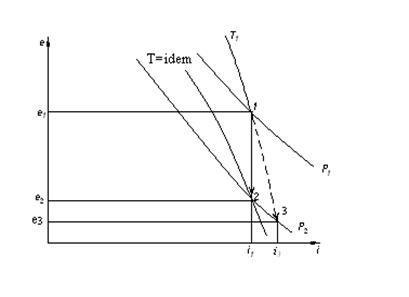
Рис.11.3. Процесс дросселирования в низкотемпературных системах, протекающий с охлаждением
На рисунке 11.3. изображен процесс дросселирования с охлаждением.
Точка 1 - начальное состояние при Т1, Р1;
Точка 2 - конечное состояние при Т2, Р2 .
При этом Т2<T1, прямая 1-2 – i = idem–процесс дросселирования.
Изменение эксергии при дросселировании определяется разностью её значений в начальной и конечной точках.
В процессе адиабатного дросселирования при отсутствии энергетического обмена работой тела с окружающей средой величина  е1-2 равна потере от необратимости
е1-2 равна потере от необратимости
 е1-2 = е1 –е2 =d
е1-2 = е1 –е2 =d
Эксергетический КПД процесса дросселирования определяется величиной
ηе = ∆е2-3 /  е1-3 ,
е1-3 ,
где т.3 определяется пересечением изотермы Т1 с изобарой р2.
Лекция №8
Дата добавления: 2020-01-07; просмотров: 292; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
