Основные термодинамические и кинетические величины
| Параметр | Обозначение, единицы измерения | Смысловое значение |
| Внутренняя энергия | U, кДж/моль | Полная энергия системы, равная сумме потенциальной, кинетической и других видов энергии всех частиц этой системы. Это функция состоя- ния, приращение которой равно те- плоте, полученной системой в изо- хорном процессе |
| Работа | A, кДж/моль | Энергетическая мера направ-ленных форм движения частиц в процессе взаимо-действия системы с окру- жающей средой |
| Теплота | Q, кДж/моль | Энергетическая мера хаоти-ческих форм движения частиц в процессе взаимо-действия системы с окру- жающей средой |
| I закон термодина- мики | Q = U + A | Теплота, подведенная к закрытой системе расходуется на увеличение внутренней энергии систем и на со- вершение системой работы против внешних сил окружающей среды |
| Энтропия | S, Дж/(моль K)
S=Q/T
S o S o 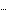 р ции i i ( прод. р -ции )
i S о
i (исх. в-в )
р ции i i ( прод. р -ции )
i S о
i (исх. в-в )
| Функция состояния, характеризую- щая меру неупорядоченности сис- темы, т.е. неоднородности располо- жения и движения ее частиц, при- ращение которой равно теплоте, подведенной к системе в обратимом изотермическом процессе, деленной на абсолютную температуру, при которой осуществляется процесс |
| Энтальпия | H, кДж/моль H = U + pV H = U + p V | Функция состояния, характеризую- щая энергетическое состояние сис- темы в изобарно-изотермических условиях |
| Энтальпия реакции | Hр-ции, кДж/моль | Количество теплоты, которое выде- ляется или поглощается при прове- дении химических реакций в изо- барно-изотермических условиях |














|
|
|
| Параметр | Обозначение, единицы измерения | Смысловое значение |
| Стандарт- ные усло- вия | с.у. | Давление: 101325 Па = 760 мм рт.ст., температура: 25 С 298 K |
| Стандарт- ная энталь- пия образова- ния про- стых веществ | H 0 обр 298 (в-во, агрегатное состояние), кДж/моль | При с.у. принимается равной нулю для про- стых веществ в их наи- более термодинамически устойчивом агрегатном и аллотропном состоянии |
| Стандарт- ная энталь- пия образова- ния слож- ных веществ | H 0 обр 298 (в-во, агрегатное состояние), кДж/моль | Это энтальпия реакции об- разования 1 моль этого вещества из простых ве- ществ в с.у. |
| Стандарт- ная энталь- пия сгора- ния | H 0 Х сгор кДж/моль | Это энтальпия сгорания (окисления) 1 моль веще- ства до высших оксидов в среде кислорода при с.у. |
| Энтальпия растворе- ния | Нр-ния, кДж/моль
_
Нр-ния = c m р ра Т M в ва ,
m в - ва
 где с – теплоемкость раствора
где с – теплоемкость раствора
| Тепловой эффект раство- рения твердого вещества в изобарных условиях |
| Энергия Гиббса | G, кДж/моль, G = H – T S G = H – T S G o G о G о р ции i i ( прод. р ции ) i i (исх. в в ) | Свободная энергия, обоб- щенная термодинамиче- ская функция состояния системы, учитывающая энергетику и неупорядо- ченность системы в изо- барно-изотермических ус- ловиях |



















|
|
|
| Параметр | Обозначение, единицы измерения | Смысловое значение |
| Константа равновесия химической реакции | Kравн, (моль/л) v, где v зависит от значений сте- хиометрических коэффициен- тов веществ. Для реакции аА + bВ сС + dD [C] c [D] d Kравн = a b . [A] [B] | Равна отношению произведе- ния равновесных концентра- ций продуктов реакции к про- изведению равновесных кон- центраций реагентов в степе- нях, равных стехиометриче- ским коэффициентам |
| Уравнение изотермы Вант-Гоффа | Для обратимой реакции
аА + bВ сС + dD
Gр-ции = Gо -ции +
р
d  c
+ R T ln с (D) c (C) c
+ R T ln с (D) c (C)
 c a (A)
c a (A)  c b (B)
Gор-ции = –R Т lnKравн
Gр-ции = –R Т lnKравн +
+ RTln с d (D) c c (C)
c a (A) c b (B)
Gор-ции = –R Т lnKравн
Gр-ции = –R Т lnKравн +
+ RTln с d (D) c c (C)
c a (A)  c b (B)
Gр-ции =
RT с d (D) c c (C)
ln ln K
c a (A) c b (B) равн. c b (B)
Gр-ции =
RT с d (D) c c (C)
ln ln K
c a (A) c b (B) равн.
| Позволяет рассчитать энергию Гиббса при заданных значени- ях концентраций реагентов и продуктов реакции |
| Закон дейст- вующих масс для кинетики | = k cnA(A) cnB(B) | Скорость реакции пропорцио- нальна произведению концен- траций реагирующих веществ в степенях, которые называ- ются порядками реакции по соответствующим веществам |
| Порядок реакции по веществу | ni | Показатель степени, в которой входит концентрация реагента в уравнение для скорости хи- мической реакции. Порядок может быть любой величиной: целой, дробной, положитель- ной, нулем, отрицательной и даже переменной величиной, зависящей от глубины проте- кания реакции |
















|
|
|
| Параметр | Обозначение, единицы измерения | Смысловое значение |
| Общий порядок реакции | n = nA + nB + … | Сумма порядков реакции по всем реагентам |
| Средняя скорость реакции | , моль/(л с) 1 c i v i | Усредненная скорость реакции за данный промежуток времени; vi, – стехиометрический коэффициент ве- щества в реакции |
| Средняя скорость реакции по веществу | i , моль/(л с) c i i | Усредненная скорость по веществу за данный промежуток времени |
| Истинная скорость реакции | , моль/(л с) 1 dc i v i d | Характеризует скорость реакции в данный момент времени ( ); vi, – стехиометрический коэффициент вещества в реакции |
| Истинная скорость реакции по веществу | i , моль/(л с) dc i i d | Характеризует скорость по веществу в данный момент времени ( ) |
| Константа скорости реакции | k, с–1 – для реакций 1-го порядка; л/(моль с) – для реак- ций 2-го порядка | Индивидуальная характеристика ре- акции, численно равна скорости ре- акции при концентрациях реагентов, равных 1 моль/л |
| Энергия активации | Ea, кДж/моль | Минимальная избыточная энергия взаимодействующих частиц, доста- точная для того, чтобы эти частицы вступили в химическую реакцию |
| Период полу- превращения | 1/2, сек, мин, час, сутки | Время, за которое концентрация реа- гирующего вещества уменьшается вдвое |
| Период полураспада | 1/2, сек, мин, часы, сутки, годы | Время, за которое количество ради- активного вещества уменьшается в 2 раза |
| Кинетическое уравнение для реакций 1-го порядка (интегральная форма) | с = со e–k lnc = lnco – kt ln 2 k 1 / 2 | Уравнение линейно относительно пе- ременных lnc и t. k – константа ско- рости реакции 1-го порядка; со – кон- центрация исходного вещества в на- чальный момент времени; с – теку- щая концентрация исходного вещест- ва в момент времени t; t – время, прошедшее от начала реакции |
















|
|
|
| Параметр | Обозначение, единицы измерения | Смысловое значение |
| Правило Вант-Гоффа | Т 2 Т1
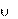  10
2 1
Т 2 Т1
k k 10
2 1
где – температурный коэффициент скорости реакции;
1 и 2 – скорости реак- ции при температуре Т1
и Т2 соответственно 10
2 1
Т 2 Т1
k k 10
2 1
где – температурный коэффициент скорости реакции;
1 и 2 – скорости реак- ции при температуре Т1
и Т2 соответственно
| С увеличением температуры на каж- дые 10 градусов скорость химической реакции возрастает в 2-4 раза. (Для биохимических реакций 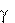 достигает значений 7-9) достигает значений 7-9)
|
| Уравнение Аррениуса | E a
k  A A  e RT ,
где k – константа ско- рости реакции,
А - предэкспоненциаль- ный множитель,
Еа – энергия активации
E
ln k ln A a
RT
k E 1 1
ln 2 a
k1 R T2 T1
k E T T
ln 2 a 1 2
k1 R T1 T2
Если А – const, то
k E e RT ,
где k – константа ско- рости реакции,
А - предэкспоненциаль- ный множитель,
Еа – энергия активации
E
ln k ln A a
RT
k E 1 1
ln 2 a
k1 R T2 T1
k E T T
ln 2 a 1 2
k1 R T1 T2
Если А – const, то
k E  E
ln 2 a 2 a1
k1 RT E
ln 2 a 2 a1
k1 RT
| Устанавливает связь между констан- той скорости реакции, энергией акти- вации и температурой |
2. 




 Термодинамические свойства некоторых веществ, применяемых в медицине
Термодинамические свойства некоторых веществ, применяемых в медицине


|
|
стандартное изменение энергии Гиббса при образовании сложного вещества
|
 Дж/(моль К);
Дж/(моль К);
к – кристаллическое состояние; ж – жидкое состояние; г – газообразное со- стояние; aq – вещество (ион) в водном растворе.
| Вещество или ион | Состояние | H о обр | G о обр | S о 298 |
| AgCl | к | –127 | –109,7 | 96,1 |
| AgNO3 | к | –123 | –32,2 | 141 |
| Ag2O | к | –30,6 | –10,8 | 122 |
| Al | к | 0 | 0 | 28,3 |
| Al3+ | aq | –525 | –481 | –313 |
| Al2O3 | корунд | –1670 | –1576 | 51 |
| Al2O3 3H2O | к | –2568 | –2292 | 140 |
| B2O3 | к | –1264 | –1184 | 54 |
| H3BO3 | к | –1089 | –963 | 89,6 |
| H3BO3 | aq | –1068 | –963 | 160 |
| Ba2+ | aq | –538 | –561 | 12,6 |
| BaCl2 | к | –860 | –811 | 126 |
| BaCl2 2H2O | к | –1462 | –1296 | 203 |
| BaSO4 | к | –1465 | –1353 | 132 |
| Br2 | ж | 0 | 0 | 152 |
| Br2 | г | 30,7 | 3,1 | 245 |
| C | графит | 0 | 0 | 5,7 |
| C | алмаз | 1,9 | 2,9 | 2,4 |
| CO | г | –111 | –137 | 198 |
| CO2 | г | –393,5 | –394,4 | 214 |
| CO2 | aq | –413 | –386 | 121 |
| H2CO3 | aq | –700 | –623 | 187 |
| HCO 3 | aq | –691 | –587 | 95 |
| CO 2 3 | aq | –676 | –528 | –53 |
| Ca2+ | aq | –543 | –553 | –55 |
| CaO | к | –636 | –603 | 40 |
| Ca(OH)2 | к | –987 | –897 | 76 |
| CaSO4 | к | –1432 | –1320 | 107 |
| CaSO4 2H2O | к | –1762 | –1565 | 194 |
| CaCl2 | к | –795 | –750 | 114 |
| CaCl2 | aq | –878 | –815 | 55 |
| CaCl2 6H2O | к | –2607 |








| Вещество или ион | Состояние | H о обр | G о обр | S о 298 |
| CaCO3 | к | –1207 | –1129 | 93 |
| Cl2 | г | 0 | 0 | 223 |
| Cl2O | г | 76 | 94 | 266 |
| HCl | г | –92,3 | –95,3 | 186,7 |
| HCl | aq | –167 | –131 | 55 |
| COCl2 | г | –219,5 | –205,31 | 283,64 |
| CrO 2 4 | aq | –863 | –706 | 38,5 |
| Cr2O 2 7 | aq | –1461 | –1257 | 214 |
| Сu2+ | aq | 64,4 | 65 | 99 |
| CuCl | к | –136 | –118 | 84,5 |
| CuCl2 | к | –206 | ||
| CuSO4 | к | –770 | –662 | 113 |
| CuSO4 5H2O | к | –2278 | –1880 | 305 |
| F– | aq | –329 | –276 | –9,6 |
| HF | г | –269 | –271 | 174 |
| Fe | к | 0 | 0 | 27,2 |
| Fe2+ | aq | –88 | –85 | –113 |
| Fe3+ | aq | –48 | –11 | –293 |
| Fe(OH)3 | к | –824 | ||
| FeCO3 | к | –753 | –680 | 96 |
| FeCl3 | к | –405 | ||
| FeCl3 6H2O | к | –2226 | ||
| FeSO4 | к | –923 | –820 | 108 |
| FeSO4 7H2O | к | –3007 | ||
| H2 | г | 0 | 0 | 131 |
| H+ | aq | 0 | 0 | 0 |
| OH– | aq | –230 | –157 | –10,5 |
| H2O | ж | –286 | –237 | 70 |
| H2O | г | –242 | –229 | 189 |
| H2O2 | ж | –188 | –120,5 | 109,6 |
| H2O2 | г | –191 | –107,74 | 234,4 |
| Hg | ж | 0 | 0 | 77 |
| Hg | г | 61 | 32 | 175 |
| Hg2+ | aq | –165 | ||
| HgCl2 | к | –230 | –177 | |
| Hg2Cl2 | к | –265 | –211 | 196 |
| HgO | к | –90 | –58,4 | 73 |
| K+ | aq | –251 | –282 | 103 |
| KОН | aq | –477 | –441 | 92 |
| KAl(SO4)2 12H2O | к | –6057 | –5137 | 687 |
| KBr | к | –392 | –379 | 96 |
| KBr | aq | –372 | –385 | 183 |







| Вещество или ион | Состояние | H о обр | G о обр | S о 298 |
| KCl | к | –436 | –408 | 83 |
| KCl | г | –216 | –235 | 239,5 |
| KCl | aq | –419 | –413 | 158 |
| KClO3 | к | –391 | –290 | 143 |
| KI | к | –328 | –322 | 104 |
| KI | aq | –307 | –334 | 212 |
| KNO3 | к | –493 | –393 | 133 |
| KNO3 | aq | –458 | –393 | 291 |
| KMnO4 | к | –813 | –714 | 172 |
| K2SO4 | к | –1438 | –1320 | 176 |
| Li+ | aq | –278 | –294 | 14 |
| LiOH | к | –487 | –444 | 50 |
| Li2CO3 | к | –1215 | –1130 | 90 |
| Mg2+ | aq | –462 | –456 | –118 |
| MgCO3 | к | –1113 | –1029 | 66 |
| MgCl2 | к | –642 | –592 | 89,5 |
| MgCl2 6H2O | к | –2500 | –1279 | 366 |
| MgO | к | –602 | –570 | 27 |
| Mg(OH)2 | к | –925 | –834 | 63 |
| MgSO4 | к | –1278 | –1174 | 91,6 |
| MgSO4 7H2O | к | –3384 | ||
| Mn2+ | aq | –219 | –223 | –84 |
| MnSO4 | к | –1064 | –956 | 112 |
| N2 | г | 0 | 0 | 191,5 |
| NH3 | г | –46,2 | –16,6 | 192,5 |
| NH3 | aq | –80,8 | –26,6 | 110 |
| NH 4 | aq | –133 | –79,5 | 113 |
| NH4Cl | к | –315 | –204 | 94,6 |
| (NH4)2SO4 | к | –1179 | –900 | 220 |
| N2O | г | 81,5 | 103,6 | 220 |
| NO | г | 90,4 | 86,7 | 210,6 |
| NO2 | г | 33,8 | 51,8 | 240,5 |
| N2O4 | г | 9,7 | 98,3 | 304,3 |
| HNO2 | aq | –119 | –56 | 153 |
| HNO3 | ж | –173 | –80 | 155 |
| NO 3 | aq | –207 | –114 | 146 |
| Na | к | 0 | 0 | 51 |
| Na+ | aq | –240 | –262 | 60 |
| Na2CO3 | к | –1131 | –1048 | 136 |
| Na2CO3 10H2O | к | –4082 | –3906 | |
| NaHCO3 | к | –948 | –852 | 102 |
| NaF | к | –569 | –541 | 59 |












| Вещество или ион | Состояние | H о обр | G о обр | S о 298 |
| NaCl | к | –411 | –384 | 72 |
| NaNO2 | к | –359 | ||
| NaNO3 | к | –425 | –366 | 116 |
| NaOH | к | –427 | –380 | 60 |
| Na2SO3 | к | –1117 | –1043 | 146 |
| Na2SO4 | к | –1384 | –1267 | 149 |
| Na2SO4 10H2O | к | –4324 | –3644 | 593 |
| Na2S2O3 5H2O | к | –2602 | ||
| O2 | г | 0 | 0 | 205 |
| O3 | г | 142 | 163 | 238 |
| P4 | белый | 0 | 0 | 44,4 |
| P | красный | –18,4 | ||
| PCl3 | г | –306 | –286 | 312 |
| PCl5 | г | –399 | –325 | 353 |
| H2PO 4 | aq | –1302 | –1135 | 89 |
| HPO 2 4 | aq | –1299 | –1094 | –36 |
| PO 3 4 | aq | –1284 | –1026 | –218 |
| P2O 4 7 | aq | –2276 | ||
| PbO | к | –218 | –188 | 69 |
| PbO2 | к | –277 | –219 | 77 |
| Pb(CH3COO)2 | к | –964 | ||
| Pb(CH3COO)2 3H2O | к | –1854 | ||
| S | ромбич. | 0 | 0 | 32 |
| S | монокл. | 0,3 | 0,1 | 32,6 |
| SO2 | г | –297 | –300 | 249 |
| SO3 | г | –395 | –370 | 256 |
| H2S | г | –20 | –33 | 206 |
| H2SO4 | aq | –907 | –742 | 17 |
| HSO 4 | aq | –886 | –753 | 127 |
| SO 2 4 | aq | –907 | –742 | 17,2 |
| SiO2 | кварц | –859 | –805 | 42 |
| ZnO | к | –348 | –318 | 44 |
| ZnCl2 | к | –416 | –369 | 108 |
| ZnSO4 | к | –979 | –872 | 125 |
| ZnSO4 7H2O | к | –3076 | –2560 | 387 |
| Органические вещества | ||||
| СН4 | г | –75 | –51 | 186 |
| С2Н2 | г | 227 | 209 | 201 |
| С2Н4 | г | 52 | 68 | 219 |
| С2Н6 | г | –107 | –33 | 229 |
| Вещество или ион | Состояние | H о обр | G о обр | S о 298 |
| С6Н6 | ж | 49 | 125 | 173 |
| СН3Cl | г | –82 | –59 | 234 |
| CH2Cl2 | г | –88 | –59 | 271 |
| CHCl3 | г | –100 | –67 | 296 |
| CCl4 | г | –107 | –64 | 309 |
| CH3Br | г | –35,6 | –26 | 246 |
| CH2Br2 | г | –4,2 | –5,9 | 294 |
| CHBr3 | г | 25 | 16 | 331 |
| CBr4 | г | 50 | 36 | 358 |
| CH3OH | ж | –239 | –166 | 127 |
| C2H5OH | ж | –278 | –175 | 161 |
| С2Н5ОС2Н5 | ж | –279,49 | –123,05 | 253,13 |
| С2Н5ОС2Н5 | г | –252,21 | –122,39 | 342,67 |
| Глицерин | ж | –671 | –479 | 205 |
| Формальдегид | г | –116 | –110 | 219 |
| Ацетальдегид | г | –166 | –134 | 265 |
| Ацетон | ж | –247 | –154 | 199 |
| НСООН | ж | –410 | –346 | 129 |
| НСОО– | aq | –410 | –335 | 92 |
| СН3СООН | ж | –487 | –392 | 160 |
| СН3СОО– | aq | 489 | –404 | 205 |
| С3Н7СООН | ж | –535 | –376 | 226 |
| С3Н7СОО– | к | –536 | –372 | 202 |
| Глюкозо-1-фосфорная кислота | aq | –1789,5 | ||
| Нитробензол | ж | 16 | 146 | 224 |
| Анилин | ж | 31 | 149 | 191 |
| Глицин | к | –537 | –378 | 103,5 |
| Глицин | aq | –523 | –380 | 158,6 |
| Цистеин | к | –532,6 | –342,7 | 169,9 |
| L-лейцин | aq | –643,4 | –352,3 | 207,5 |
| D,L-лейцилглицин | aq | –464 | ||
| Глицилглицин | aq | –734,3 | 492,1 | 231,4 |
| Пируват-ион | aq | –596,2 | –472,4 | 171,5 |
| L-молочная кислота | aq | –686 | –539 | 222 |
| Сахароза | к | –2222 | –1545 | 360 |
| D-глюкоза | aq | –1263,8 | –917,0 | 269,5 |
| D-глюкоза | к | –1274,5 | –910,6 | 212,1 |
3. 


|
, кДж/моль) некоторых веществ
Дата добавления: 2019-11-25; просмотров: 276; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
