Нормальные величины суточной потребности в энергии для городского на- селения в зависимости от рода деятельности
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА.
БИОЭНЕРГЕТИКА.
|
Тема: ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ, ТЕРМОХИМИИ. ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ РАСТВОРЕНИЯ ВЕЩЕСТВА
 Система – это тело или групп тел, находящихся во взаимодей- ствии, реально или мысленно обособленных от окружающей среды и подвергнутых изучению, рассматривающиеся как со- вокупность большого числа частиц.
Система – это тело или групп тел, находящихся во взаимодей- ствии, реально или мысленно обособленных от окружающей среды и подвергнутых изучению, рассматривающиеся как со- вокупность большого числа частиц.
Классификация термодинамических систем
В зависимости от однородности различают системы гомоген- ные и гетерогенные.
С И С Т Е М Ы


Гомогенные, однофазные гетерогенные, двух- и более фазные
(однородные) (разнородные)
Например: воздух, вода, истинные растворы
Например: цельная кровь, молоко
В зависимости от характера взаимодействия с окружающей средой различают системы изолированные, закрытые и открытые.


 С И С Т Е М Ы
С И С Т Е М Ы
Открытые закрытые изолированные
обмениваются с окру- жающей средой и ве- ществом, и энергией
обмениваются с окру- жающей средой энер- гией, но не вещест- вом
отсутствует обмен энергией и веществом с окружающей средой
Например: живой организм
Например: теплообменники в природе не существует,
модель - термостат
В термодинамике различают три состояния системы: равновес- ное, стационарное и переходное.


 СОСТОЯНИЕ СИСТЕМЫ
СОСТОЯНИЕ СИСТЕМЫ
Равновесное стационарное
|
|
|
Переходное
постоянство свойств во времени, отсутст- вие потоков вещества и энергии в системе
постоянство свойств во времени за счет непрерыв- ного обмена веществом и энергией между системой и окружающей средой
изменение свойств сис- темы во времени
 Для живого организма характерно стационарное состояние.
Для живого организма характерно стационарное состояние.
Состояние системы характеризуется параметрами.
 Параметры системы – совокупность физических и химиче- ских величин, характеризующих состояние системы.
Параметры системы – совокупность физических и химиче- ских величин, характеризующих состояние системы.
Параметры системы подразделяют на экстенсивные и интенсив- ные.
ПАРАМЕТРЫ СИСТЕМЫ


Экстенсивные
величины, зависящие от числа частиц в системе Например: масса (m), объем
(V), количество вещества (n)
Интенсивные
величины, не зависящие от числа частиц в системе
Например: температура (T), давление (р), концентрация (с)
При взаимодействии систем значения экстенсивных парамет- ров суммируются, а интенсивных – усредняются.
Например, при смешивании горячего кофе и холодного молока, объемы суммируются, а температура усредняется.
Наряду с параметрами для характеристики состояния системы используют функции состояния.
Функции состояния – экстенсивные величины, которые нель- зя непосредственно измерить экспериментально, характеризующие состояние системы. Их значения зависят только от данного состоя- ния системы и не зависят от того, каким путем это состояние дос- тигнуто. К функциям состояния относятся: внутренняя энергия (U), энтальпия (Н), энтропия (S), свободная энергия Гиббса (G).
|
|
|
Переход системы из одного состояния в другое является про- цессом.

 Процесс – переход системы из одного состояния в другое, со- провождающийся необратимым или обратимым изменением хотя бы одного параметра, характеризующего данную систему.
Процесс – переход системы из одного состояния в другое, со- провождающийся необратимым или обратимым изменением хотя бы одного параметра, характеризующего данную систему.
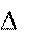
 =
=
изменение параметра
конечное значение параметра
начальное значение параметра

 П Р О Ц Е С С Ы
П Р О Ц Е С С Ы

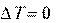 изотермический
изотермический
Изобарический изохорический
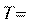 const,
const,
p const,
V const,
 | |||
 | |||


 Энергия – это количественная мера различных форм движения и взаимодействия всех видов материи.
Энергия – это количественная мера различных форм движения и взаимодействия всех видов материи.
Термодинамика рассматривает процессы взаимного перехода тепловой энергии в другие виды (механическую, химическую, электрическую и т.д.).
 Внутренняя энергия (U) системы – это сумма потенциальной энергии взаимодействия всех частиц системы между собой и кинетической энергии их движения.
Внутренняя энергия (U) системы – это сумма потенциальной энергии взаимодействия всех частиц системы между собой и кинетической энергии их движения.
|
|
|
Внутренняя энергия системы складывается из поступательно- го и вращательного движения молекул, энергии внутримолекуляр- ного колебательного движения атомов и атомных групп, состав- ляющих молекулы, энергии вращения электронов в атомах, энер- гии, заключающейся в ядрах атомов, энергии межмолекулярного взаимодействия и других видов энергии.
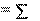 U U , кДж/моль
U U , кДж/моль
i
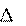 Внутренняя энергия – функция состояния, абсолютное значе- ние которой определить невозможно. так как любая термодинами- ческая система материальна, а материя – неисчерпаема. Экспери- ментально можно определить только изменение внутренней энер- гии в процессе взаимодействия системы с окружающей средой.
Внутренняя энергия – функция состояния, абсолютное значе- ние которой определить невозможно. так как любая термодинами- ческая система материальна, а материя – неисчерпаема. Экспери- ментально можно определить только изменение внутренней энер- гии в процессе взаимодействия системы с окружающей средой.
Обмен внутренней энергией между системой и окружающей средой может осуществляться в форме теплоты или работы.
 Работа (А или W) – энергетическая мера направленных форм движения частиц в процессе взаимодействия системы с окру- жающей средой.
Работа (А или W) – энергетическая мера направленных форм движения частиц в процессе взаимодействия системы с окру- жающей средой.
Работа А считается положительной, если совершается системой против внешних сил окружающей среды.
 Теплота (Q)– энергетическая мера хаотических форм движения частиц в процессе взаимодействия системы с окружающей сре- дой.
Теплота (Q)– энергетическая мера хаотических форм движения частиц в процессе взаимодействия системы с окружающей сре- дой.
В термодинамике количество теплоты Q считается положи- тельным, если теплота сообщается системе из окружающей среды.
|
|
|
Работа и теплота не являются функциями состояния, а являются функциями процесса, их величина зависит от пути процесса, по которому система перешла из одного состояния в другое.
I закон термодинамики
I закон термодинамики рассматривает обмен энергией между системой и окружающей средой в форме работы и теплоты. Впервые этот закон сформулировал немецкий врач Ю. Р. Майер (1842 г.), хотя фактически это закон сохранения энергии, который был сформулирован М.В. Ломоносовым еще в 1748 г.
 Энергия не исчезает и не возникает из ничего, а только пре- вращается из одного вида в другой в строго эквивалентных ко- личествах.
Энергия не исчезает и не возникает из ничего, а только пре- вращается из одного вида в другой в строго эквивалентных ко- личествах.
В зависимости от вида системы существуют различные фор- мулировки I закона термодинамики.
 Невозможно создать вечный двигатель (перпетуум мобиле) первого рода, т.е. осуществить работу, не израсходовав энер- гию.
Невозможно создать вечный двигатель (перпетуум мобиле) первого рода, т.е. осуществить работу, не израсходовав энер- гию.
 В изолированной системе изменение внутренней энергии сис- темы в результате любых процессов всегда равно нулю.
В изолированной системе изменение внутренней энергии сис- темы в результате любых процессов всегда равно нулю.

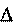
 Подведенная к закрытой системе теплота расходуется на изме- нение внутренней энергии системы и на совершение системой работы против внешних сил окружающей среды.
Подведенная к закрытой системе теплота расходуется на изме- нение внутренней энергии системы и на совершение системой работы против внешних сил окружающей среды.
Q = U + A
 Живые организмы функционируют в изобарно- изотермических условиях (р = const, T = const), для которых работа равна: A = р V, поэтому:
Живые организмы функционируют в изобарно- изотермических условиях (р = const, T = const), для которых работа равна: A = р V, поэтому:

 Q = U + р V;
Q = U + р V;




 U = Uкон Uнач; V = Vкон Vнач; Q = (Uкон Uнач) + р(Vкон Vнач);
U = Uкон Uнач; V = Vкон Vнач; Q = (Uкон Uнач) + р(Vкон Vнач);
Q = (Uкон рVкон) – (Uнач + рVнач); U + рV = H,
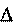 где Н – энтальпия, численно равна сумме внутренней энергии сис- темы и произведения давления на объем системы.
где Н – энтальпия, численно равна сумме внутренней энергии сис- темы и произведения давления на объем системы.
Q = Н кон – Н нач = H
 Энтальпия (Н) – термодинамическая функция, характеризую- щая энергетическое состояние системы при изобарно- изотермических условиях.
Энтальпия (Н) – термодинамическая функция, характеризую- щая энергетическое состояние системы при изобарно- изотермических условиях.
Химические реакции и физико-химические процессы могут протекать с выделением или поглощением энергии.
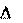
 Количество теплоты, которое выделяется или поглощается при проведении химической реакции в изобарно-изотермических условиях Qр равно изменению энтальпии системы и называется энтальпией реакции ( Нр-ции).
Количество теплоты, которое выделяется или поглощается при проведении химической реакции в изобарно-изотермических условиях Qр равно изменению энтальпии системы и называется энтальпией реакции ( Нр-ции).
Химические реакции и физико-химические процессы подраз- деляют на экзотермические и эндотермические процессы.
 Экзотермические процессы – процессы, в результате которых энергия выделяется из системы в окружающую среду.
Экзотермические процессы – процессы, в результате которых энергия выделяется из системы в окружающую среду.
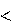

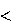
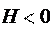 Для экзотермических процессов:
Для экзотермических процессов:
 Нкон Ннач, Н = (Нкон Ннач) 0,
Нкон Ннач, Н = (Нкон Ннач) 0, 
 Эндотермические процессы – процессы, в результате которых энергия поглощается системой из окружающей среды.
Эндотермические процессы – процессы, в результате которых энергия поглощается системой из окружающей среды.
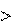

 Для эндотермических процессов:
Для эндотермических процессов:
 Нкон Ннач, Н = (Нкон Ннач) 0,
Нкон Ннач, Н = (Нкон Ннач) 0, 
Энтальпия системы является экстенсивным параметром и за- висит от температуры, давления, поэтому изменение энтальпии в результате химической реакции или физико-химического процесса определяют при стандартных условиях.
Стандартные условия (с.у.): количество вещества – 1 моль; давление – 760 мм. рт. ст. = 101 325 Па; температура – 298 K.
Термодинамические величины в с.у. обозначаются соответст- вующим символом этой величины с верхним индексом о и темпера- турой 298, указанной справа внизу.
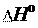
 – стандартная энтальпия процесса или реакции – энерге-
– стандартная энтальпия процесса или реакции – энерге-
298
тическая характеристика физико-химического процесса или
химической реакции, проводимых при с.у.
Для оценки энергетического состояния веществ в термодина- мике используются значения стандартных энтальпий образования этих веществ, обозначаемых:

|
298
(вещество, агрегатное состояние), кДж/моль.
 Стандартная энтальпия образования простых веществ в их наи- более термодинамически устойчивом агрегатном и аллотроп- ном состоянии при с.у. условно принимается равной нулю.
Стандартная энтальпия образования простых веществ в их наи- более термодинамически устойчивом агрегатном и аллотроп- ном состоянии при с.у. условно принимается равной нулю.

|
|
|
|
 Стандартная энтальпия образования сложного вещества равна энтальпии реакции получения 1 моль этого вещества из про- стых веществ при с.у.
Стандартная энтальпия образования сложного вещества равна энтальпии реакции получения 1 моль этого вещества из про- стых веществ при с.у.
Например, стандартная энтальпия образования этанола равна стандартной энтальпии реакции:
2С(графит) + 3Н2(г) + 1/2О2(г) = С2Н5ОН(ж);
 Но (С Н ОН, ж) = -278 кДж/моль.
Но (С Н ОН, ж) = -278 кДж/моль.
298 2 5
Значение стандартной энтальпии образования сложного веще- ства зависит от природы вещества и его агрегатного состояния. Чи- словые значения стандартных энтальпий образования веществ яв- ляются справочными данными и для некоторых веществ приведены в табл. 2 приложения.
Используя стандартные энтальпии образования веществ, уча- ствующих в химической реакции, можно, не прибегая к экспери- менту, рассчитать энтальпию реакции на основе закона Г.И. Гесса (1840 г.):


 Значение теплового эффекта процесса, протекающего в изо- барных ( Нр-ции) или изохорных ( Uр-ции) условиях, зависит только от начального и конечного состояния данной системы и не зависит от пути процесса.
Значение теплового эффекта процесса, протекающего в изо- барных ( Нр-ции) или изохорных ( Uр-ции) условиях, зависит только от начального и конечного состояния данной системы и не зависит от пути процесса.
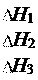 Например: С(тв) + О2(г) СО2(г)
Например: С(тв) + О2(г) СО2(г)
С(тв) + 1/2О2(г) СО(г) СО(г) +1/2О2(г) СО2(г)



 CO
CO
 H2 H3
H2 H3
Н1 = Н2 + Н3
C H1
CO2
Закон Гесса широко используется для расчета тепловых эф- фектов химических реакций, которые экспериментально опреде- лить невозможно.
Из закона Гесса вытекают следующие следствия.
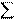

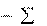
 1-е следствие используют для расчета энтальпии реакции по стандартным энтальпиям образования веществ.
1-е следствие используют для расчета энтальпии реакции по стандартным энтальпиям образования веществ.

|
р-ции
n Ho .(прод. р-ции)
n Ho .(исх. в-в) ,
|
|
|
|
 Энтальпия химической реакции при с.у. равна разности алгеб- раической суммы энтальпий образования продуктов реакции и алгебраической суммы энтальпий образования исходных веществ с учетом их стехиометрических коэффициентов:
Энтальпия химической реакции при с.у. равна разности алгеб- раической суммы энтальпий образования продуктов реакции и алгебраической суммы энтальпий образования исходных веществ с учетом их стехиометрических коэффициентов:
2-е следствие используют для расчета теплового эффекта ре- акции по стандартным теплотам сгорания веществ.
 Стандартная теплота сгорания вещества – это теплота, вы- деляющаяся при сгорании 1 моль вещества в кислороде до высших оксидов при стандартных условиях.
Стандартная теплота сгорания вещества – это теплота, вы- деляющаяся при сгорании 1 моль вещества в кислороде до высших оксидов при стандартных условиях.
Стандартные теплоты сгорания являются справочными вели- чинами и для некоторых веществ приведены в табл. 3 приложения.

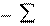
 Энтальпия реакции равна разности алгебраической суммы эн- тальпий сгорания исходных веществ и суммы энтальпий сгора- ния продуктов реакции с учетом их стехиометрических коэф- фициентов.
Энтальпия реакции равна разности алгебраической суммы эн- тальпий сгорания исходных веществ и суммы энтальпий сгора- ния продуктов реакции с учетом их стехиометрических коэф- фициентов.

|
р-ции
n Ho .(исх. в-в)
n Ho .(прод. р-ции) ,


|
|
|
|
Наиболее распространенными реакциями, используемыми живым организмом для получения энергии, являются реакции окисления.
 Энергия, выделяемая при полном окислении, т.е. сгорании пи- тательных веществ, называется их калорийностью.
Энергия, выделяемая при полном окислении, т.е. сгорании пи- тательных веществ, называется их калорийностью.
По закону Гесса, количество теплоты, которое выделяется при окислении питательных веществ, не зависит от того, как или где они окисляются, при условии, что продукты реакции остаются не- изменными.
Следовательно, для энергетической оценки большинства про- дуктов питания может служить энтальпия реакции их сгорания. Энергетическую характеристику продуктов питания принято вы- ражать в калориях:
1 кал = 4,18 Дж, соответственно, 1 ккал = 4,18 кДж
Удельные теплоты полного окисления основных компонентов пищевых продуктов приведены в табл. 4 приложения.
Пища представляет собой смесь питательных веществ слож- ного состава, поэтому калорийность пищи указывается в расчете на 1 г, а не на моль (кДж/г или ккал/г).
Нормальные величины суточной потребности в энергии для городского на- селения в зависимости от рода деятельности
(данные Института питания АМН СССР)
| Пол | Группы интенсивности труда и суточная потребность в энергии (ккал) | |||
| 1 | 2 | 3 | 4 | |
| Мужчины | 2600–2800 | 2800–3000 | 2900–3200 | 3400–3700 |
| Женщины | 2200–2400 | 2350–2550 | 2500–2700 | 2900–3150 |
Калорийность основных продуктов питания представлена в табл. 6 приложения.
Практическое значение при термохимических расчетах имеет также 3-е следствие, известное как закон Лавуазье-Лапласа:
 Тепловой эффект разложения какого-либо соединения равен и противоположен по знаку тепловому эффекту его образования.
Тепловой эффект разложения какого-либо соединения равен и противоположен по знаку тепловому эффекту его образования.

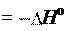 обр. разл.
обр. разл.
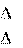 Например: Н2(г) + Cl2(г) = 2HCl(г) H = –184 кДж
Например: Н2(г) + Cl2(г) = 2HCl(г) H = –184 кДж
2HCl(г) = Н2(г) + Cl2(г) H = +184 кДж
4-е следствие:
 Если совершаются две реакции, приводящие из различных на- чальных состояний к одинаковым конечным состояниям, то разница между их тепловыми эффектами равна тепловому эф- фекту перехода из одного начального состояния в другое.
Если совершаются две реакции, приводящие из различных на- чальных состояний к одинаковым конечным состояниям, то разница между их тепловыми эффектами равна тепловому эф- фекту перехода из одного начального состояния в другое.
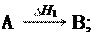 | 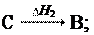 | 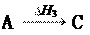 |
A

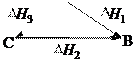


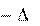 H3 = H1 H2
H3 = H1 H2
5-е следствие:
 Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным состояниям, то разница между их тепловыми эффектами представляет собой тепловой эффект перехода из одного конечного состояния в другое.
Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным состояниям, то разница между их тепловыми эффектами представляет собой тепловой эффект перехода из одного конечного состояния в другое.
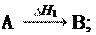 | 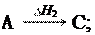 | 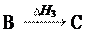 |
B
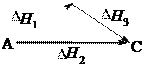


 H3 = H2 H1
H3 = H2 H1
В зависимости от типа химической реакции или физико- химического процесса, кроме энтальпий образования и сгорания, различают: энтальпию нейтрализации, энтальпию растворения, эн- тальпию гидратации, энтальпию фазового перехода.
 Энтальпия нейтрализации – количество теплоты, которое выделяется при взаимодействии 1 моль эквивалентов сильной кислоты с 1 моль эквивалентов сильного основания.
Энтальпия нейтрализации – количество теплоты, которое выделяется при взаимодействии 1 моль эквивалентов сильной кислоты с 1 моль эквивалентов сильного основания.
Нейтрализация любой сильной кислоты любой щелочью в вод- ном растворе описывается одним и тем же ионным уравнением:
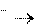

 Н+ + ОН Н2О Ho298 нейтр-ции = 55,8 кДж/моль
Н+ + ОН Н2О Ho298 нейтр-ции = 55,8 кДж/моль
 Энтальпия растворения – количество теплоты, которое выде- ляется при растворении 1 моль вещества в значительном из- бытке растворителя.
Энтальпия растворения – количество теплоты, которое выде- ляется при растворении 1 моль вещества в значительном из- бытке растворителя.
II закон термодинамики
II закон термодинамики определяет условия самопроизвольно- го протекания процессов. Установлено, что все самопроизвольные процессы реализуются под влиянием двух основных факторов:
1) стремления системы к достижению минимума энергии;
2) стремления системы к увеличению ее энтропии, т.е. возрас- танию беспорядка в ней.
 Энтропия (S) – термодинамическая функция, характеризую- щая меру неупорядоченности движения частиц системы, т.е. неоднородности расположения и перемещения ее частиц.
Энтропия (S) – термодинамическая функция, характеризую- щая меру неупорядоченности движения частиц системы, т.е. неоднородности расположения и перемещения ее частиц.
Для обратимого процесса:
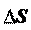

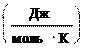 = Q ;
= Q ;
T
Для необратимого процесса:
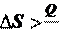 T
T
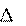 где S – изменение энтропии системы;
где S – изменение энтропии системы;
 Q – теплота, передаваемая системе;
Q – теплота, передаваемая системе;
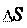
 Т абсолютная температура, при которой осуществляется процесс.
Т абсолютная температура, при которой осуществляется процесс.
Энтропия – экстенсивное свойство системы:
= Sкон Sнач
 Изменение энтропии как функции состояния можно рассчи- тать, используя следствие из закона Гесса:
Изменение энтропии как функции состояния можно рассчи- тать, используя следствие из закона Гесса:
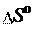
|
|
Sо(прод. р-ции)
Sо(исх. в-в),
где Sо – стандартная энтропия образования вещества.
Значения стандартных энтропий образования некоторых ве- ществ приведены в табл. 2 приложения.
Величина энтропии зависит: от агрегатного состояния, ал- лотропной формы, температуры, давления, сложности системы.
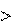
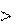
 Энтропия вещества в газообразном состоянии больше, чем эн- тропия его в жидком состоянии, а последняя больше энтропии этого вещества в твердом состоянии: Sг Sж Sтв.
Энтропия вещества в газообразном состоянии больше, чем эн- тропия его в жидком состоянии, а последняя больше энтропии этого вещества в твердом состоянии: Sг Sж Sтв.
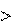
 Энтропия простых веществ зависит от их аллотропной формы:
Энтропия простых веществ зависит от их аллотропной формы:
S(графит) S(алмаз); S(O2) < S(O3)
 Энтропия системы при повышении температуры возрастает, так как увеличивается неупорядоченность движения частиц: если T1 > Т2, то S1 > S2
Энтропия системы при повышении температуры возрастает, так как увеличивается неупорядоченность движения частиц: если T1 > Т2, то S1 > S2
 Энтропия системы при повышении давления уменьшается, так как снижается неупорядоченность движения частиц:
Энтропия системы при повышении давления уменьшается, так как снижается неупорядоченность движения частиц:
если р1 > р2, то S1 < S2
С увеличением сложности системы энтропия повышается, так как возрастает число видов частиц и вариантов их расположения.
Энтропия – важнейший термодинамический параметр, кото- рый является не только мерой неупорядоченности расположения и движения частиц в системе, но и мерой связанной энергии, кото- рую система не может превратить в работу, критерием направления протекания самопроизвольного процесса, критерием глубины про- текания процесса (S = Smax).
Свойства энтропии позволяют проследить цепочку услож- няющихся образований от атомов элементов до белковых молекул, от неживой природы до живой клетки (рис. 2).
Существует несколько формулировок II закона термодинами-
ки:
 Теплота не может самопроизвольно переходить от менее нагре- того тела к более нагретому (Р. Клаузиус, 1850 г.).
Теплота не может самопроизвольно переходить от менее нагре- того тела к более нагретому (Р. Клаузиус, 1850 г.).
 Невозможно построить вечный двигатель второго рода, т.е. не- возможно теплоту полностью превратить в работу (В. Томсон)
Невозможно построить вечный двигатель второго рода, т.е. не- возможно теплоту полностью превратить в работу (В. Томсон)
 Все самопроизвольные процессы в макроскопических системах протекают в направлении от менее вероятного состояния к бо- лее вероятному состоянию системы (Л. Больцман)
Все самопроизвольные процессы в макроскопических системах протекают в направлении от менее вероятного состояния к бо- лее вероятному состоянию системы (Л. Больцман)
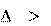
 В изолированных системах самопроизвольно могут совершать- ся только такие процессы, в которых энтропия системы возрас- тает: S 0.
В изолированных системах самопроизвольно могут совершать- ся только такие процессы, в которых энтропия системы возрас- тает: S 0.

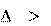
 В любой изолированной системе полная энергия остается по- стоянной, а полная энтропия со временем только повышается: U = 0, S 0.
В любой изолированной системе полная энергия остается по- стоянной, а полная энтропия со временем только повышается: U = 0, S 0.
Математическая форма второго начала термодинамики для изолированных систем:

 ≥ Q
≥ Q
T
Большинство биохимических реакций протекает в открытых системах и сопровождается одновременным изменением энтальпии и энтропии. Функцией состояния, одновременно учитывающей и энтальпию, и энтропию системы, является энергия Гиббса, которая связана с энтальпией и энтропией следующим уравнением:
G = H – TS, (кДж/моль)
 G – энергия Гиббса, изобарно-изотермический потенциал, обобщенная термодинамическая функция, характеризующая энергетическое состояние системы при постоянном давлении и температуре.
G – энергия Гиббса, изобарно-изотермический потенциал, обобщенная термодинамическая функция, характеризующая энергетическое состояние системы при постоянном давлении и температуре.

 Энергия Гиббса функция состояния: G = Gкон – Gнач
Энергия Гиббса функция состояния: G = Gкон – Gнач
|
(табл. 2 приложения).
 Стандартная энергия Гиббса образования простых веществ в термодинамически устойчивой форме условно принята равной нулю.
Стандартная энергия Гиббса образования простых веществ в термодинамически устойчивой форме условно принята равной нулю.
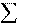

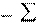
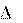 Изменение энергии Гиббса в результате химической реакции определяется:
Изменение энергии Гиббса в результате химической реакции определяется:

|
298 р-ции
n Go (прод. р-ции)
n Go298 (исх. в-в),
|
|
|
 Изменение энергии Гиббса для биохимических реакций в не- стандартных условиях можно рассчитывать на основе эксперимен- тальных данных по уравнению:
Изменение энергии Гиббса для биохимических реакций в не- стандартных условиях можно рассчитывать на основе эксперимен- тальных данных по уравнению:
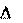
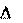
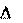 G = Н Т S,
G = Н Т S,
 где Н – характеризует полное изменение энергии системы в изо- барно-изотермическом процессе и отражает стремление сис- темы к минимуму энергии;
где Н – характеризует полное изменение энергии системы в изо- барно-изотермическом процессе и отражает стремление сис- темы к минимуму энергии;
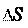 Т· – характеризует ту часть энергии, которую нельзя превра-
Т· – характеризует ту часть энергии, которую нельзя превра-
тить в работу (связанная энергия), и отражает стремление сис- темы к максимуму беспорядка;
 G – характеризует ту часть энергии системы, которую можно превратить в работу (свободная энергия).
G – характеризует ту часть энергии системы, которую можно превратить в работу (свободная энергия).
Изменение энергии Гиббса позволяет судить о возможности самопроизвольного протекания процессов.

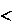
 В системе при постоянных температуре и давлении могут само- произвольно совершаться только такие процессы, в результате которых энергия Гиббса уменьшается
В системе при постоянных температуре и давлении могут само- произвольно совершаться только такие процессы, в результате которых энергия Гиббса уменьшается
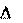 G 0, т.е.G кон. G нач. .
G 0, т.е.G кон. G нач. .


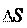 Из уравнения G = Н – Т можно определить направление
Из уравнения G = Н – Т можно определить направление
протекания реакций различных типов.

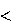 При Н 0 и но слева направо.
При Н 0 и но слева направо.

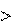 При Н 0 и
При Н 0 и
0, G 0, процесс протекает самопроизволь-
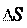
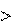

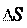

 0, G 0, процесс не может самопроизволь-
0, G 0, процесс не может самопроизволь-
 но протекать слева направо.
но протекать слева направо.

 При Н 0 и
При Н 0 и
0, а также при Н 0 и
0 знак G зави-


 сит от соотношения энтальпийного и энтропийного факторов.
сит от соотношения энтальпийного и энтропийного факторов.

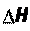
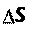
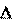
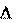
 Изменение знака при изменении знаков и
Изменение знака при изменении знаков и
| Знак |
Вывод |
Примеры
 Мы поможем в написании ваших работ! | ||||
