Стандартные теплоты (энтальпии) образования
некоторых веществ при 298К (25ºС)
| Вещество | 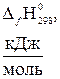
| Вещество | 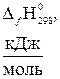
| Вещество | 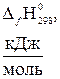
|
| Al2O3(к) | –1676 | Cu2S(к) | –82,0 | MnO2(к) | –519,7 |
| BeO(к) | –598,7 | FeO(к) | –264,8 | NH3(г) | –46,2 |
| BeSO4 | –1196 | Fe2O3(к) | –822,2 | NH4Cl(к) | –314,2 |
| CH4(г) | –74,9 | Fe3O4(к) | –1118 | NO(г) | +90,2 |
| C2H2(г) | +226,3 | HF(г) | –270,7 | NO2(г) | +33,0 |
| C2H4(г) | +52,3 | HCl(г) | –91,8 | N2O4(г) | +9,4 |
| C2H6(г) | –84,7 | HBr(г) | –34,1 | NiO(к) | –244,4 |
| C6H6(г) | +82,9 | HI(г) | +26,6 | PbO(к) | –217,9 |
| CO(г) | –11,05 | H2O(г) | –241,8 | PbO2(к) | –276,6 |
| CO2(г) | –393,5 | H2O(ж) | –285,8 | SO2(г) | –296,9 |
| CaO(к) | –635,1 | MgCO3(к) | –1096 | SO3(г) | –395,2 |
| Ca(OH)2(к) | –986,5 | MgO(к) | –601,8 | SnO(к) | –286,4 |
| CaCO3(к) | –1206 | Mg(OH)2(к) | –924,7 | SnO2(к) | –580,7 |
| CuO(к) | –162,0 | MnO(к) | –384,9 | ZnO(к) | –349,0 |
2. Стандартные энтропии 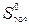 некоторых веществ
некоторых веществ
при 298К (25ºС)
| Вещество | 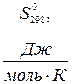
| Вещество | 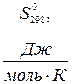
| Вещество | 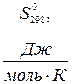
|
| Al(к) | 28,3 | CuO(к) | 42,6 | MnO2(к) | 53,1 |
| Al2O3(к) | 50,9 | Fe(к) | 27,2 | N2(г) | 191,5 |
| BeO(к) | 14,1 | FeO(к) | 60,8 | NH3(г) | 192,6 |
| BeSO4(к) | 90,0 | Fe2O3(к) | 87,0 | NH2Cl(к) | 94,6 |
| C(графит) | 5,7 | Fe2O4(к) | 151,5 | NO(г) | 210,6 |
| СH4(к) | 186,2 | H2(г) | 130,6 | NO2(г) | 240,2 |
| С2H2(г) | 200,8 | HF(г) | 173,7 | N2O4(г) | 304,3 |
| С2H4(г) | 219,5 | HCl(г) | 186,8 | NiO(к) | 38,6 |
| С2H6(г) | 229,5 | HBr(г) | 198,6 | O2(г) | 205,0 |
| С6H6(г) | 173,2 | Н2О(г) | 188,7 | PbO2(к) | 76,4 |
| CO(г) | 197,6 | Н2О(ж) | 70,1 | S(ромб) | 31,9 |
| CO2(г) | 213,5 | Mg(к) | 32,6 | SO2(г) | 248,1 |
| CaCO3(к) | 92,9 | MgCO3(к) | 65,7 | SO3(г) | 256,2 |
| CaO(к) | 39,7 | MgO(к) | 27,1 | Sn | 51,6 |
| Ca(OH)2(к) | 83,4 | MgOH2(к) | 63,1 | SnO(к) | 56,5 |
| Cl2(г) | 223,0 | MnO(к) | 60,3 | SnO2(к) | 52,3 |
| Cu(к) | 33,1 | PbO(к) | 67,4 | ZnO(г) | 43,5 |
| HI(г) | 206,5 | Pb | 64,8 |
Стандартная энергия Гиббса образования
|
|
|
некоторых веществ при 298К (25ºС)
| Вещество | 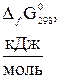
| Вещество | 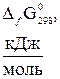
| Вещество | 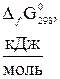
|
| Al2O3(к) | –1582 | FeO(к) | –239,3 | NH4Cl(к) | –203,2 |
| BeCO3(к) | –944,8 | Fe2O2(к) | –740,3 | NO(г) | –86,6 |
| BeO(к) | –581,6 | Fe3O4(к) | –1017 | NO2(г) | –51,5 |
| CH4(г) | –50,8 | HF(г) | –272,8 | NiO(к) | –216,4 |
| C2H2(г) | +208,4 | HCl(г) | –94,8 | PbO(к) | –188,2 |
| С2H4(г) | +68,2 | HBr(г) | –51,2 | PbO2(к) | –217,6 |
| СО(г) | –137,1 | Hl(г) | +1,8 | SO2(г) | –300,2 |
| СО2(г) | –394,4 | H2O(г) | –228,6 | SO3(г) | –371,2 |
| СаСО3(к) | –599,4 | H2O(ж) | –237,2 | SnO(к) | –257,3 |
| CaCO3(к) | –1129 | MgO(к) | –569,6 | SnO2(к) | –519,7 |
| CuO(к) | –129,7 | NH3(г) | –16,7 | ZnO(к) | –319,0 |
Константы нестойкости комплексных ионов
|
|
|
| Уравнение диссоциации | Кн |
[Ag(CN)2]–  Ag+ + 2CN– Ag+ + 2CN–
| 2,0·10-22 |
[Ag(NH3)2]+  Ag+ + 2NH3 Ag+ + 2NH3
| 5,9·10-8 |
[Cd(CN)4]2– 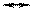 Cd2+ + 4CN– Cd2+ + 4CN–
| 7,7·10-18 |
[CdI4]2+ 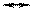 Cd2+ + 4I– Cd2+ + 4I–
| 7,9·10-7 |
[Cd(NH3)4]2+ 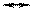 Cd2+ + 4NH3 Cd2+ + 4NH3
| 2,8·10-7 |
[Cu(NH3)4]2+ 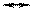 Cu2+ + 4NH3 Cu2+ + 4NH3
| 9,3·10-13 |
[Hg(CN)4]2– 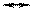 Hg2+ 4CN– Hg2+ 4CN–
| 3,0·10-42 |
[HgI4]2– 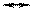 Hg2+ + 4I– Hg2+ + 4I–
| 1,4·10-30 |
[Zn(CN)4]2– 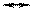 Zn2+ + 4CN– Zn2+ + 4CN–
| 1,0·10-16 |
[Zn(NH3)4]2+ 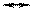 Zn2+ + 4NH3 Zn2+ + 4NH3
| 2,0·10-9 |
Константы диссоциации слабых кислот
| Кислота | K1 | K2 |
| H2C2O4 | 5,6·10-2 | 5,1·10-5 |
| H2SO3 | 1,7·10-2 | 6,3·10-8 |
| HF | 6,6·10-4 | — |
| H2CO3 | 4,5·10-7 | 4,8∙10-11 |
| H2S | 1,1·10-7 | 1,0∙10-14 |
| HCN | 7,9·1010 | — |
Величины стандартных электродных потенциалов
| Электрод | Потенциал
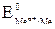 , В , В
| Электрод | Потенциал
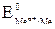 , В , В
| Электрод | Потенциал
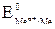 , В , В
|
| Li+ / Li | –3,02 | Zn2+ / Zn | –0,76 | Bi3+ / Bi | +0,22 |
| K+ /K | –2,92 | Cr3+ / Cr | –0,74 | Cu2+ / Cu | +0,34 |
| Ca2+ / Ca | –2,87 | Fe2+ / Fe | –0,44 | Hg22+/2Hg | +0,79 |
| Na+ /Na | –2,71 | Cd2+ / Cd | –0,40 | Ag+ / Ag | +0,80 |
| Mg2+ /Mg | –2,36 | Co2+ / Co | –0,28 | Hg2+ / Hg | +0,85 |
| Be2+ /Be | –1,85 | Ni2+ / Ni | –0,25 | Pt2+ / Pt | +1,19 |
| Al3+ /Al | –1,66 | Sn2+ / Sn | –0,14 | Au3+ / Au | +1,50 |
| Ti2+ /Ti | –1,63 | Pb2+ / Pb | –0,13 | ||
| Mn2+ /Mn | –1,18 | 2H+ / H2 | 0 |
|
|
|
Содержание
Общие методические указания........................................................... 2
Программа........................................................................................... 3
Литература.......................................................................................... 7
Перечень лабораторных работ.......................................................... 8
Перечень практических занятий......................................................... 9
Контрольное задание........................................................................ 10
1. Атомно-молекулярное учение.
Стехиометрические законы.......................................................... 10
2. Строение вещества........................................................................ 12
2.1. Строение атома...................................................................... 12
2.2. Периодическая система элементов
и изменение свойств элементов............................................. 16
3. Общие закономерности протекания
химических процессов.................................................................. 19
3.1. Энергетика химических процессов....................................... 19
3.2. Химическая кинетика. Химическое равновесие.
Правило Ле Шателье-Брауна................................................ 25
4. Растворы и другие дисперсные системы.
Концентрации растворов............................................................. 30
5. Электрохимические процессы...................................................... 33
|
|
|
5.1. Окислительно-восстановительные реакции.......................... 33
5.2. Химические источники электричества.
Электродные потенциалы. Гальванические элементы......... 37
5.3. Электролиз............................................................................ 41
5.4. Коррозия и защита металлов............................................... 46
Варианты контрольных заданий...................................................... 50
Приложения....................................................................................... 51
Дата добавления: 2019-11-25; просмотров: 529; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
