Химические источники электричества.
Электродные потенциалы. Гальванические элементы
Пример 1. Напишите уравнения анодного и катодного процессов, суммарные ионно-молекулярное и молекулярное уравнения этих процессов, протекающих в гальваническом элементе, схема которого:
Ni │ NiSO4 ║ CoSO4 │ Co
(0,001 M) (1 M)
(В скобках приведены молярные концентрации растворов соответствующих солей). Вычислите величину электродвижущей силы (ЭДС) гальванического элемента.
Решение. Рассчитаем величины электродных потенциалов по уравнению Нернста:
 ,
,
где  – стандартный электродный потенциал (см. в Приложении: табл. 6;
– стандартный электродный потенциал (см. в Приложении: табл. 6;  = –0,25 В;
= –0,25 В;  = –0,28 В).
= –0,28 В).
 = –0,25 +
= –0,25 +  ·(–3) = –0,34 В.
·(–3) = –0,34 В.
 = –0,28 +
= –0,28 +  ·0 = –0,28 В.
·0 = –0,28 В.
На электроде, имеющем меньший потенциал, происходит отдача электронов, т. е. окисление. Этот электрод называется анодом. Поскольку  <
<  , анодом является никелевый электрод.
, анодом является никелевый электрод.
На электроде, имеющем больший потенциал, происходит принятие электронов, т. е. восстановление. Этот электрод называется катодом. Им является кобальтовый электрод.
Процессы, протекающие в гальваническом элементе:
Анод Ni – 2  = Ni2+
= Ni2+
Катод Co2+ + 2  = Co
= Co
Ионно-молекулярное уравнение: Ni + Co2+ = Ni2+ + Co
Молекулярное уравнение: Ni + CoSO4 = NiSO4 + Co
ЭДС = E(к) – E(а) = –0,28 – (–0,34) = 0,06 В.
Пример 2. В каком направлении может самопроизвольно протекать реакция
2Bi + 3CdCl2  2BiCl3 + 3Cd
2BiCl3 + 3Cd
|
|
|
Составьте схему гальванического элемента, в котором протекает эта реакция. Напишите уравнения анодного и катодного процессов, а также суммарное ионно-молекулярное уравнение. Определите ЭДС при концентрациях потенциалообразующих ионов в анодном и катодном пространстве, равных 1  .
.
Решение. Окислительно-восстановительная реакция возможна, если потенциал предполагаемого окислителя больше потенциала предполагаемого восстановителя: Eокисл > Eвосст. Для прямой реакции



окислителем должен являться ион Cd2+, а восстановителем – металлический висмут  . Однако соотношение их электродных потенциалов:
. Однако соотношение их электродных потенциалов:  = –0,40 В <
= –0,40 В <  = +0,22 В, т.е. электродный потенциал предполагаемого окислителя оказывается меньше потенциала предполагаемого восстановителя: Eокисл < Eвосст. Прямая реакция невозможна.
= +0,22 В, т.е. электродный потенциал предполагаемого окислителя оказывается меньше потенциала предполагаемого восстановителя: Eокисл < Eвосст. Прямая реакция невозможна.
Для обратной реакции окислителем оказывается ион Bi3+, а восстановителем – металлический кадмий  , т.е. Eокисл > Eвосст. Возможно самопроизвольное протекание обратной реакции
, т.е. Eокисл > Eвосст. Возможно самопроизвольное протекание обратной реакции
2BiCl3 + 3Cd = 2Bi + 3CdCl2
В гальваническом элементе на аноде (Cd) протекает процесс окисления кадмия, а на катоде (Bi) – процесс восстановления ионов Bi3+:
Анод Cd – 2  = Cd2+ │ 3
= Cd2+ │ 3
Катод Bi3+ + 3  = Bi │ 2
= Bi │ 2
|
|
|
2Bi3+ + 3Cd = 2Bi + 3Cd2+
Схема гальванического элемента:
(А) Cd │ CdCl2 ║ BiCl3 │ Bi (К)
ЭДС = E(к) – E(а) =  –
–  = +0,22 – (–0,40) = 0,62 В.
= +0,22 – (–0,40) = 0,62 В.
Задания
141-150. Напишите уравнения анодного и катодного процессов, Суммарные ионно-молекулярное и молекулярное уравнения этих процессов, протекающих в гальваническом элементе. Вычислите величину электродвижущей силы (ЭДС) гальванического элемента при указанных молярных концентрациях растворов соответствующих солей.
| Номер задачи | Схема гальванического элемента |
| 141 | Cu | CuSO4 || AgNO3 | Ag (1 M) (0,1 M) |
| 142 | Bi | Bi(NO3)3 || Cu(NO3)2 | Cu (0,001 M) (1 M) |
| 143 | Fe | FeSO4 || CdSO4 | Cd (0,001 M) (1 M) |
| 144 | Ni | NiSO4 || CuSO4 | Cu (1 M) (0,01 M) |
| 145 | Cd | CdSO4 || NiSO4 | Ni (0,01 M) (1 M) |
| 146 | Zn | ZnSO4 || AgNO3 | Ag (1 M) (0,01 M) |
| 147 | Cd | CdSO4 || CdSO4 | Cd (0,01 M) (1 M) |
| 148 | Co | CoSO4 || CuSO4 | Cu (1 M) (0,01 M) |
| 149 | Ni | NiSO4 || Bi(NO3)3 | Bi (0,1 M) (1 M) |
| 150 | Pb | Pb(NO3)2 || AgNO3 | Ag (1 M) (0,01 M) |
151-160. Дайте обоснованный ответ, в каком направлении может самопроизвольно протекать заданная реакция? Составьте схему гальванического элемента, в котором протекает эта реакция. Напишите уравнения анодного и катодного процессов, а также суммарное ионно-молекулярное уравнение. Определите ЭДС при концентрациях потенциалообразующих ионов в анодном и катодном пространстве, равных 1  .
.
|
|
|
| Номер задачи | Схема реакции |
| 151 | Cu + HgCl2  CuCl2 + Hg CuCl2 + Hg
|
| 152 | Cu + NiCl2  CuCl2 + Ni CuCl2 + Ni
|
| 153 | Pb + Co(NO3)2  Pb(NO3)2 + Co Pb(NO3)2 + Co
|
| Номер задачи | Схема реакции |
| 154 | Zn + NiSO4  ZnSO4 + Ni ZnSO4 + Ni
|
| 155 | Cu(NO3)2 + 2Ag  2AgNO3 + Cu 2AgNO3 + Cu
|
| 156 | CuSO4 + Co  CoSO4 + Cu CoSO4 + Cu
|
| 157 | 2Bi + 3Ni(NO3)2  2Bi(NO3)3 + 3Ni 2Bi(NO3)3 + 3Ni
|
| 158 | 2Ag + Co(NO3)2  2AgNO3 + Co 2AgNO3 + Co
|
| 159 | Bi + 3AgNO3  Bi(NO3)3 + 3Ag Bi(NO3)3 + 3Ag
|
| 160 | HgCl2 + Ni  Hg + NiCl2 Hg + NiCl2
|
Электролиз
Пример 1. Составьте уравнения электродных процессов, протекающих при электролизе водного раствора Bi2(SO4)3 в электролизерах: а) с угольными электродами; б) с висмутовыми электродами.
Для каждого варианта вычислите массы веществ, полученных (или растворенных) на электродах, если через электролизеры пропущен ток силой 10,0 А в течение 1 ч 10 мин. Для газообразных веществ определите их объем при н.у.
Решение. а) На катоде в первую очередь протекает восстановление наиболее сильных окислителей, характеризующихся бόльшим потенциалом. К отрицательно заряженному катоду движется катионы Bi3+, которые могут восстанавливаться до металлического висмута (  + 0,22 В) и полярные молекулы воды, которые могут восстанавливаться до водорода (
+ 0,22 В) и полярные молекулы воды, которые могут восстанавливаться до водорода (  = 0,00 В при pH 0;
= 0,00 В при pH 0;  = –0,41 В при pH 7). Поскольку
= –0,41 В при pH 7). Поскольку  >
>  , то на катоде восстанавливается висмут:
, то на катоде восстанавливается висмут:
|
|
|
Bi3+ + 3 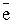 = Bi
= Bi
К положительно заряженному аноду движутся анионы  и полярные молекулы воды. В сульфат-ионе сера находится в высшей степени окисления (+6), поэтому дальнейшее окисление серы невозможно. В данных условиях протекает единственно возможный процесс – окисление воды до кислорода:
и полярные молекулы воды. В сульфат-ионе сера находится в высшей степени окисления (+6), поэтому дальнейшее окисление серы невозможно. В данных условиях протекает единственно возможный процесс – окисление воды до кислорода:
2H2O – 4  = O2 + 4H+
= O2 + 4H+
По законам Фарадея масса восстановленного на катоде висмута:
 , (1)
, (1)
где  ;
;
I – сила тока, А;
τ – продолжительность электролиза, с;
F – константа Фарадея, 96 500 Кл.
 = 30,3 г.
= 30,3 г.
Масса выделившегося на аноде кислорода:
 = 3,48 г,
= 3,48 г,
где  .
.
Объем, занимаемый газом при н.у., определяется по формуле:
 ,
,
где n – количество газа, моль;
m – масса газа, г;
M – молярная масса газа, 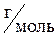 ;
;
V0 = 22,4 л – объем одного моль газа при н.у.
Для кислорода
 = 2,44 л.
= 2,44 л.
б) На висмутовом аноде кроме окисления воды возможно окисление висмута – материала анода. На аноде протекает, в первую очередь, окисление наиболее сильных восстановителей, характеризующихся меньшим потенциалом. Поскольку  = +0,22В <
= +0,22В <  = +1,23В, то окисляться будет материал анода:
= +1,23В, то окисляться будет материал анода:
Bi – 3  = Bi3+
= Bi3+
На катоде, как и в варианте (а), восстанавливается висмут:
Bi3+ + 3  = Bi
= Bi
Массы осажденного на катоде и растворенного на аноде висмута одинаковы и определяются уравнением (1): на катоде из раствора восстановилось 30,3 г висмута и столько же висмута растворилось на аноде.
Пример 2. При электролизе водных растворов AgNO3 и NiSO4 в двух электролизерах, соединенных последовательно, на катодах выделилось соответственно серебро массой 5,39 г и никель массой 1,39 г. Определите выход по току никеля, если выход по току серебра 100%. Какова продолжительность электролиза при силе тока 5,00 А?
Решение. Если на электроде возможно одновременно протекание нескольких процессов, то используют понятие выхода по току. Выходом по току i-го вещества (Bi) называется доля общего количества электричества в процентах, которая расходуется на окисление или восстановление i-го вещества при электролизе
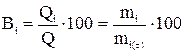 ,
,
где Q = I·τ – общее количество прошедшего электричества;
Qi – количество электричества, израсходованное на окисление или восстановление i-го вещества;
mi – масса i-го вещества, окисленного или восстановленного на электроде;
mi(τ) – то же, теоретически рассчитанное из предположения 100%-ного выхода по току.
Из законов Фарадея по массе выделившегося серебра при 100%-ном выходе по току определим продолжительность электролиза τ:
 = 964 с = 16 мин 4 с.
= 964 с = 16 мин 4 с.
Рассчитаем массу никеля, которая выделилась бы при 100%-ном выходе по току
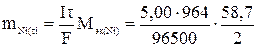 = 1,47 г.
= 1,47 г.
Выход по току никеля
 = 94,6%.
= 94,6%.
Пример 3. В течение какого времени следует проводить электролиз при силе тока 8,00А для выделения на катоде всей меди, содержащейся в 250 мл 0,100 М раствора CuSO4?
Решение. Из законов Фарадея
 ,
,
или
 , (2)
, (2)
где nэк(Cu) – количество моль эквивалентов меди.
Количество моль меди в растворе
nCu = cV = 0,100·0,250 = 0,0250 моль,
где c – молярная концентрация CuSO4,  ;
;
V – объем раствора, л.
Поскольку эквивалент меди ЭCu = ½ Cu, то nэк(Cu) = 2nCu =
= 2·0,0250 = 0,0500 моль. Подставим значение nэк(Cu) в уравнение (2):
 = 603 c = 10 мин 3 с.
= 603 c = 10 мин 3 с.
Задания
161-168. Электролиз водного раствора вещества X проводили с угольными электродами катодного и анодного процессов. Вычислите массы веществ, выделившихся на катоде и на аноде. Определите объем выделившихся газообразных веществ (н.у.).
| Номер задачи | X | I, A | τ |
| 161 | CuSO4 | 15,0 | 5 ч 37 мин |
| 162 | K2SO4 | 10,0 | 30 мин |
| 163 | NaOH | 25,0 | 30 мин |
| 164 | AgNO3 | 10,1 | 1 ч 40 мин |
| 165 | KI | 10,0 | 50 мин |
| 166 | NaBr | 18,0 | 1 ч 40 мин |
| 167 | Al2(SO4)3 | 20,0 | 45 мин |
| 168 | H2SO4 | 15,0 | 25 мин |
169-175. Электролиз водного раствора вещества X проводили с анодом из материала Y при силе тока I. Составьте уравнения электродных процессов. Определите, сколько потребуется времени для окисления на аноде массы mA соответствующего вещества. Составьте уравнения электродных процессов с угольным анодом.
| Номер задачи | X | Y | mA, г | I, A |
| 169 | NiSO4 | Ag | 15,0 | 10,0 |
| 170 | AgNO | Ag | 100,0 | 20,0 |
| 171 | SnCl2 | Sn | 45,0 | 15,0 |
| 172 | Na2SO4 | Cd | 50,0 | 25,0 |
| Номер Задачи | X | Y | mA, г | I, A |
| 173 | MgCl2 | Mg | 15,0 | 15,0 |
| 174 | H2SO4 | Cu | 65,0 | 30,0 |
| 175 | CdSO4 | Cd | 60,0 | 10,0 |
176. При электролизе водных растворов KI и CuSO4 в двух электролизерах, соединенных последовательно, масса одного из катодов увеличилась на 15,7 г. Какое количество электричества было пропущено через электролизеры? Составьте уравнения катодных и анодных процессов в каждом из электролизеров, если электроды угольные.
177. Через два соединенных последовательно электролизера, содержащих, соответственно, водные растворы Na2SO4 и AgNO3, пропускали ток силой 10,0 А в течение 1 ч 40 мин. На какую величину увеличилась масса одного из электродов? Составьте уравнения всех катодных и анодных процессов, если электроды угольные.
178. Составьте уравнения процессов, протекающих на угольных электродах при электролизе: а) водного раствора MgCl2; б) расплава MgCl2. Вычислите массу веществ, выделяющихся на электродах в том и другом случаях, если через раствор и расплав пропустили ток силой 20,0 А в течение 1 ч 20 мин. Определите объем выделяющихся газов (н.у.).
179. Составьте электронные уравнения процессов, происходящих на электродах при электролизе водного раствора AgNO3 с нерастворимым анодом; с растворимым серебряным анодом. Вычислите массу серебра и объем кислорода, выделившихся на электродах при электролизе водного раствора AgNO3 с нерастворимым анодом, если время
180. Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов MgSO4 и ZnCl2. Вычислите силу тока при электролизе раствора MgSO4 в течение 1 ч 40 мин, если на катоды выделилось 1,4 л водорода (н.у.).
Коррозия и защита металлов
Пример 1. Возможна ли коррозия сплава, состоящего из мелкодисперсных кристаллов висмута и свинца: а) в аэрируемой воде; б) в изолированном от воздуха сосуде с водой? Для среды, в которой коррозия возможна, составьте схему микрогальванических элементов, возникающих в процессе коррозии. Составьте уравнения анодного и катодного процессов и результирующее (суммарное) уравнение процесса коррозии.
Решение. Как любой окислительно-восстановительный процесс, коррозия возможна, если потенциал окислителя больше потенциала восстановителя (Eокисл > Eвосст). Отсюда следует, что в первую очередь будет окисляться, т.е. корродировать, металл, имеющий меньший электродный потенциал. Таким металлом в данном примере является свинец (  = –0,13 В <
= –0,13 В <  = +0,22 В). Окислителем будут те ионы или молекулы в окружающей среде, которые имеют больший потенциал.
= +0,22 В). Окислителем будут те ионы или молекулы в окружающей среде, которые имеют больший потенциал.
а) В аэрируемой воде из двух возможных окислителей – иона водорода воды H+ и растворенного в воде кислорода O2 – более сильным окислителем является кислород, так как его потенциал больше (в нейтральной среде  = +0,81 В >
= +0,81 В >  = –0,41 В). Коррозия возможна, так как Eокисл = +0,81 В > Eвосст = –0,13 В.
= –0,41 В). Коррозия возможна, так как Eокисл = +0,81 В > Eвосст = –0,13 В.
Схема гальванического элемента: Pb | O2; H2O | Bi. Анодом является свинец, катодом – висмут. Протекают процессы:
Анод Pb – 2  = Pb2+ │ 2
= Pb2+ │ 2
Катод O2 + 4  + 2H2O = 4OH– │ 1
+ 2H2O = 4OH– │ 1
2Pb + O2 + 2H2O = 2Pb(OH)2 ↓
Продуктом коррозии является труднорастворимый гидроксид свинца Pb(OH)2.
б) В отсутствие кислорода единственным окислителем могли бы быть ионы водорода из воды. Но поскольку Eокисл = –0,41 В < Eвосст = –0,13 В, коррозия невозможна.
Пример 2. Какие процессы будут протекать при коррозии бериллия и меди, находящихся в контакте? Составьте уравнения анодного и катодного процессов и результирующее (суммарное) уравнение процесса коррозии в следующих средах: а) во влажном воздухе; б) в растворе гидроксида натрия; в) в растворе хлороводородной кислоты.
Решение. Из контактирующих металлов более активным восстановителем является бериллий, так как 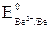 = –1,85 В <
= –1,85 В <  = +0,34 В, поэтому, в первую очередь, корродирует бериллий.
= +0,34 В, поэтому, в первую очередь, корродирует бериллий.
а) Во влажном воздухе окислителем является кислород. Коррозия возможна, так как его потенциал значительно больше потенциала бериллия. Бериллий будет являться анодом и окисляться, а медь – катодом, где будет восстанавливаться кислород:
Анод Be – 2  = Be2+ │ 2
= Be2+ │ 2
Катод O2 + 4  + 2H2O = 4OH– │ 1
+ 2H2O = 4OH– │ 1
2Be + O2 + 2H2O = 2Be(OH)2 ↓
Продуктом коррозии является труднорастворимый гидроксид бериллия.
б) Поскольку гидроксид бериллия амфотерен, в щелочном растворе процесс анодного окисления бериллия заканчивается образованием гидроксокомплекса:
Анод Be – 2  + 4OH– = [Be(OH)4]2–
+ 4OH– = [Be(OH)4]2–
Несмотря на то, что потенциал кислорода больше, чем иона водорода воды, доступ кислорода к поверхности катода (медь) ограничен из-за малой его растворимости и медленной диффузии. Поэтому в щелочном растворе (pH 14) при условии  = –0,82 В >>
= –0,82 В >> 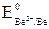 = –1,85 В, окислителем является ион водорода воды
= –1,85 В, окислителем является ион водорода воды
Катод 2H2O + 2  = H2 + 2OH–
= H2 + 2OH–
Результирующее уравнение процесса коррозии получим, суммируя уравнения анодного и катодного процессов:
Be + 2H2O + 2OH– = [Be(OH)4]2– + H2
или
Be + 2H2O + 2NaOH = Na2[Be(OH)4] + H2
в) По тем же кинетическим причинам, что и в предыдущем случае, окислителем является ион водорода H+. Уравнения процессов:
Анод Be – 2  = Be2+
= Be2+
Катод H2 + 2  = H2
= H2
Be + 2H2 = Be2+ + H2
или
Be + 2HCl = BeCl2 + H2
Задания
181-192. Какие коррозионные процессы могут протекать при контакте двух металлов? Составьте уравнения анодного и катодного процессов и результирующее (суммарное) уравнение процесса коррозии в заданных условиях. Если коррозия невозможна, то объясните, почему?
| Номер задачи | Металлы | Среда |
| 181 | Cu, Fe | а) раствор HCl |
| б) влажный воздух | ||
| 182 | Zn, Fe | а) речная вода |
| б) раствор HCl | ||
| 183 | Cu, Ag | а) аэрируемый раствор H2SO4 |
| б) закрытый сосуд с раствором HCl | ||
| 184 | Ni, Fe | а) влажный воздух |
| б) раствор H2SO4 | ||
| 185 | Cr, Ni | а) морская вода |
| б) раствор H2SO4 | ||
| 186 | Cu, Zn | а) влажный грунт |
| б) раствор HCl | ||
| 187 | Cu, Sn | а) раствор H2SO4 |
| б) влажный воздух | ||
| 188 | Sn, Fe | а) раствор H2SO4 |
| б) морская вода | ||
| 189 | Al, Cu | а) раствор H2SO4 |
| б) раствор NaOH | ||
| 190 | Sn, Ag | а) раствор HCl |
| б) влажный воздух | ||
| 191 | Cu, Ni | а) раствор HCl |
| б) вода при отсутствии в ней растворенного кислорода | ||
| 192 | Cu, Au | а) раствор H2SO4 в контакте с воздухом |
| б) раствор H2SO4 при отсутствии в окружающей среде кислорода |
193. Приведите пример катодного покрытия для никеля. Напишите уравнения анодного, катодного и суммарного процессов коррозии, протекающих в аэрируемом водном растворе и в солянокислой среде при частичном нарушении такого покрытия.
194. Приведите пример анодного покрытия для кадмия. Напишите уравнения анодного, катодного и суммарного процессов коррозии, протекающих в сернокислом растворе и во влажном воздухе, при частичном нарушении такого покрытия.
195. Какие металлы можно использовать для протекторной защиты железа? Для одного из примеров напишите уравнения анодного, катодного и суммарного процессов коррозии в аэрируемом водном растворе и в сернокислой среде.
196. В чем сущность катодной защиты от коррозии? Какие процессы протекают на электродах при катодной защите стального трубопровода, проложенного во влажном грунте?
197. К какому типу покрытий относится лужение (покрытие оловом) меди? Напишите уравнения анодного, катодного и суммарного процессов коррозии, протекающих во влажном воздухе и в сернокислой среде при частичном нарушении этого покрытия.
198-200. Возможна ли в средах (а) и (б) коррозия сплава, представляющего собой смесь мелкодисперсных кристаллов металлов X и Y?
В случае возможности коррозии составьте схему микрогальванических элементов, возникающих в процессе коррозии. Напишите уравнения анодного и катодного процессов и суммарное уравнение процесса коррозии. Если коррозия невозможна, то объясните, почему?
| Номер задачи | X | Y | Среда | |
| 198 | Ag | Cu | а) аэрируемый раствор HCl | б) изолированный от воздуха раствор HCl |
| 199 | Cd | Bi | а) раствор H2SO4 | б) влажный воздух |
| 200 | Pb | Sb | а) влажный воздух | б) вода при отсутствии растворенного в ней кислорода |
Варианты контрольных заданий
| Номер варианта | Номера задач | |||||||||
| 01 | 1 | 21 | 41 | 61 | 81 | 103 | 121 | 141 | 161 | 181 |
| 02 | 2 | 22 | 42 | 62 | 82 | 104 | 122 | 142 | 162 | 182 |
| 03 | 3 | 23 | 43 | 63 | 83 | 105 | 123 | 143 | 163 | 183 |
| 04 | 4 | 24 | 44 | 64 | 84 | 106 | 124 | 144 | 164 | 184 |
| 05 | 5 | 25 | 45 | 65 | 85 | 107 | 125 | 145 | 165 | 185 |
| 06 | 6 | 26 | 46 | 66 | 86 | 108 | 126 | 146 | 166 | 186 |
| 07 | 7 | 27 | 47 | 67 | 87 | 109 | 127 | 147 | 167 | 187 |
| 08 | 8 | 28 | 48 | 68 | 88 | 110 | 128 | 148 | 168 | 188 |
| 09 | 9 | 29 | 49 | 69 | 89 | 111 | 129 | 149 | 169 | 189 |
| 10 | 10 | 30 | 50 | 70 | 90 | 112 | 130 | 150 | 170 | 190 |
| 11 | 11 | 31 | 51 | 71 | 91 | 113 | 131 | 151 | 171 | 191 |
| 12 | 12 | 32 | 52 | 72 | 92 | 114 | 132 | 152 | 172 | 192 |
| 13 | 13 | 33 | 53 | 73 | 93 | 115 | 133 | 153 | 173 | 193 |
| 14 | 14 | 34 | 54 | 74 | 94 | 116 | 134 | 154 | 174 | 194 |
| 15 | 15 | 35 | 55 | 75 | 95 | 117 | 135 | 155 | 175 | 195 |
| 16 | 16 | 36 | 56 | 76 | 96 | 118 | 136 | 156 | 176 | 196 |
| 17 | 17 | 37 | 57 | 77 | 97 | 119 | 137 | 157 | 177 | 197 |
| 18 | 18 | 38 | 58 | 78 | 98 | 120 | 138 | 158 | 178 | 198 |
| 19 | 19 | 39 | 59 | 79 | 99 | 103 | 139 | 159 | 179 | 199 |
| 20 | 20 | 40 | 60 | 80 | 100 | 104 | 140 | 160 | 180 | 200 |
| 21 | 3 | 31 | 41 | 71 | 181 | 111 | 122 | 147 | 162 | 187 |
| 22 | 4 | 32 | 47 | 72 | 101 | 112 | 123 | 148 | 163 | 181 |
| 23 | 5 | 33 | 48 | 73 | 102 | 113 | 124 | 149 | 164 | 182 |
| 24 | 6 | 34 | 49 | 74 | 87 | 114 | 125 | 150 | 165 | 183 |
| 25 | 7 | 35 | 50 | 75 | 88 | 115 | 126 | 151 | 166 | 184 |
| 26 | 8 | 36 | 51 | 76 | 89 | 116 | 127 | 152 | 167 | 185 |
| 27 | 9 | 37 | 52 | 77 | 90 | 117 | 128 | 153 | 168 | 186 |
| 28 | 10 | 38 | 53 | 78 | 91 | 118 | 129 | 154 | 169 | 187 |
| 29 | 11 | 39 | 54 | 79 | 92 | 119 | 130 | 155 | 170 | 188 |
| 30 | 12 | 40 | 55 | 80 | 93 | 120 | 131 | 156 | 171 | 190 |
Приложения
Дата добавления: 2019-11-25; просмотров: 613; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
