Определение содержания кальция и магния при их совместном
Присутствии
Определение основано на предварительном определении общего содержания ионов Са2+ и Мg2+ титрованием исследуемого раствора ЭДТА в присутствии индикатора эриохрома черного Т и последующем определении в отдельной пробе содержания ионов Са2+ титрованием ЭДТА в присутствии индикатора мурексида.
Реактивы
Аммиачно-буферная смесь, рН 9;
индикаторы: эриохром черный Т - раствор,
мурексид кристаллический;
Натрия гидроокись NaOH, 1 н раствор;
ЭДТА, 0,02 М раствор.
Методика определения
Полученный в препараторской в мерной колбе, исследуемый раствор доводят до метки дистиллированной водой и тщательно перемешивают. После этого проводят 2 серии параллельных опытов.
1) Определение суммарного содержания Са2+ и Мg2+
В коническую колбу для титрования переносят аликвотную часть раствора, добавляют 5 мл аммиачно-буферной смеси, 10 капель эриохрома черного Т и титруют стандартным раствором ЭДТА до перехода красной окраски в синюю. Записывают объем ЭДТА, пошедший на образование комплексов с ионами Са2+ и Мg2+. Опыт повторяют 3-5 раз и рассчитывают среднее значение ( 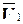 ).
).
2) Определение содержания Са2+
В коническую колбу для титрования переносят аликвотную часть раствора, добавляют 5 мл 1 н раствора NаОН и мурексида на кончике шпателя. Титруют стандартным раствором ЭДТА до перехода красной окраски раствора в фиолетовую. Записывают объем ЭДТА, пошедший на образование комплексов с ионами Са2+, поскольку при данных условиях комплекс с ионами Мg2+ не образуется. Опыт проводят 3-5 раз и рассчитывают среднее значение (  ).
).
|
|
|
Расчетная часть
Содержание определяемых катионов рассчитывают по формулам:
 (г)
(г)
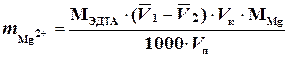 (г),
(г),
где: МЭДТА - молярность раствора ЭДТА;
МСа, МMg - атомные массы кальция и магния, равные соответственно 40 и 24;
Vк, Vп - объем соответственно мерной колбы и мерной пипетки, мл.
Лабораторная работа № 9
Гравиметрический метод
Это метод количественного химического анализа, основанный на точном измерении массы определяемого вещества или его составных частей, выделяемых в химически чистом состоянии или в виде соответствующих соединений.
Все многочисленные гравиметрические определения можно разделить на три большие группы: методы выделения, осаждения и отгонки.
Метод осаждения
В анализе различают форму осаждения и гравиметрическую форму.
Соединение, в виде которого определяемое вещество осаждается из раствора, называют формой осаждения.
Соединение, в виде которого производят взвешивание, называют гравиметрической формой.
|
кристаллически й | ||||||||||
|
| форма осаждения | гравиметрическая форма
| ||||||||
|
аморфный | ||||||||||
|
| форма осаждения | гравиметрическая форма | ||||||||
В качестве формы осаждения в гравиметрическом анализе может быть использован далеко не любой осадок.
Требования к осадку:
1. Осадок должен быть малорастворим (т.е. осаждение должно быть достаточно полным.
2. Осадок должен быть чистым и легко фильтроваться.
3. Необходимо чтобы из формы осаждения легко получалась гравиметрическая форма.
Осадок должен быть крупнокристаллическим. На размер кристаллов оказывают влияние относительные скорости двух основных процессов:
1. скорость образования центров кристаллизации;
2. скорость роста кристаллов.
Скорость образования центров кристаллизации зависит от величины относительного пересыщения, которая выражается уравнением:
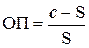 ,
,
где c - концентрация осаждаемого компонента;
S - его растворимость.
Для уменьшения числа центров кристаллизации в соответствии с формулой необходимо уменьшить c и увеличить S. Для этого перед осаждением раствор рекомендуется разбавить для уменьшения c и нагреть для увеличения S, а также ввести электролит или подкислить раствор.
Основные условия получения кристаллических осадков (например, BaSO 4 ) в гравиметрическом методе осаждения
|
|
|
1) Осаждение следует вести из разбавленного анализируемого раствора разбавленным раствором осадителя.
2) Раствор осадителя прибавляют медленно, по каплям (особенно в начале осаждения), при непрерывном осторожном перемешивании раствора.
3) Осаждение следует вести из горячего анализируемого раствора горячим раствором осадителя.
4) В некоторых случаях осаждение полезно вести в присутствии веществ (например, небольших количеств кислоты), слегка повышающих растворимость осадка, но не образующих с ним растворимые комплексные соединения.
5) Выпавший осадок оставляют на некоторое время вместе с маточником для созревания осадка.
Если в качестве осаждаемой формы образуется аморфный осадок, то его стремятся получить как можно более плотным, с тем чтобы улучшить его фильтрование и уменьшить потери при его промывании.
Условия получения аморфных осадков (например, Fe ( OH )3).
1) К горячему концентрированному анализируемому раствору прибавляют горячий концентрированный раствор осадителя. В этих условиях происходит коагуляция коллоидных частиц и осадки получаются более плотными.
2) Горячий раствор осадителя прибавляют быстро, что уменьшает вероятность образования коллоидных растворов.
|
|
|
3) При необходимости в раствор вводят электролит-коагулятор.
4) Избегают длительного выдерживания осадка с маточным раствором. Обычно условия осаждения (получения осаждаемой формы) подробно регламентируются методикой анализа.
Дата добавления: 2019-09-13; просмотров: 856; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!


