Определение содержания формальдегида
Количественное определение формальдегида (обратное титрование) основано на реакции его окисления до муравьиной кислоты избытком раствора иода в щелочной среде:
НСОН + 3 NaOH + J2 = HCOONa + 2NaJ + 2H2O
Щелочная среда необходима для прохождения реакции, в результате которой образуется иодат натрия, являющийся более сильным окислителем, чем иод, и ускоряющий реакцию окисления формальдегида:
3Ј2 + 6NaOH = NaЈO3 + 5NaЈ + 3H2O
Реактивы
Тиосульфат натрия, Na2S2O3, 0,05 н раствор;
крахмал, 1% раствор;
раствор иода, ~ 0,05 н;
кислота хлористоводородная, НСl, концентрированная;
раствор гидроксида натрия NаОН, 1 н.
Ход определения
Для определения нормальности раствора иода («холостой опыт») аликвотную его часть (25 мл) титруют стандартным раствором тиосульфата натрия до соломенно-желтой окраски, прибавляют 5 капель крахмала (раствор окрашивается в синий цвет) и дотитровывают, определяя точку эквивалентности по обесцвечиванию раствора. По результатам 3 параллельных определений рассчитывают средний объем тиосульфата натрия, пошедший на тирование раствора иода (  ).
).
Полученный в препараторской в мерной колбе исследуемый раствор доводят до метки дистиллированной водой и тщательно перемешивают. В коническую колбу для титрования переносят аликвотную часть раствора, добавляют 25 мл раствора иода и по каплям добавляют 1 н раствор NаОН до светло-желтой окраски и ставят в темное место на 10 минут. По истечение этого времени в колбу добавляют 3 мл концентрированной HCl и титруют раствором тиосульфата натрия, добавляя в конце титрования 5 капель раствора крахмала. Точку эквивалентности определяют по исчезновению синей окраски.
|
|
|
По результатам параллельных опытов рассчитывают средний объем тиосульфата натрия, пошедший на титрование непрореагировавшего иода ( 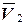 ).
).
Расчетная часть
Содержание формальдегида рассчитывают по формуле:
 (г), где
(г), где
N -нормальность раствора тиосульфата натрия;
ЭНСОН - восстановительный эквивалент формальдегида, равный 15,02;
Vк, Vп - объем соответственно мерной колбы и мерной пипетки, мл.
Лабораторная работа № 7
Бромометрия
Бромометрия (бромометрическое титрование), ‑ метод определения восстановителей с применением в качестве реагента, взаимодействующего с определяемым веществом, раствора брома Br2.
В бромометрии используется способность свободного брома вступать в реакцию с некоторыми органическими соединениями по точному стехиометрическому уравнению без образования каких-либо побочных продуктов.
Растворы брома неустойчивы и очень токсичны, поэтому в качестве титранта не применяются. Источником брома является бромат‑бромидная смесь KBrO3 +KBr , которая содержит бромат калия точно известной концентрации и примерно пятикратный избыток бромида калия.
|
|
|
При подкислении такой раствор выделяет свободный бром в количестве, эквивалентном взятому количеству бромата:
BrO3- + 5Br‑ + 6H+ = 3Br2 + 3H2O
Дата добавления: 2019-09-13; просмотров: 1384; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
