Электронное строение кластерных соединений
Проблема описания электронного строения кластеров заключается в том, что число атомов в составе кластера достаточно велико, но всё же обозримо. Это, с одной стороны, затрудняет применение стандартных квантовохимических методов расчёта ввиду большого числа переменных, а с другой не позволяет применить готовые статистические и теоретико-вероятностные модели, описывающие строения и свойства компактных металлов.
Наиболее общими и результативными являются различные модификации ММО(подробное изложение дано в [1, с. 59],[4], [8]), однако ввиду сложности их концепции здесь не приводятся, а использование в повседневной практике представляется проблематичным. Таким образом целесообразным было сформулировать полуэмпирические правила, позволяющие быстро предсказывать стабильность и свойства кластеров. В ходе их формирования возникли специфические термины, которые будут поясняться по мере появления. Перечислим некоторые из этих правил:
I)Правило ЭАН(эффективного атомного номера)( [4, с. 92], [8]) заключается в том, что устойчивым будет соединения, в которых у атомов переходных элементов остова имеется 18-электронная оболочка. Оно применимо для низконуклеарных металлополиэдрических кластеров. При этом предполагается, что:
1) Все связи М-М двухэлектронные двухцентровые, локализованы на рёбрах остова, к каждой вершине сходится не более трёх ребер;
2) Лиганды обычно являются донорами одной НЭП, независимо от заряда. Арены и циклопентадиен являются 6- и 5- электронными лигандами соответственно.
Таким образом число связей М-М должно быть таким, чтобы выполнялось ПЭАН. Вообще, гораздо удобнее рассматривать кластер как нечто цельное, поэтому вводят понятия КВЭ(суммарное число электронов валентной оболочки атомов металлов остова + число донируемых лигандами электронов - заряд кластера ) и КСЭ(электроны, образующие связи М-М). Между геометрией кластера и числом КВЭ существует корреляция. Зная число КВЭ, мы можем узнать число КСЭ, а после и число связей М-М. Отсюда можно установить и геометрию кластера. В таблице 1.2[8, с.558] приведены данные так называемых «магических» чисел электронов для разных типов геометрии и примеры соединений, для которых данный принцип выполнен.
| Таблица 1.2. Соотношения между геометрией и числом КВЭ, при которых кластер устойчив(«магических» чисел) |
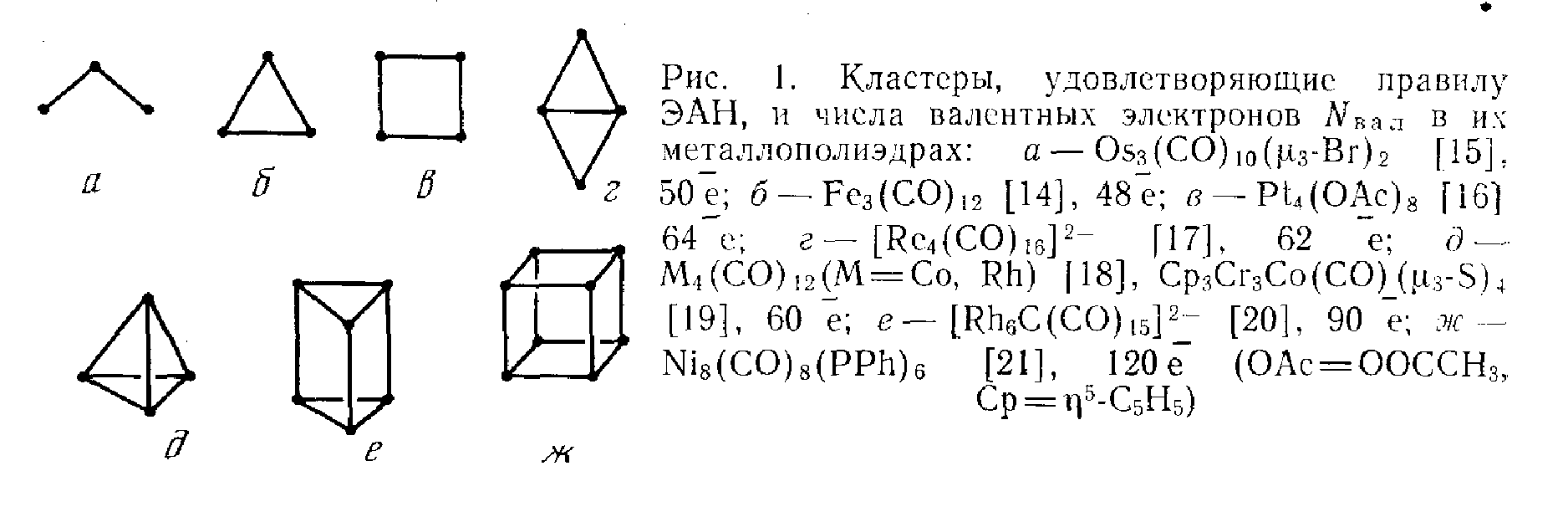
Однако из данного правила существует множество исключений(например, см. [4, р.93] ), являющихся электронодефицитными(число КВЭ меньше предсказываемого ПЭАН) либо электроноизбыточными;
II)Правило скелетных электронных пар( [1, с.93], [3, р.336] [4, р.95]), зародившееся при проведении аналогий между структурами остовов металлических кластеров с таковыми для боранов(нидо-, клозо- и арахно-), применяется для расчетов магических чисел кластеров структуры типа боранов. Очень упрощённо, идея состоит в том, что при расчётах методом МО разделяют электронную систему кластера на две как бы независимые подсистемы – остовную и внешнюю по отношению к остовной и расчеты проводят раздельно.
| Таблица 1.3. Примеры изолобальных групп |

III )Принцип изолобальной аналогии (см. [1, с.93], [4, р.103], [2, с.185].) сформулирован Р. Хоффманом в 1976 г. и служит для объяснения строения кластеров, металлоорганических соединений и т.д. Его суть состоит в том, что некоторые группы могут быть заменены на другие без нарушений геометрии и стабильности кластера. Для этого у групп должно быть одинаковое число граничных МО, имеющих близкие значения энергии, одинаковое число электронов, сходные симметрию и пространственное строение. Такие группы называют изолобальными. Примеры изолобальных групп приведены в таблице 1.3[4, р.105].
Принцип изолобальности ценен тем, что может быть применён для оценки устойчивости ранее неизвестных соединений.
Дата добавления: 2019-09-13; просмотров: 179; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
