Концепция плотной упаковки лигандов на поверхности металлического остова
Оглавление
СПИСОК УСЛОВНЫХ ОБОЗНАЧЕНИЙ…………….…………………….….........3
ВВЕДЕНИЕ..……………………………………………………….……………..……4
ГЛАВА 1.ЛИТЕРАТУРНЫЙ ОБЗОР………………………….…………..................5
1.1. Общая структура кластерных соединений…………………………………….5
1.2.Концепция плотной упаковки лигандов на поверхности металлического остова…………………………………………………………………… ……………..6
1.3.Лиганды в кластерных соединениях…………………………… ……………..6
1.4.Распространённость кластерных соединений d-ряда…………………………7
1.5.Электронное строение кластерных соединений……………………………….8
1.6.Классификация кластерных соединений d-ряда по типу геометрии металлического остова…………………………………………………………………………10
1.7.Методы синтеза кластеров переходных элементов………….……………….10
1.8.Реакционная способность кластерных соединений d-металлов…………..…14
1.9.Каталитические свойства кластеров переходных металлов……………..…...17
ГЛАВА 2.ПОЛУЧЕНИЕ ДИГИДРАТА АЦЕТАТА ХРОМА(II)…………………..19
2.1.Обоснование методики синтеза ………… ………………………………...….19
2.2.Техника безопасности………………………………………………………….19
2.3.Методика синтеза………………………………………………………………19
ГЛАВА 3.РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА…………………...…………….…...20
ЗАКЛЮЧЕНИЕ…………………………………………………………..…………..22
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ…………………………………23
|
|
|
Список условных обозначений
КВЭ – кластерные валентные электроны
КСЭ – кластерные скелетные электроны
СЭП – скелетные электронные пары
СО – степень окисления
МО – молекулярные обитали
КВМО - кластерные валентные молекулярные орбитали
КСМО – кластерные скелетные молекулярные орбитали
М – атом металла
L – лиганд
Введение
В современной химии термину «кластер» даётся следующее определение: «группа близко расположенных, тесно связанных друг с другом атомов, молекул, ионов, иногда ультрадисперсные частицы» [2, с. 792]. В более узком смысле под кластерными понимаются соединения, содержащие связи металл-металл. Когда было установлено существование подобных веществ, казалось, что мы имеем дело с чем-то аномальным, однако позже выяснилось, что практически все элементы способны образовывать кластеры. Особенно характерны они для тяжелых элементов d-ряда.
Теперь кластерная химия является интенсивно развивающимся научным направлением. Это обусловлено многими причинами. Во-первых, сама по себе структура частиц, занимающих промежуточное положение между компактными металлами и моноядерными координационными соединениями, оказалась нетривиальной и интересной с точки зрения описания характера связи. Во-вторых, кластерные соединения находят широчайшее применение в качестве эффективных катализаторов. Оказалось, что даже в живой природе существуют различные ферменты, содержащие кластерные фрагменты (например кубические железосерные кластеры входят в состав ферментов, учавствующих в различных редокс-процессах, начиная от клеточного дыхания и заканчивая фиксацией атмосферного азота)[1, c. 7], что интересно уже с точки зрения биохимии и ферментативного катализа. Что касается физических свойств, в ряде случаев возникает необычное сочетание электромагнитных, тепловых, механических, сверхпроводящих и др. свойств, не присущих металлам, что открывает невероятные перспективы применения кластеров в ряде областей техники.
|
|
|
Задачи работы:
· Изучить общие особенности структуры, закономерности образования, реакционной способности кластерных соединений переходных элементов;
· Выяснить причины выделения кластеров в отдельный класс соединений;
· Ввести важнейшие понятия химии кластерных соединений;
· Предоставить классификацию кластерных соединений;
· Описать основные методы синтеза кластеров;
· Дать представление о типах координации лигандов в кластерных соединениях;
|
|
|
Глава 1
Общая структура кластерных соединений
| Схема 1.1 |
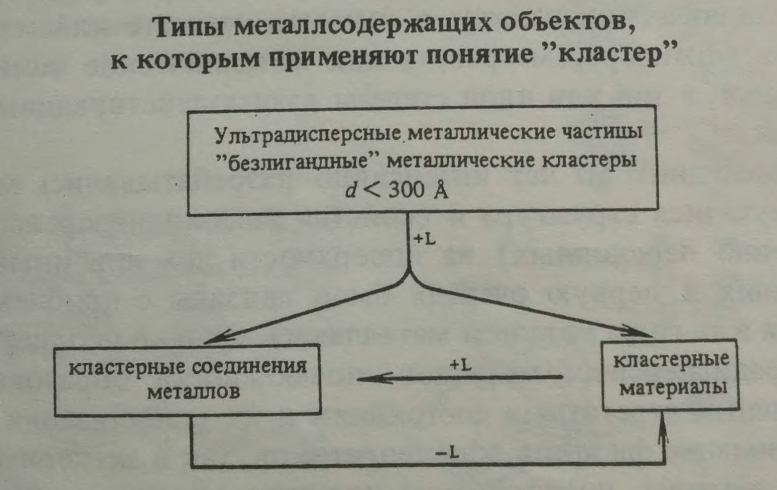 Общая структура кластеров представлена на схеме 1.1[1, c.9, схемa 1]. Характерным признаком кластерных соединений служат короткие расстояния металл-металл(не более 3,5Ǻ) и значительные взаимодействия М-М. Кластеры могут быть как гомо-(состоящими из атомов одного элемента), так и гетероэлементными. Самыми «простыми» в плане строения являются ультрадисперсные металлические частицы, которые могут быть получены различными физическими методами. Они являются метастабильными и склонны к агрегации, поэтому для стабилизации их покрывают лигандами, в качестве которых могут быть использованы небольшие частицы либо полимеры.В первом случае мы приходим к молекулярным кластерам, во втором – к кластерным материалам. Были разработаны реакции, осуществляющие переходы между ними.
Общая структура кластеров представлена на схеме 1.1[1, c.9, схемa 1]. Характерным признаком кластерных соединений служат короткие расстояния металл-металл(не более 3,5Ǻ) и значительные взаимодействия М-М. Кластеры могут быть как гомо-(состоящими из атомов одного элемента), так и гетероэлементными. Самыми «простыми» в плане строения являются ультрадисперсные металлические частицы, которые могут быть получены различными физическими методами. Они являются метастабильными и склонны к агрегации, поэтому для стабилизации их покрывают лигандами, в качестве которых могут быть использованы небольшие частицы либо полимеры.В первом случае мы приходим к молекулярным кластерам, во втором – к кластерным материалам. Были разработаны реакции, осуществляющие переходы между ними.
| Таблица 1. 1 |
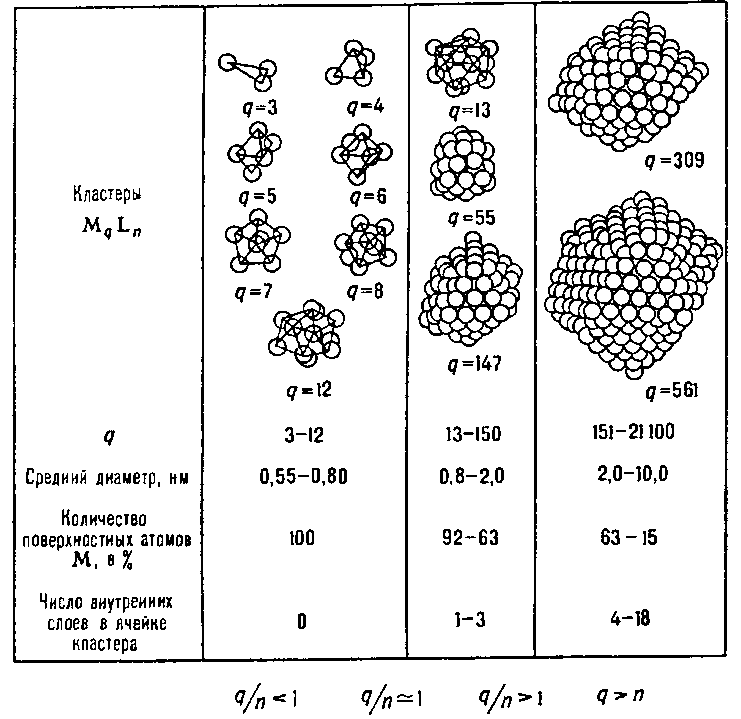 Количество атомов в остове кластера называют его нуклеарностью. В случае металлополиэдрических кластеров она определяет соотношение количеств поверхностных атомов(n) ко внутренним(q), приведенное в таблице 1.1[2, c.792, pисунок 5], которое во многом определяет свойства таких объектов. Однако в общем случае кластеры могут представлять собой не только металлополиэдры(характерные для «голых» кластеров, так как в данном случае потенциальная энергия конфигурации будет минимальной), но и металлоцепи и металлоциклы, а также их различные комбинации(слоистые структуры, протяженные каркасы, трубки и т. д.). Они способны существовать, т.к. в целом взаимодействия M-L значительно сильнее взаимодействий M-M и при покрытии лигандами такие структуры стабилизируются.
Количество атомов в остове кластера называют его нуклеарностью. В случае металлополиэдрических кластеров она определяет соотношение количеств поверхностных атомов(n) ко внутренним(q), приведенное в таблице 1.1[2, c.792, pисунок 5], которое во многом определяет свойства таких объектов. Однако в общем случае кластеры могут представлять собой не только металлополиэдры(характерные для «голых» кластеров, так как в данном случае потенциальная энергия конфигурации будет минимальной), но и металлоцепи и металлоциклы, а также их различные комбинации(слоистые структуры, протяженные каркасы, трубки и т. д.). Они способны существовать, т.к. в целом взаимодействия M-L значительно сильнее взаимодействий M-M и при покрытии лигандами такие структуры стабилизируются. |
|
|
При размерах частиц, больших 300 Ǻ, доля поверхностных атомов столь мала, что взаимодействие с лигандами не может существенно повлиять на энергетику частицы в целом, хотя и может изменить её поверхностные свойства.
Концепция плотной упаковки лигандов на поверхности металлического остова
В связи с сильной поляризуемостью связей M-M, их высокой активностью, наиболее стабильной будет являться частица, в которой лиганды будут максимально плотно упакованы, что, с одной стороны, предотвратит агрегацию остовов, а с другой стороны пространственно экранирует остов, затрудняя взаимодействие его с реагентами. При этом при расчетах координационных чисел поступают следующим образом: заменяют внешность каркаса идеализированными поверхностями(линейную цепь – цилиндром ,плоский цикл – тором, правильный полиэдр – шаром и т.д.), параметры поверхностей вычисляют соответственно ковалентным радиусам атомов, а для лигандов принимают модель жёстких сфер с радиусом, равным ван-дер-ваальсовому[1, c.29]. Таким образом находят максимально возможное число лигандов, способных координироваться остовом.
Дата добавления: 2019-09-13; просмотров: 128; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
