ХИМИЧЕСКОЕ РАВНОВЕСИЕ (к заданиям 2,3)
Основные понятия и закономерности
· Химическое равновесие – состояние системы, характеризующееся равными скоростями прямой и обратной реакций.
· Константа химического равновесия – мера глубины прохождения прямой реакции.
· Для системы
aA + bB  cC + dD
cC + dD
математическое выражение константы равновесия (Кс ) имеет вид
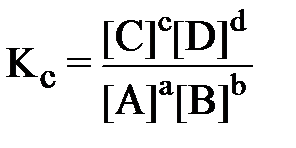 (
( 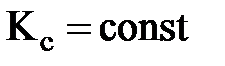 при
при 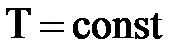 )
)
где [A], [B], [C], [D] – равновесные концентрации реагентов, моль/л;
a, b, c, d – cтехиометрические коэффициенты.
· В математическое выражение константы равновесия гомогенных систем включают концентрации всех реагентов, в выражение константы равновесия гетерогенных систем не включают концентрации твёрдых реагентов.
· Закономерности смещения химического равновесия в результате внешнего воздействия на систему подчиняются принципу Ле Шателье.
Влияние концентраций веществ:
увеличение концентрации исходных веществ смещает равновесие в сторону прямой реакции, уменьшение – в сторону обратной реакции;
увеличение концентрации продуктов реакции смещает равновесие в сторону обратной реакции уменьшение – в сторону прямой реакции.
Влияние общего давления в системе:
увеличение давления смещает равновесие в направлении реакции, идущей с уменьшением количества газообразных веществ;
уменьшение давления смещает химическое равновесие в сторону реакции, идущей с увеличением количества газообразных веществ.
|
|
|
Влияние температуры:
повышение температуры смещает равновесие в сторону эндотермической реакции (ΔН > 0);
понижение температуры смещает равновесие в сторону экзотермической реакции (ΔН < 0).
Примеры решения задач
· Задача 1. Запишите выражения констант химического равновесия реакций
4NO(г) + 6H2O(г)  4NH3(г) + 5O2(г);
4NH3(г) + 5O2(г);
2ZnS(т) + 3O2(г)  2ZnO(т) + 2SO2(г).
2ZnO(т) + 2SO2(г).
Решение.
Реакция
4NO(г) + 6H2O(г)  4NH3(г) + 5O2(г)
4NH3(г) + 5O2(г)
является гомогенной (все реагенты – газообразные вещества), следовательно, в выражение константы равновесия входят равновесные концентрации всех веществ, участвующих в реакции:
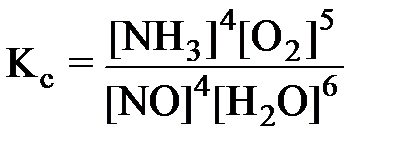
Реакция
2ZnS(т) + 3O2(г)  2ZnO(т) + 2SO2(г).
2ZnO(т) + 2SO2(г).
является гетерогенной, концентрации твердых веществ в выражение константы равновесия не включают:
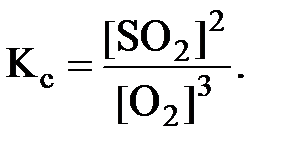
· Задача 2. Определите направление смещения равновесия в системе
2CH4(г) + 3O2(г)  2CO(г) + 4H2O(г)
2CO(г) + 4H2O(г)
· при увеличении концентрации CH4;
· при снижении концентрации O2;
· при увеличении концентрации CO;
· при снижении концентрации H2O.
Решение.
При увеличении концентрации CH4 химическое равновесие смещается в сторону реакции, при которой CH4 расходуется, т.е. в сторону прямой реакции.
При снижении концентрации O2 химическое равновесие смещается в сторону реакции, идущей с образованием O2, т.е. в сторону обратной реакции.
|
|
|
При увеличении концентрации CO химическое равновесие смещается в сторону реакции, при которой CO расходуется, т.е. в сторону обратной реакции.
При снижении концентрации H2O химическое равновесие смещается в сторону реакции, идущей с образованием H2O, т.е. в сторону прямой реакции.
· Задача 3. Определите направление смещения равновесия при снижении общего давления в системах
2СH4(г) + O2(г)  2CO(г) + 4H2(г);
2CO(г) + 4H2(г);
Mn(к) + 2CO(г)  MnO2(к) + 2C(к);
MnO2(к) + 2C(к);
Fe3O4(к).+ H2(г)  3FeO(к) + H2O(г).
3FeO(к) + H2O(г).
Решение.
В системе
2СH4(г) + O2(г)  2CO(г) + 4H2(г)
2CO(г) + 4H2(г)
3 моль 6 моль
газов газов
снижение общего давления приводит к смещению химического равновесия в сторону прямой реакции, так как прямая реакция идет с увеличением количества вещества газов.
В системе
Mn(к) + 2CO(г)  MnO2(к) + 2C(к)
MnO2(к) + 2C(к)
2 моль 0 моль
газов газов
снижение общего давления приводит к смещению химического равновесия в сторону обратной реакции, так как обратная реакция идет с увеличением количества вещества газов.
В системе
Fe3O4(к).+ H2(г)  3FeO(к) + H2O(г)
3FeO(к) + H2O(г)
1 моль 1 моль
|
|
|
газов газов
количество вещества газов в правой и левой части уравнения реакции одинаково, следовательно, изменение давления на химическое равновесие системы не влияет.
· Задача 4. Определите, как изменится равновесное парциальное давление паров воды при повышении температуры в системе
H2O(ж)  H2O(г),
H2O(г), 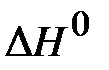 > 0.
> 0.
Решение.
Внешнее воздействие на равновесную систему приводит к смещению химического равновесия. В рассматриваемой системе при повышении температуры равновесие сместится в сторону прямой реакции (эндотермической). Это означает, что концентрация паров воды и соответствующее парциальное давление увеличатся.
· Задача 5. Определите направление смещения равновесия при увеличении температуры в системах
NH4Cl(к)  NH3(г) + HCl(г),
NH3(г) + HCl(г), 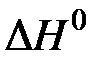 = +63 кДж;
= +63 кДж;
C(к) + O2(г)  CO2(г),
CO2(г), 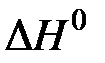 = –394 кДж.
= –394 кДж.
Решение.
Согласно второму следствию закона Гесса, энтальпия прямой реакции равна по модулю и противоположна по знаку энтальпии обратной реакции.
В системе
NH4Cl(к)  NH3(г) + HCl(г),
NH3(г) + HCl(г), 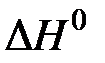 = +63 кДж
= +63 кДж
прямая реакция эндотермическая, обратная – экзотермическая. При увеличении температуры равновесие смещается в сторону прямой (эндотермической) реакции.
В системе
C(к) + O2(г)  CO2(г),
CO2(г), 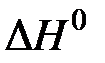 = –394 кДж
= –394 кДж
|
|
|
прямая реакция экзотермическая, обратная – эндотермическая. При увеличении температуры равновесие в системе смещается в сторону обратной (эндотермической) реакции.
· Задача 6. Определите, как изменится при повышении температуры константа равновесия реакции
2SO2(г) + O2(г)  2SO3(г),
2SO3(г), 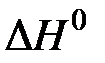 < 0.
< 0.
Решение.
Выражение константы равновесия:
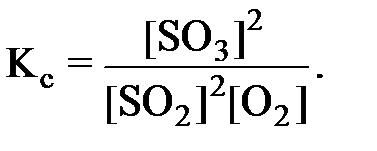
Прямая реакция экзотермическая, обратная – эндотермическая. При повышении температуры равновесие сместится в сторону обратной реакции, т.е. концентрации SO2 и O2 увеличатся, а концентрация SO3 уменьшится. Константа равновесия уменьшится.
· Задача 7. Константа равновесия реакции CaCO3(т)  CaO(т) + CO2(г) увеличивается с ростом температуры. Укажите, как при этом будет меняться равновесное парциальное давление CO2. Ответ обоснуйте.
CaO(т) + CO2(г) увеличивается с ростом температуры. Укажите, как при этом будет меняться равновесное парциальное давление CO2. Ответ обоснуйте.
Решение.
Выражение константы равновесия через равновесные парциальные давления веществ
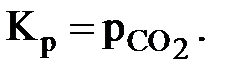
С ростом температуры равновесное парциальное давление СО2 увеличивается.
Дата добавления: 2019-09-13; просмотров: 323; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
