Определите, сколько теплоты выделится, если в результате реакции горения сероуглерода
Домашняя работа №1
Термохимия. Химическое равновесие
Домашнюю работу выполните на отдельном листе, обязательно укажите номер варианта. Домашняя работа включает три задания, в каждом студент отвечает на вопрос с номером варианта. Номера вариантов задаёт преподаватель. Необходимый теоретический материал рассмотрен на лекциях. Кратко необходимая теория и примеры разобранных решений задач приведены в конце данного файла.
ВАРИАНТЫ ЗАДАНИЙ
Задание 1. Решение задач по термохимии.
Условия прохождения реакций принять стандартными. Необходимые для решения значения стандартных энтальпий образования веществ приведены в таблице (см. конец задания 1).
1. При сжигании графита в стандартных условиях образуется 4,48 л оксида углерода (IV) и выделяется 78,7 кДж теплоты. Рассчитайте стандартную энтальпию образования оксида углерода (IV).
2. Определите, сколько теплоты выделится при сжигании 38 г сероуглерода:
CS2(ж) + 3O2(г) = CО2(г) + 2SO2(г) .
Допишите термохимическое уравнение реакции.
3. Определите стандартную энтальпию образования PH3(г), исходя из термохимического уравнения:
2PH3(г) + 4О2(г) = P2O5(т) + 3H2O(ж), 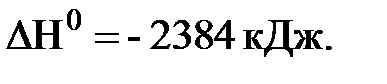
4. Составьте термохимическое уравнение и укажите, экзо- или эндотермической является данная реакция:
C(т) + H2O(г) = CO(г) + H2(г).
5. Определите, какое количество теплоты выделится в стандартных условиях при получении 1,48 кг гашёной извести по уравнению
CaO(т) + H2O(ж) = Ca(OH)2(т).
|
|
|
Допишите термохимическое уравнение реакции.
6. Рассчитайте стандартную энтальпию реакции
2PbS(к) + 3O2(г) = 2PbO(к) + 2SO2(г).
Укажите, экзо- или эндотермической является данная реакция.
7. Рассчитайте, какое количество теплоты выделяется в стандартных условиях при получении 2 кг железа по реакции
Fe2O3(к) + 3CO(г) = 2Fe(к) + 3CO2(г).
Допишите термохимическое уравнение реакции.
8. Определите стандартную энтальпию образования С3H8, если известно, что при сгорании 11 г данного вещества выделилось 552 кДж теплоты. Допишите термохимическое уравнение
C3H8(г) + 5O2(г) = 3CO2(г) + 4H2O(ж).
9. Рассчитайте стандартную энтальпию образования сульфата алюминия по известному термохимическому уравнению и известным значениям энтальпий образования (табл.)
2Al2O3(т) + 6SO2(г) + 3O2(г) = 2Al2(SO4)3(т), 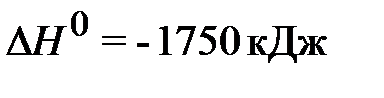 .
.
10. При сгорании этилена
C2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(ж)
выделилось 6226 кДж теплоты. Определите объём вступившего в реакцию кислорода.
11. При взаимодействии 3,6 г оксида железа (II) с кремнием по уравнению
2FeO(т) + Si(т) = 2Fe(т) + SiO2(т)
выделилось 8,3 кДж теплоты. Рассчитайте стандартную энтальпию образования оксида железа (II), используя данные таблицы.
12. Рассчитайте энтальпию образования оксида фосфора (V), если известно, что при сжигании 4 г фосфора в стандартных условиях выделяется 97,2 кДж теплоты. Напишите термохимическое уравнение реакции образования оксида фосфора (V) из простых веществ.
|
|
|
13. Определите, какое количество теплоты выделяется при сжигании 100 г магния в стандартных условиях. Напишите термохимическое уравнение реакции.
14. В результате реакции
2C2H2(г) + 5O2(г) = 4CO2(г) + 2H2O(г), 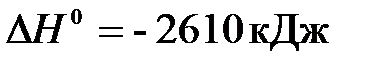
в стандартных условиях выделилось 652,5 кДж теплоты. Определите объём сгоревшего ацетилена.
15. При образовании 1,8 г H2O(ж) из газообразных водорода и кислорода выделяется 28,6 кДж теплоты. Напишите термохимическое уравнение реакции.
16. Рассчитайте, какое количество теплоты необходимо для разложения 126 г MgCO3. Напишите термохимическое уравнение реакции.
17. В результате сгорания 48 г метана выделилось 2406 кДж теплоты. Допишите термохимическое уравнение реакции
CH4(г) + O2(г) = CO2(г) + 2H2O(г).
18. Рассчитайте, какой объём кислорода выделился в результате разложения бертолетовой соли
2KClO3(т) = 2KCl(т) + 3O2(г), 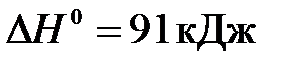 ,
,
если поглощено 182 кДж теплоты.
19. При сжигании 8 г серы с образованием оксида серы (IV) выделилось 73,85 кДж теплоты. Напишите термохимическое уравнение этой реакции.
20. Рассчитайте, какое количество теплоты выделится при сгорании 36 г графита с образованием оксида углерода (IV). Напишите термохимическое уравнение реакции.
|
|
|
Определите, сколько теплоты выделится, если в результате реакции горения сероуглерода
CS2(ж) + 3O2(г) = CО2(г) + 2SO2(г)
образовалось 11,2 л оксида серы (IV). Допишите термохимическое уравнение реакции.
22. Определите, какое количество теплоты выделится в стандартных условиях при гашении 1,12 кг извести:
CaO(т) + H2O(ж) = Ca(OH)2(т).
Допишите термохимическое уравнение реакции.
23. Определите стандартную энтальпию реакции
2PbS(к) + 3O2(г) = 2PbO(к) + 2SO2(г).
Рассчитайте, какое количество теплоты выделится или поглотится при образовании 42,6 г оксида свинца (II).
24. Рассчитайте, какое количество теплоты выделяется в стандартных условиях, если в результате реакции образовалось 112 л оксида углерода (IV):
Fe2O3(к) + 3CO(г) = 2Fe(к) + 3CO2(г).
Допишите термохимическое уравнение реакции.
25. При сгорании в стандартных условиях этилена
C2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(ж)
выделилось 6226 кДж теплоты. Определите объём вступившего в реакцию этилена, допишите термохимическое уравнение реакции.
26. Рассчитайте энтальпию образования оксида серы (IV), если известно, что при сжигании 40 г серы в стандартных условиях выделяется 369,2 кДж теплоты. Напишите термохимическое уравнение реакции образования оксида серы (IV).
|
|
|
27. Рассчитайте, какое количество теплоты необходимо для разложения 300 г СaCO3. Напишите термохимическое уравнение реакции.
28. В результате сгорания 48 г метана выделилось 2406 кДж теплоты. Допишите термохимическое уравнение реакции
CH4(г) + O2(г) = CO2(г) + 2H2O(г).
Рассчитайте, какое количество теплоты выделится, если в результате реакции образовалось 10 моль воды.
29. Рассчитайте, сколько граммов хлорида калия образовалось в результате разложения бертолетовой соли
2KClO3(т) = 2KCl(т) + 3O2(г), 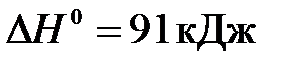 ,
,
если поглощено 364 кДж теплоты.
30. Рассчитайте, какое количество теплоты выделяется или поглощается при получении 44,8 л оксида углерода (II) в результате реакции
C(т) + H2O(г) = CO(г) + H2(г).
Допишите термохимическое уравнение данной реакции.
Таблица
Дата добавления: 2019-09-13; просмотров: 708; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
