Стандартные энтальпии образования
некоторых веществ при Т=298К
| Вещество | DН0, кДж/моль | Вещество | DН0, кДж/моль |
| Al2O3(к) | -1676 | KCl | -433 |
| ВаСО3(к) | -1202 | MgСО3(к) | -1096 |
| СаО (т) | -635 | MgO (к) | -601 |
| СаСО3(к) | -1205 | NH3 (г) | -46 |
| Са(ОН) 2(т) | -987 | NO(г) | +91 |
| C2H2(г) | +227 | NO2 (г) | +33 |
| C2H4(г) | +52 | N2O4 (г) | +9 |
| СН4(г) | -75 | N2O (г) | +82 |
| СО(г) | -110 | P2O5(т) | –1492 |
| СО2(г) | -393 | PbO(к) | –219 |
| CS2(ж) | +88 | PbS(к) | –94 |
| Fe2O3(к) | -824 | SО2 (г) | –296 |
| Fe3O4(к) | -1118 | SО3 (г) | –395 |
| HCl(г) | -92 | SiО2 (т) | –872 |
| Н2О(г) | -242 | ZnО(к) | -349 |
| Н2О(ж) | -286 | ZnS (к) | -210 |
| KClO3(т) | -399 |
Задание 2. Константа химического равновесия – физический смысл,
математическое выражение, зависимость от различных факторов.
1. Запишите выражение константы равновесия:
2Fe2O3(т) + 3С(т)  4Fe(т) + 3CO2(г)
4Fe(т) + 3CO2(г)
2. Укажите, в растворе какой из кислот (HBrO или HСlO), концентрация ионов H+ больше, если концентрации растворов одинаковы. Ответ мотивируйте. Значения констант равновесий:
HBrO  H+ + BrO-, K = 2.10-9
H+ + BrO-, K = 2.10-9
HClO  H+ + ClO-, K = 3.10-8
H+ + ClO-, K = 3.10-8
3. Запишите выражение константы равновесия:
4Fe(т) + 3O2(г)  2Fe2O3(т)
2Fe2O3(т)
4. Укажите реакцию, константа равновесия которой увеличится с ростом температуры
а) N2O4(г)  2NO2(г), DH>0
2NO2(г), DH>0
б) H2(г) + Cl2(г)  2HCl(г), DH<0
2HCl(г), DH<0
Ответ мотивируйте.
5. Запишите выражение константы равновесия:
TiI4(г)  Ti(т) + 2I2(г)
Ti(т) + 2I2(г)
6. Константа равновесия
PbO(т) + CO2(г)  PbCO3(т)
PbCO3(т)
уменьшается с ростом температуры. Укажите, как будет меняться равновесное парциальное давление CO2 при нагревании. Ответ мотивируйте.
|
|
|
7. Запишите выражение константы равновесия:
SO2(г) + 2H2(г)  S(т) + 2H2O(г)
S(т) + 2H2O(г)
8. В растворе какой кислоты (HCN или CH3COOH) концентрация ионов H+ будет меньше, если концентрации растворов кислот одинаковы, а константы равновесия имеют значения:
HCN  H+ + CN-, K = 5.10-10
H+ + CN-, K = 5.10-10
CH3COOH  H+ + CH3COO-, K = 2.10-5
H+ + CH3COO-, K = 2.10-5
Ответ мотивируйте.
9. Запишите выражение константы равновесия:
C(т) + 2H2(г)  CH4(г)
CH4(г)
10. Укажите, как изменится константа равновесия
2SO2(г) + O2(г)  2SO3(г), DH<0,
2SO3(г), DH<0,
при повышении температуры. Ответ мотивируйте.
11. Запишите выражение константы равновесия:
Fe2O3(т) + 3СO(г)  2Fe(т) + 3CO2(г)
2Fe(т) + 3CO2(г)
12. Константа равновесия
Ni(CO)4(г)  Ni(т) + 4CO(г)
Ni(т) + 4CO(г)
увеличивается с ростом температуры. Укажите, как при этом будет изменяться равновесная концентрация CO. Ответ мотивируйте.
13. Запишите выражение константы равновесия:
2ZnS(т) + 3O2(г)  2ZnO(т) + 2SO2(г)
2ZnO(т) + 2SO2(г)
14. Укажите кислоту (HBrO, HIO или HСlO), в растворе которой концентрация ионов H+ будет больше, если концентрации растворов кислот одинаковы. Константы равновесия имеют значения:
HBrO  H+ + BrO-, K = 2.10-9
H+ + BrO-, K = 2.10-9
HIO  H+ + IO-, K = 2.10-11
H+ + IO-, K = 2.10-11
HClO  H+ + ClO-, K = 3.10-8
H+ + ClO-, K = 3.10-8
Ответ мотивируйте.
15. Запишите выражение константы равновесия:
2N2O5(т)  4NO2(г) + O2(г)
4NO2(г) + O2(г)
16. Укажите реакцию, константа равновесия которой уменьшится при понижении температуры
|
|
|
а) CO2(г) + C(т)  2CO(г), DH>0
2CO(г), DH>0
б) C(т.) + O2(г.)  CO2(г.), DH<0
CO2(г.), DH<0
Ответ мотивируйте.
17. Запишите выражение константы равновесия:
2S(т) + 3O2(г)  2SO3(г)
2SO3(г)
18. Укажите, как изменится константа равновесия и выход аммиака при повышении температуры:
N2(г) + 3H2(г)  2NH3(г), DH<0.
2NH3(г), DH<0.
Ответ мотивируйте.
19. Запишите выражение константы равновесия:
MnO2(т) + 2C(т)  Mn(т) + 2CO(г)
Mn(т) + 2CO(г)
20. Укажите, в растворе какой кислоты (HBrO или HIO) равной концентрации больше концентрация ионов. Константы равновесий имеют следующие значения:
HBrO  H+ + BrO-, K = 2. 10-9
H+ + BrO-, K = 2. 10-9
HIO  H+ + IO-, K = 2.10-11
H+ + IO-, K = 2.10-11
Ответ мотивируйте.
21. Запишите выражение константы равновесия:
CaCO3(т) + H+(р)  Ca2+(р) + HCO3-(р)
Ca2+(р) + HCO3-(р)
22. Укажите, как изменится константа равновесия
N2O4(г)  2NO2(г) , DH>0,
2NO2(г) , DH>0,
при повышении температуры. Ответ мотивируйте.
23. Запишите выражение константы равновесия:
MnS(т) + 2H+(р)  Mn2+(р) + H2S(р)
Mn2+(р) + H2S(р)
24. Укажите, как влияют на константу равновесия (увеличивают, уменьшают или не изменяют)
а) присутствие катализатора;
б) увеличение концентрации реагентов.
25. Запишите выражение константы равновесия:
MnO2(т) + 2C(т)  Mn(т) + 2CO(г)
Mn(т) + 2CO(г)
26. Укажите, как изменится константа равновесия
CO2(г) + C(т)  2CO(г), DH>0,
2CO(г), DH>0,
при повышении температуры. Ответ мотивируйте.
27. Запишите выражение константы равновесия:
|
|
|
TiI4(г)  Ti(т) + 2I2(г)
Ti(т) + 2I2(г)
28. Константа равновесия
МgCO3(т)  MgO(т) + CO2(г)
MgO(т) + CO2(г)
уменьшается с понижением температуры. Укажите, как при этом изменяется равновесное парциальное давление CO2.
29. Запишите выражение константы равновесия:
Fe(CO)5(г)  Fe(т) + 5CO(г)
Fe(т) + 5CO(г)
30. Предложите и обоснуйте возможный способ увеличения константы равновесия в системе
2CO(г) + O2(г)  2CO2(г),
2CO2(г), 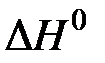 < 0.
< 0.
Задание 3. Влияние различных факторов на смещение химического равновесия.
Принцип Ле Шателье.
1. Укажите три возможных варианта изменения концентрации ионов H+, Sn2+ или Cl-, которые приведут к увеличению содержания SnOHCl в системе
SnOHCl + H+  Sn2+ + Cl- + H2O.
Sn2+ + Cl- + H2O.
2. Определите направление смещения равновесия
Ni(CO)4(г)  Ni(т) + 4CO(г)
Ni(т) + 4CO(г)
при повышении давления. Ответ мотивируйте.
3. Укажите систему, равновесие в которой при повышении температуры смещается в сторону исходных веществ
а) H2(г) + Cl2(г)  2HCl(г), DH<0;
2HCl(г), DH<0;
б) MnO2(т) + 2C(т)  Mn(т) + 2CO(г), DH>0.
Mn(т) + 2CO(г), DH>0.
Ответ мотивируйте.
4. Укажите, как повлияет на концентрацию каждой из частиц (Cl-, ClO-, Cl2) добавление щелочи в равновесную систему
Cl2 + 2OH-  Cl- + ClO- + H2O.
Cl- + ClO- + H2O.
5. Определите направление смещения равновесия
2ZnS(т) + 3O2(г)  2ZnO(т) + 2SO2(г)
2ZnO(т) + 2SO2(г)
при понижении давления. Ответ мотивируйте.
6. Определите, приведет ли повышение температуры в равновесной системе
|
|
|
N2(г) + 3H2(г)  2NH3(г), DH<0,
2NH3(г), DH<0,
к образованию дополнительного количества NH3. Ответ мотивируйте.
7. Укажите ион (Co2+, Cl- или H+), повышение концентрации которого сместит в сторону прямой реакции равновесие
CoOHCl + H+  Co2+ + Cl- + H2O.
Co2+ + Cl- + H2O.
8. Определите, как следует изменить давление, чтобы сместить в сторону прямой реакции равновесие
Fe(CO)5(г)  Fe(т) + 5CO(г)
Fe(т) + 5CO(г)
Ответ мотивируйте.
9. Укажите, как изменится парциальное давление кислорода в равновесной системе
2CoO(т)  2Co(т) + O2(г), DH>O
2Co(т) + O2(г), DH>O
при повышении температуры. Ответ мотивируйте.
10. Укажите влияние добавления щелочи в систему
3I2 + 6OH-  5I- + IO3- + 3H2O
5I- + IO3- + 3H2O
на направление смещения равновесия и изменение содержания I2.
11. Выберите систему, равновесие в которой не нарушится при увеличении давления:
а) C(т) + CO2(г)  2CO(г);
2CO(г);
б) C(т) + 2H2(г)  CH4(г);
CH4(г);
в) CH4(г) + 2O2(г)  CO2(г) + 2H2O(г).
CO2(г) + 2H2O(г).
Ответ мотивируйте.
12. Определите направление смещения равновесия
4HCl(г) + O2(г)  2H2O(г) + 2Cl2(г), DH<0,
2H2O(г) + 2Cl2(г), DH<0,
при понижении температуры. Ответ мотивируйте.
13. Укажите, как следует изменить концентрацию каждого из ионов (H+, Mn2+), чтобы сместить в сторону обратной реакции равновесие
MnS + 2H+  Mn2+ + H2S.
Mn2+ + H2S.
14. Выберите систему, в которой при повышении давления равновесие смещается в сторону прямой реакции:
а) S(т) + O2(г)  SO2(г); б) C(т) + CO2(г)
SO2(г); б) C(т) + CO2(г)  2CO(г);
2CO(г);
в) 2SO2(г) + O2(г)  2SO3(г).
2SO3(г).
Ответ мотивируйте.
15. Укажите, как изменится парциальное давление CO2 в равновесной системе
MgCO3(т)  MgO(т) + CO2(г), DH>0,
MgO(т) + CO2(г), DH>0,
при понижении температуры. Ответ мотивируйте.
16. Укажите ион (Al3+ или AlO2-), концентрация которого уменьшится при добавлении кислоты в равновесную систему.
AlO2- + 4H+  Al3+ + 2H2O.
Al3+ + 2H2O.
17. Выберите систему, в которой при повышении давления равновесие смещается в сторону прямой реакции
а) S(т) + O2(г)  SO2(г); б) C(т) + CO2(г)
SO2(г); б) C(т) + CO2(г)  2CO(г);
2CO(г);
в) 2SO2(г) + O2(г)  2SO3(г).
2SO3(г).
Ответ мотивируйте.
18. Укажите вещество (CO, CO2, C), которое будет накапливаться в равновесной системе
C(т) + CO2(г)  2CO(г), DH>0,
2CO(г), DH>0,
при повышении температуры. Ответ мотивируйте.
19. Укажите частицы (Cl-, ClO- или Cl2), концентрация которых увеличится при добавлении щелочи в равновесную систему
Cl2 + 2OH-  Cl- + ClO- + H2O.
Cl- + ClO- + H2O.
20. Определите направление смещения равновесия
TiI4(г)  Ti(т) + 2I2(г)
Ti(т) + 2I2(г)
при увеличении давления. Ответ мотивируйте.
21. Определите направление смещения равновесия
2H2S(г) + 3O2(г)  2H2O(г) + 2SO2(г), DH<0,
2H2O(г) + 2SO2(г), DH<0,
при понижении температуры. Ответ мотивируйте.
22. Укажите направление смещения равновесия
Fe3+ + 3SCN-  Fe(SCN)3
Fe(SCN)3
при добавлении KSCN (повышении концентрации ионов SCN-).
23. Определите направление смещения равновесия
S(т) + 2H2O(г)  SO2(г) + 2H2(г)
SO2(г) + 2H2(г)
при понижении давления. Ответ мотивируйте.
24. Укажите, как изменится парциальное давление кислорода в равновесной системе
2CoO(т)  2Co(т) + O2(г), DH>0,
2Co(т) + O2(г), DH>0,
при понижении температуры. Ответ мотивируйте.
25. Укажите направление смещения равновесия
CaCO3 + 2H+  Ca2+ + CO2 + H2O
Ca2+ + CO2 + H2O
а) при добавлении кислоты; б) при понижении концентрации CO2.
26. Определите направление смещения равновесия
S(т) + 2H2O(г)  SO2(г) + 2H2(г)
SO2(г) + 2H2(г)
при понижении давления. Ответ мотивируйте.
27. Укажите систему, в которой при охлаждении равновесие смещается в сторону прямой реакции
а)2N2O5(т)  4NO2(г) + O2(г) , DH>0;
4NO2(г) + O2(г) , DH>0;
б)2NO(г) + O2(г)  2NO2(г), DH<0.
2NO2(г), DH<0.
Ответ мотивируйте.
28. Укажите ион (Ni2+, Cl- или H+), повышение концентрации которого приведёт к уменьшению содержания основной соли NiOHCl в системе
NiOHCl + H+  Ni2+ + Cl- + H2O.
Ni2+ + Cl- + H2O.
29. Выберите систему, в которой при увеличении давления равновесие смещается в сторону прямой реакции
а) C(т) + H2O(г)  СO(г) + H2(г); б) Ti(т) + 2I2(г)
СO(г) + H2(г); б) Ti(т) + 2I2(г)  TiI4(г);
TiI4(г);
в) CO(г) + H2O(г)  CO2(г) + H2(г).
CO2(г) + H2(г).
Ответ мотивируйте.
30. Укажите систему, в которой при охлаждении равновесие смещается в сторону прямой реакции
а)2N2O5(т)  4NO2(г) + O2(г) , DH>0
4NO2(г) + O2(г) , DH>0
б)2NO(г) + O2(г)  2NO2(г), DH<0
2NO2(г), DH<0
Ответ мотивируйте.
Критерии оценок
Дата добавления: 2019-09-13; просмотров: 247; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
