Формулы тридцати важнейших кислот и названия их солей
Министерство сельского хозяйства Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
Высшего образования «Вологодская государственная молочнохозяйственная академия имени Н.В. Верещагина»
Кафедра «Технологии молока и молочных продуктов»
Преподаватель: доц. Полянская Ирина Сергеевна
ХИМИЯ (или Химия неорганическая)
ГЛОССАРИЙ КУРСА (термины и определения, т еза́урус )
( глоссарий от лат. glossarium — «собрание глосс», т еза́урус от греч. θησαυρός — «сокровищница», гиперссылки
для выполнения индивидуальных проектов по темам)гиперссылки для выполнения индивидуальных проектов
2019-2020 уч. год (6 коллоквиумов по разделам)
Корректирующий Модуль. Раздел 1. Химия: основные понятия. Валентность, степень окисления, формулы соединений. Классы, названия соединений и их основные свойства
1. Атом, молекула, ион (катион, анион). Валентность (ковалентность). Степень окисления элемента в веществе.
2. Химический элемент, изотопы.
3. Эмпирические формулы и структурные формулы веществ.
4. Простые вещества. Cложные неорганические вещества (соединения). Класс органических соединений.
5. Основны́е оксиды и их свойства. Кислотные оксиды, их свойства.
6. Амфотерные оксиды и их свойства.
7. Кисло́ты и их свойства.
8. Основания (осно́вные гидрокси́ды) и их свойства.
|
|
|
9. Со́ли и их свойства.
10. Комплексное соединение. Лиганд, комплексообразователь, координационное число.
1. 1. Атом – электронейтральная частица, состоящая из положительно заряженного ядра и отрицательных электронов; наименьшая химически неделимая частица, входящая в состав простых и сложных веществ. Молекула – наименьшая частица данного вещества, обладающая его химическими свойствами; наименьшая электронейтральная замкнутая совокупность атомов, образующих определенную структуру с помощью химических связей.
Валентность (ковалентность) В – число электронных пар, связывающих данный атом с другими атомами в конкретном соединении. Имеет смысл только для соединений, в которых все химические связи являются двухцентровыми, т.е. каждая связь осуществляется парой электронов, находящейся между двумя атомами в молекуле. В большинстве соединений определяют не валентность, универсальную С.О.
Степень окисления С.О.– заряд, который приобрел бы атом, если бы все химические связи были чисто ионными, т.е. если бы все электронные пары были сдвинуты в сторону более электроотрицательного элемента. Для молекул, состоящих из одинаковых атомов, равна нулю. Степень окисления иногда не совпадает с валентностью. Например, в катионе аммония, аммиаке, в простых веществах: NH4: В=4 , С.О. = -3; NH3 В=4 , С.О. = -3. С.О. может быть дробная, например, в азидоводороде NH3 – у атома азота С.О. = -1/3
|
|
|
Степень окисления конкретного элемента в веществе (общее правило):
• 0 в простых веществах: H20, О30, S80.
• +1 для Н (в гидридах щелочных мет.- I) и щелочных мет.; H+2O, H+2SO4, Na+H-.
• +2 – для щелочноземельных мет. и Zn: Ca+2(OH)2, Zn+2 О.
• +3 – для В, Аl: (Al+3(OH)3.
• -2 – для атомов кислорода: H+2O-2; (в перекисях -I: H+2O2-);
• переменная для других элементов, и рассчитывается исходя из электронейтральности молекулы, например в молекуле серной кислоты H2SO4 С.О. атома водорода +1; атома кислорода -2, электронейтральность обеспечивается при С.О. атома серы +6.
1.2. Химический элемент – более широкое понятие, чем атом, включает все изотопы, характеризующиеся определенным зарядом ядра. Например Н – атом водорода, состоит из элементов протия 11Н, дейтерия12Н и трития 13Н. Радиоактивные элементы подвергаются ядерным реакциям.
1.3. Эмпирические формулы показывают сколько каких атомов содержится в молекуле: Оксид углерода(IV) CO2. Структурные формулы дополнительно показывают валентность каждого атома (число электронных пар, т.е. связей черточками или парами точек): О=С=О или О : С : О.
|
|
|
1.4. Простые вещества состоят из одинаковых атомов: H2- водород О2, - кислород, О3- озон, N2 - азот, Cl2 - хлор, S - сера, S8 – газообразная сера C - углерод, C60 - фуллерен.
C ложные неорганические вещества (соединения) состоят из нескольких различных атомов: 1) оксиды (H2O, CaO, CO2, P2O5 (P4O10) и др.) бывают: не образующие гидроксидов (не кислотообразующие, например СО, NO), кислотные, основные, амфотерные
2) гидроксиды: основания (Na(OH), Ca(OH)2 и др.); кислородосодержащие кислоты (HNO3, H2SO4, H3PO4 и др.); амфотерные гидроксиды (Al(OH)3, Fe(OH)3 и др.); 3) безкислородные кислоты (HCl, HCN и др.); 4) соли (NaCl, KNO3, Fe2(SO4)3, LiBr и др.), кристаллогидраты солей: (CuSO4·5H2O и др.) 5) комплексные соединения: (K3[Fe(CN)6] и др.)
Класс органических соединений. Химические соединения делят на классы: неорганические и органические. Органические соединения, органические вещества — класс химических соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода и цианидов).
1.5. Кислотные оксиды (ангидриды) – оксиды, растворяющиеся только в щелочах, с образованием соли и воды. Образуются типичными неметаллами и некоторыми переходными элементами. Элементы в кислотных оксидах обычно проявляют степень окисления от +4 до +7. Оксид углерода(IV) CO2;Оксид серы(IV) SO2; Оксид серы(VI) SO3; Оксид кремния(IV) SiO2; Оксид фосфора(V) P2O5; Оксид хрома(VI) CrO3; Оксид марганца(VII) Mn2O7; Оксид хлора (VII) Cl2O7
|
|
|
Основны́е оксиды – оксиды, которым соответствуют основания. К ним относятся: оксиды металлов главной подгруппы первой группы (щелочные металлы) Li — Fr; оксиды металлов главной подгруппы второй группы (щелочноземельные металлы) Be — Ra, оксиды переходных металлов в низших степенях окисления. Металлы в основных оксидах обычно проявляют степень окисления +1 и +2. Основные оксиды наиболее активных металлов (щелочных и щелочноземельных, начиная с оксида кальция) при взаимодействии с водой (реакция гидратации) образуют соответствующие им гидроксиды (основания). Например, при растворении оксида кальция (негашёной извести) в воде образуется гидроксид кальция – сильное основание: СаO + H2O → Са(OH)2. Оксид лития Li2O; Оксид натрия Na2O; Оксид калия K2O; Оксид серебра Ag2O; Оксид магния MgO; Оксид кальция CaO; Оксид стронция SrO; Оксид бария BaO; Оксид ртути HgO; Оксид марганца MnO; Оксид хрома CrO; Оксид никеля NiO; Оксид франция Fr2O; Оксид цезия Cs2O; Оксид рубидия Rb2O; Оксид меди CuO, Оксид железа(II) FeO.
Амфотерные оксиды — солеобразующие оксиды, проявляющие в зависимости от условий либо осно́вные, либо кислотные свойства (то есть проявляющие амфотерность). Образуются переходными металлами. Металлы в амфотерных оксидах обычно проявляют валентность II, III, IV. Оксид цинка ZnO, Оксид хрома(III) Cr2O3, Оксид алюминия Al2O3, Оксид олова(II) SnO, Оксид олова(IV) SnO2, Оксид свинца(II) PbO, Оксид свинца(IV) PbO2, Оксид титана(IV) TiO2, Оксид марганца(IV) MnO2, Оксид железа(III) Fe2O3, Оксид бериллия BeO.
Примеры реакций амфотерных оксидов: ZnO + H2SO4 → ZnSO4 + H2O;
ZnO + 2NaOH → Na2ZnO2 + H2O; Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, в частности лакмуса на красный. H2CO3 – неустойчивая, H2S – летучая кислота (что важно помнить при написании уравнений ионообменной реакции!)
Формулы тридцати важнейших кислот и названия их солей
| № | Формула кислоты | Название кислоты | Название солеи | № | Формула кислоты | Название кислоты | Название солеи | ||
| 1 | Н2ZnО2 | Цинковая | Цинкаты | 16 | НРО3 | (Мета- )фосфорная | (Мета-) фосфаты | ||
| 2 | Н3АlО3 | Алюминиевая | Алюминаты | 17 | Н3АsО4 | Мышьяковая | Арсенаты | ||
| 3 | НАlО2 | Метаалюминиевая | метаалюминаты | 18 | Н3АsО3 | Мышьяковистая | Арсениты | ||
| 4 | Н3ВО3 | (Орто)- борная | (Орто-)бораты | 19 | H2SO3 | Сернистая | Сульфиты | ||
| 5 | Н2В4О7 | Тетраборная | Тетрабораты | 20 | H2SO4 | Серная | Сульфаты | ||
| 6 | Н2СО3 | Угольная | Карбонаты | 21 | H2S | Сероводород | Сульфиды | ||
| 7 | НСООН | Муравьиная | Формиаты | 22 | H2СrO4 | Хромовая | Хроматы | ||
| 8 | Н2С2О4 | Щавелевая | Оксалаты | 23 | H2Сr2O7 | Двухромовая | Дихроматы | ||
| 9 | СН3СООН | Уксусная | Ацетаты | 24 | HMnO4 | Марганцовая | Перманганаты | ||
| 10 | HCN | Циановодород | Цианиды | 25 | H2МnO4 | Марганцовистая | Манганаты | ||
| 11 | HCNS | Родановодород | Роданиды | 26 | НС l | Хлороводород | Хлориды | ||
| 12 | H2SiO3 | Кремниевая | Силикаты | 27 | НСlO | Хлорноватистая | Гипохлориты | ||
| 13 | HNO2 | Азотистая | Нитриты | 28 | HCIO2 | Хлористая | Хлориты | ||
| 14 | HNO3 | Азотная | Нитраты | 29 | НСlO3 | Хлорноватая | Хлораты | ||
| 15 | Н3РО4 | (Орто- )фосфорная | (Орто-) фосфаты | 30 | НС1O4 | Хлорная | Перхлораты | ||
1.8. Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (гидроксид-аниона) (OH-). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Хорошо растворимые в воде основания называются щелочами. Основные типы реакций гидроксидов – нейтрализации.
1.9. Со́ли — класс химических соединений, состоящих из катионов и анионов. В роли катионов в солях могут выступать катионы металлов, ониевые катионы (катионов аммония  , фосфония
, фосфония 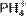 , гидроксония
, гидроксония  и их органические производные), комплексные катионы и т.д., в качестве анионов — анионы кислотного остатка различных кислот, включая комплексные анионы и т.п. Основные типы реакций солей - ионообменные, разложения, замещения.
и их органические производные), комплексные катионы и т.д., в качестве анионов — анионы кислотного остатка различных кислот, включая комплексные анионы и т.п. Основные типы реакций солей - ионообменные, разложения, замещения.
1.10. Комплексное соединение К.С.— химическое вещество, в состав которого входят комплексные частицы. Комплексная частица — сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию. [(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II) (катионное К.С.), K2[BeF4] — тетрафторобериллат(II) калия (анионное К.С.), Li[AlH4] — тетрагидридоалюминат(III) лития (анионное К.С.), [Ni(CO)4] — тетракарбонилникель, [Pt(NH3)2Cl2] — дихлородиамминплатина(II) (нейтральное К.С.).
Типы химических реакций
1. Хими́ческая реа́кция. Типы реакций: - окислительно-восстановительные реакции ОВР и не ОВР;реакции присоединения (ассоциации, агрегации), разложения (отщепления), обмена и замещения, перегруппировки; - нейтрализации, необратимые; обратимые;, эндотермические; реакции. комплексообразования; простые, сложные; - гомогенные, гетерогенные.
2. Окислителыные, восстановительные реакции. реакции диспропорционирования, Вещества окислители и восстановители.
3. Реакции нейтрализации. Ионнообменная реакция. В каких случаях идёт ионообменная реакция. Электрохимическая реакция. Электроды. Анод. Катод.
4. Основные закономерности электрохимического процесса.
5. ЕДС гальванического элемента.
2.1. Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется изотопный состав химических элементов, при этом происходит перераспределение электронов и образуются новые химические вещества.
Т ипы реакций:
- реакции присоединения (ассоциации, агрегации) АВ + С → АВС, разложения (отщепления) АВС → АВ + С, обмена и замещения (число частиц в правой и левой части одинаково) В + С → АС + В, перегруппировки АВС → АСВ;
- нейтрализации, необратимые – реакции, протекающие только в одном направлении до полного израсходования одного из реагирующих веществ; обратимые – процессы, в которых одновременно протекают две взаимно противоположные реакции – прямая и обратная; экзотермические – проходящие с выделением тепла, эндотермические – с поглощением тепла;
- реакции комплексообразования (переноса электронных пар):
Fe+3€€€€€€ + 6 : СN- ® [ Fe (СN)6]
кислота (по-Льюису)
акцептор основание (по-Льюису)
комплексообразователь донор (лиганд)
- простые – реакции протекающие в одну стадию, сложные – реакции протекающие в несколько стадий, каждая из которых является простой. Скорость сложной реакции определяется скоростью наиболее медленной лимитирующей стадии;
- гомогенные – реакции характеризующиеся отсутствием поверхности разделе между реагентами, поэтому их взаимодействие протекает по всему объёму, гетерогенные – реакции, характеризующиеся наличием поверхности раздела, где и протекает взаимодействие и другие типы.
2.2. Окислительно-восстановительные реакции ОВР, в которых атомы одного элемента (окислителя) восстанавливаются, то есть понижают свою степень окисления, а атомы другого элемента (восстановителя) окисляются, то есть повышают свою степень окисления.
Окислитель + е ® восстановитель (окислитель принимает электроны, реакция восстановление): КМn+7O4→ Mn+4O2 (степень окисления понижается, здесь реакция восстановления марганца до четырёхвалентного).
Восстановитель – е ® окислитель (восстановитель отдаёт электроны, реакция окисление); Na2S2- → S0 (степень окисления повышается, здесь реакция окисления серы со С.О. -2 до простого вещества)
Частным случаем окислительно-восстановительных реакций являются реакции диспропорционирования, в которых окислителем и восстановителем являются атомы одного и того же элемента, находящиеся в разных степенях окисления. Пример реакции диспропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрат-аниона, а восстановителем — азот (-3) катиона аммония: NH4NO3 = N2O + 2H2O (до 250 °C).
2.3. Реакции нейтрализации – взаимодействие между веществами кислого и основного характера, с образованием нейтральных веществ (соли, воды): ZnO + 2NaOH → Na2ZnO2 + H2O.
Ионнообменная реакция - обмен ионами между веществами, с образованием осадка (смотреть таблицу растворимости), газа, или слабого электролита (например, воды): Молекулярное уравнение Zn(OH)2 + Na2S → NaOH + Zn S↓ Полное ионное уравнение Zn+2 +2 OH - + Na + + S-2 → Na ++ OH - + Zn S↓ Краткое ионное уравнение Zn+2 + S-2 → Zn S↓
Электрохимическая реакция – ОВР в электрическом поле, создаваемом электродами с выделением на электродах веществ. Электроды — проводники, соединённые с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
2.4. Основные закономерности электрохимического процесса: 1. Восстанавливаются на катоде металлы, стоящие в Электрохимическом ряду активности http://ru.wikipedia.org/wiki/ (ряд напряжений, стандартных электродных потенциалов) металлов до Т i: только из расплавов. Для менее активных металлов от Тi (включительно) до Pb- конкурирующие реакции, выделение водорода, и выделение металла в чистом виде одновременно. Не активные металлы, стоящие правее водорода легко разряжаются и восстанавливается только металл. 2. На аноде легко окисляются OH−, Cl−, Br−, I−, S2−. Тяжело окисляются (только из расплавов) PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F−. В водном растворе электролизу подвергается вода с выделением кислорода. Li→K→Ba→Sr→Ca→Na→Mg→Al→Т i →Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb →H→Sb→Bi→Cu→Hg→Ag→Pt→Au
| Раствор соли активного металла и бескислородной кислотыNaCl ↔ Na+ + Cl−K(-): 2H2O + 2e = H2 + 2OH−A(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2 Вывод: 2NaCl + 2H2O(электролиз) → H2 + Cl2 +2NaOH Раствор соли менее активного металла и бескислородной кислоты ZnCl2 ↔ Zn2+ + 2Cl−K"катод"(-): Zn2+ + 2e = Zn0 A"анод"(+): 2Cl− — 2e = 2Cl0 Вывод: ZnCl2 (электролиз) → Zn + Cl2 Раствор соли активного металла и кислородсодержащей кислоты Na2SO4↔2Na++SO42−K(-): 2H2O + 2e = H2 + 2OH−A(+): 2H2O — 4e = O2 + 4H+ Вывод: 2H2O (электролиз) → 2H2 + O2 | Расплав соли активного металла и бескислородной кислоты NaCl ↔ Na+ + Cl− K(-): Na+ + 1e = Na0 A(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2 Вывод: 2NaCl → (электролиз) 2Na + Cl2 Расплав гидроксида: активный металл и гидроксид-ион NaOH ↔ Na+ + OH− K(-): Na+ +1e =Na0 A(+): 4OH− −4e =2H2O + O2 Вывод: 4NaOH → (электролиз) 4Na + 2H2O + O2 Расплав соли активного металла и кислородосодержащей кислотыNa2SO4↔2Na++SO42−K(-): 2Na+ +2e =2Na0 A(+): 2SO42− −4e =2SO3+O2 Вывод: 2Na2SO4 → (электролиз) 4Na + 2SO3 + O2 |
2.5. ЕДС гальванического элемента ΔE = Eкатода - Eанода; E = E0 + [RT/(z*F)]*ln[C], где E0 – стандартный электродный потенциал, R = 8,31 Дж моль К, z – число электронов ОВР; F = 96485,34 Кл∙моль-1 С – молярная концентрация, http://www.xumuk.ru/galvanopara/
Дата добавления: 2019-09-08; просмотров: 177; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
