Уравнение Шредингера для атома водорода
Уравнение Шредингера, примененное к атому водорода, позволяет получить результаты боровской теории атома водорода без привлечения постулатов Бора и условия квантования. Квантование энергии возникает как естественное условие, появляющееся при решении уравнения Шредингера, в некотором смысле аналогичное причине квантования энергии для частицы в потенциальной яме. Применить стационарное уравнение Шредингера к атому водорода это значит:
а) подставить в это уравнение выражение для потенциальной энергии взаимодействия электрона с ядром:
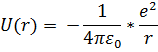
б) в качестве m подставить me - массу электрона:
После этого получим уравнение Шредингера для атома водорода:
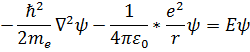
Оператор Лапласа необходимо записать в сферических координатах, т.е. выразить через производные по r, θ и φ. Мы не будем этого делать, поскольку получение решения уравнения Шредингера для атома водорода не входит в программу курса общей физики. Приведем лишь результаты.
Оказывается, что решение уравнения Шредингера для атома водорода существует при следующих условиях:
а) при любых положительных значениях полной энергии (E > 0). Это так называемые несвязанные состояния электрона, когда он пролетает мимо ядра и уходит от него на бесконечность;
б) при дискретных отрицательных значениях энергии
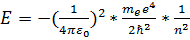 , n = 1,2,3...
, n = 1,2,3...
Эта формула совпадает с полученной Бором формулой для энергии стационарных состояний атома водорода. Целое число n называют главным квантовым числом.
|
|
|
Состав атомного ядра. Нуклоны и их взаимопревращаемость.
Ядра атомов химических элементов состоят из двух видов частиц – протонов и нейтронов. Эти частицы носят название нуклонов. Протонно-нейтронная модель ядра была предложена в 1932 г. одновременно и независимо физиками Иваненко и Гейзенбергом.
Масса протона 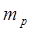 =1836
=1836 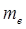 . Собственный магнитный момент протона примерно в 660 раз меньше, чем магнитный момент электрона. Масса протона составляет 1,673∙
. Собственный магнитный момент протона примерно в 660 раз меньше, чем магнитный момент электрона. Масса протона составляет 1,673∙ 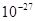 кг, или 1,00728 а.е.м.
кг, или 1,00728 а.е.м.
Протон обладает зарядом +е, имеет спиновое число, равное половине (s= 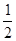 ) и собственный магнитный момент
) и собственный магнитный момент
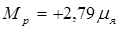 ,
,
где 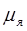 = eh/(2
= eh/(2 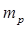 )=5,05∙
)=5,05∙ 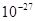
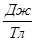 - ядерный магнетон.
- ядерный магнетон.
Протон относится к числу стабильных элементарных частиц.
Нейтрон имеет массу  ∙
∙ 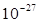 кг, не обладает электрическим зарядом и, также как и протон, имеет спиновое число s =
кг, не обладает электрическим зарядом и, также как и протон, имеет спиновое число s = 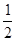 . Магнитный момент нейтрона
. Магнитный момент нейтрона 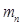 = -1,91
= -1,91 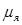 . Знак минус указывает на то, что направления собственных механического и магнитного моментов противоположны.
. Знак минус указывает на то, что направления собственных механического и магнитного моментов противоположны.
В свободном состоянии нейтрон нестабилен (радиоактивен). Он самопроизвольно распадается, превращаясь в протон, испуская электрон
(-е) и еще одну частицу, называемую антинейтрино ( 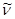 ):
):
|
|
|
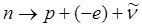 . (.1)
. (.1)
Его период полураспада равен, примерно, 12мин.
Масса антинейтрино пренебрежимо мала по сравнению с массами частиц, фигурирующих в правой части уравнения 1). Масса нейтрона больше массы протона на 2,5 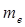 . Следовательно, масса нейтрона превышает суммарную массу частиц в правой части (1) на 1,5 me , т.е. на 0,77 МэВ. Эта энергия выделяется при распаде нейтрона в виде кинетической энергии образующихся частиц.
. Следовательно, масса нейтрона превышает суммарную массу частиц в правой части (1) на 1,5 me , т.е. на 0,77 МэВ. Эта энергия выделяется при распаде нейтрона в виде кинетической энергии образующихся частиц.
Одной из важнейших характеристик атомного ядра является зарядовое число 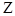 . Оно равно количеству протонов, входящих в состав ядра, и определяет его заряд, равный +
. Оно равно количеству протонов, входящих в состав ядра, и определяет его заряд, равный + 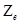 . Число
. Число 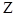 определяет порядковый номер химического элемента в периодической таблице Менделеева.
определяет порядковый номер химического элемента в периодической таблице Менделеева.
Число нуклонов (т.е. суммарное число протонов и нейтронов) в ядре обозначается буквой А и называется массовым числом ядра. Число нейтронов в ядре равно N = A - Z .
Для обозначения ядер применяется символ 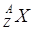 , где под Х подразумевается химический символ данного элемента. Ядра с одинаковым числом Z называется изотопами. Большинство химических элементов имеют по нескольку стабильных изотопов. Например, водород имеет три изотопа:
, где под Х подразумевается химический символ данного элемента. Ядра с одинаковым числом Z называется изотопами. Большинство химических элементов имеют по нескольку стабильных изотопов. Например, водород имеет три изотопа: 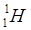 ;
; 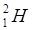 ;
; 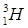 . Изотоп
. Изотоп 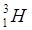 радиоактивен. У кислорода имеется три стабильных изотопа:
радиоактивен. У кислорода имеется три стабильных изотопа: 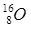 ;
; 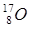 ;
; 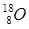 ; у олова – десять и т.д. В подавляющем большинстве изотопы одного химического элемента обладают одинаковыми химическими и близкими физическими свойствами. Всего известно около 300 устойчивых изотопов и более 2000 естественных и искусственно полученных радиоактивных изотопов.
; у олова – десять и т.д. В подавляющем большинстве изотопы одного химического элемента обладают одинаковыми химическими и близкими физическими свойствами. Всего известно около 300 устойчивых изотопов и более 2000 естественных и искусственно полученных радиоактивных изотопов.
|
|
|
Ядра с одинаковыми массовыми числами А называются изобарами
( 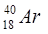 ;
; 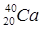 ). Ядра с одинаковым числом нейтронов N = A - Z носят название изотонов (
). Ядра с одинаковым числом нейтронов N = A - Z носят название изотонов (  ;
; 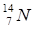 ). Наконец, существуют радиоактивные ядра с одинаковыми Z и A, отличающимися периодом полураспада (
). Наконец, существуют радиоактивные ядра с одинаковыми Z и A, отличающимися периодом полураспада ( 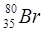 ).Они называются изомерами. Например, имеются два изомера этого ядра, у одного из них период полураспада равен 18 мин, у другого − 4,4 часа.
).Они называются изомерами. Например, имеются два изомера этого ядра, у одного из них период полураспада равен 18 мин, у другого − 4,4 часа.
В природе встречаются элементы с атомными номерами Z от 1 до 92, исключая технеций ( 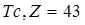 ) и прометий (
) и прометий ( 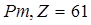 ). Плутоний (
). Плутоний ( 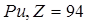 ) в небольших количествах обнаружен в природном минерале – смоляной обманке. Остальные трансурановые (т.е. заурановые) элементы с Z от 93 до 118 были получены искусственным путем посредством различных ядерных реакций. Следует отметить, что ядра всех трансурановых элементов являются короткоживущими, т.е. их период полураспада исчисляется долями секунды. В первом приближении ядро можно считать шаром, радиус которого довольно точно определяется формулой:
) в небольших количествах обнаружен в природном минерале – смоляной обманке. Остальные трансурановые (т.е. заурановые) элементы с Z от 93 до 118 были получены искусственным путем посредством различных ядерных реакций. Следует отметить, что ядра всех трансурановых элементов являются короткоживущими, т.е. их период полураспада исчисляется долями секунды. В первом приближении ядро можно считать шаром, радиус которого довольно точно определяется формулой:
|
|
|
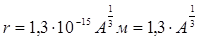 Ферми, (2)
Ферми, (2)
(Ферми– единица длины в ядерной физике, равная 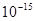 м). Из формулы
м). Из формулы
(2) следует, что объем ядра пропорционален числу нуклонов в ядре. Таким образом, плотность вещества во всех ядрах примерно одинакова.
Протоны и нейтроны являются фермионами, т.к. имеют спин ħ/2. Ядро атома имеет собственный момент импульса– спин ядра:
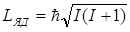 ,
,
где I – внутреннее (полное) спиновое квантовое число.
Число I принимает целочисленные или полуцелые значения 0, 1/2, 1, 3/2, 2 и т.д. Ядра с четными А имеют целочисленный спин(в единицах ħ) и подчиняются статистике Бозе–Эйнштейна (ядра – бозоны). Ядра с нечетными А имеют полуцелый спин(в единицах ħ) и подчиняются статистике Ферми–Дирака(т.е. ядра – фермионы).
Ядерные частицы имеют собственные магнитные моменты, которыми определяется магнитный момент ядра Pmяд в целом. Единицей измерения магнитных моментов ядер служит ядерный магнетон μЯД:
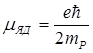 .
.
Ядерный магнетон в mp/me = 1836,5 раз меньше магнетона Бора, отсюда следует, что в основном магнитные свойства атомов определяются магнитными свойствами его электронов.
Между спином ядра Lяд и его магнитным моментом имеется соотношение:
Pmяд= γяд Lяд,
где γяд – ядерное гиромагнитное отношение.
Дата добавления: 2019-07-17; просмотров: 397; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
