Отличительные особенности аэробного и анаэробного дыхания
| Тип дыхания | Аэробное дыхание | Анаэробное дыхание |
| Микро-организмы | Грибы, Бактерии Водоросли | Бактерии, Дрожжи (облигатные и факультативные) |
| Питательные вещества | Органические молекулы углеводы, белки, жиры, спирты | Органические молекулы углеводы, белки и аминокислоты Неорганические молекулы нитраты, сульфаты |
| Пути синтеза АТФ | Субстратное фосфорилирование - гликолиз в цитоплазме (Анаэробное ферментативное расщепление сложных углеводов) Окислительное фосфорилирование (с участием цитохромоксидаз, флавинзависимых оксидаз, флавинзависимых дегидрогеназ) По пути цикла Кребса (ЦТК) и электротранспортной цепи (ЭТЦ) | Субстратное фосфорилирование - гликолиз в цитоплазме |
| Конечный акцептор электронов водорода | Молекулярный кислород С6Н12О6 + 6О2 → 6СО2 + 6Н2О +38АТФ | Органические соединения (по конечному продукту различают спиртовое, молочнокислое, уксуснокислое и другие виды брожения); редко неорганические (нитраты, сульфаты) С6Н12О6 → С2Н5ОН + СО2 + 2АТФ |
| Энергетический выход | 38 молекулы АТФ | 2 молекулы АТФ |
| Конечные продукты | Полное биологическое окисление субстрата до неорганических молекул, СО2 и Н2О не содержат энергии | неполное биологическое окисление субстрата до органических кислот; конечные продукты содержат много энергии |
|
|
|
ФЕРМЕНТЫ МИКРООРГАНИЗМОВ. ИДЕНТИФИКАЦИЯ ЧИСТОЙ КУЛЬТУРЫ ПО БИОХИМИЧЕСКИМ СВОЙСТВАМ.
Ферменты микробов. Ферменты состоят из белковой (апофермент) и небелковой частей (простетическая группа). Простетическая группа обеспечивает специфичность действия каждому ферменту, поэтому он взаимодействует только с одним субстратом.
Ферменты классифицируются:
а) по характеру вызываемых превращений: гидролазы, оксидоредуктазы, трансферазы, лиазы, изомеразы, лигазы;
б) по локализации и месту действия: эндо- и экзоферменты;
в) по времени образования: конститутивные, индуцибельные;
г) по расщепляемому субстрату: сахаролитические, протеолитические, липолитические.
При биохимической дифференциации микробов определяют их свойства:
1 - сахаролитические – способность сбраживать углеводы и многоатомные спирты с образованием кислоты и газа или только кислоты;
2 - протеолитические – способность разлагать белковые продукты с образованием сероводорода, индола и других веществ;
3- гемолитические – способность лизировать эритроциты на кровяном агаре (КА) или на бульоне с отмытыми эритроцитами;
4 - редуцирующие – способность восстанавливать некоторые химические вещества (краски и др.).
|
|
|
Сахаролитические свойства микробов определяют путем посева чистой культуры на специальные дифференциально-диагностические питательные среды, содержащие различные углеводы (лактозу, сахарозу, глюкозу, мальтозу, маннит и др.) и индикатор (реактив Андреде или др.). Наиболее распространенной является среда Гисса, которая представляет собой смесь сахара и индикатора в пептонной воде. Для улавливания газа на дно пробирки со средой опускают «газовки» – поплавки для улавливания газа. Образовавшийся в процессе ферментации газ вытесняет часть среды и скапливается вверху «газовки». Под действием образующейся при расщеплении углевода кислоты индикатор изменяет окраску среды. Поэтому эти среды названы «пестрый ряд». Короткий "пестрый ряд" включает жидкие среды Гисса с моно- и дисахаридами: глюкозой, лактозой, сахарозой, мальтозой и с 6-атомным спиртом – маннитом. В длинный "пестрый ряд" наряду с перечисленными углеводами вводят среды с разнообразными моносахаридами (арабиноза, ксилоза, рамноза, галактоза и др.) и спиртами (глицерин, дульцит, инозит и др.).
Методика определения сахаролитических свойств. Культуру микроорганизмов высевают на жидкие среды Гисса с поплавками (5 пробирок с глюкозой, лактозой, сахарозой, мальтозой и маннитом). Помещают в термостат при температуре 37оС на 24 часа. Определяют в каждой пробирке происшедшие изменения, указывают наличие кислотообразования буквой «К», что видно по покраснению среды, и газообразования буквой «Г», в том случае, если поплавок заполнен газом.
|
|
|
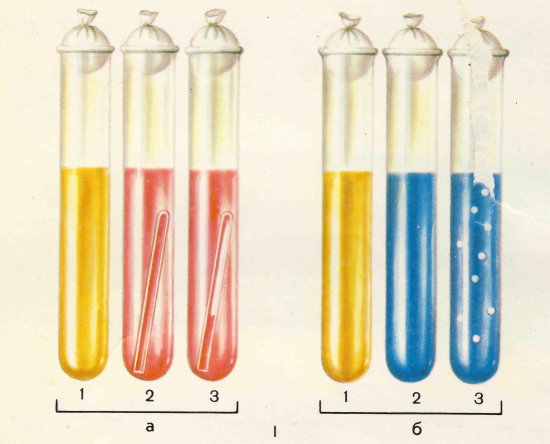
Рис. 9.1. Изучение сахаролитической активности микроорганизмов.
I – «пестрый ряд»: а – жидкая среда с углеводами и индикатором Андреде; б – полужидкая среда с индикатором ВР: 1 – микроорганизмы не ферментируют углевод; 2 – микроорганизмы ферментируют углевод с образованием кислоты; 3 – микроорганизмы ферментируют углевод с образованием кислоты и газа.
Кроме того, сахаролитическую активность изучают на средах Эндо, Левина, Плоскирева. Микроорганизмы, сбраживая до кислоты находящийся в этих средах молочный сахар (лактозу), образуют окрашенные колонии — кислота изменяет цвет имеющегося в среде индикатора. Колонии микробов, не ферментирующих лактозу, бесцветны.
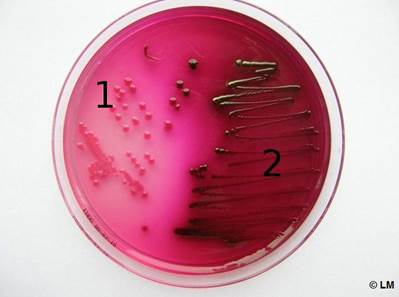

Рис.9.2. Рост энтнробактерий на среде Эндо: 1 – лактозонегативные; 2 – лактозопозитивные.
Рис 9.3. Рост на трехсахарном железосодержащем агаре (среде Олькеницкого):
|
|
|
1. Контроль (незасеянная среда)
2. род Proteus3. род Escherichia
4. род Shigella
5. род Salmonella
Молоко при росте микробов, сбраживающих лактозу, свертывается.
При росте микроорганизмов, образующих амилазу, на средах с растворимым крахмалом происходит его расщепление. Об этом узнают, прибавив к культуре несколько капель раствора Люголя — цвет среды не изменяется. Нерасщепленный крахмал дает с этим раствором синее окрашивание.
Определение протеолитических свойств микробов проводят на средах с желатином, молоком, сывороткой, пептоном.
Пептон – промежуточный продукт распада белков, представляет собой смесь полипептидов и аминокислот. Хорошо растворяется в воде и не свертывается при нагревании. Получают пептон из рубцов крупного и мелкого рогатого скота.
Желатин – животный клей, состоящий из белка сухожилий, костей, хрящей. Светло-коричневого цвета, без запаха и вкуса. Плавится при температуре 32–34оС, застывает при температуре 16оС. При посеве уколом в столбик желатиновой среды микробы, разлагающие желатин, разжижают среду.
Действие микроорганизмов, разлагающих казеин (молочный белок), проявляется в пептонизации молока, которое приобретает вид молочной сыворотки.
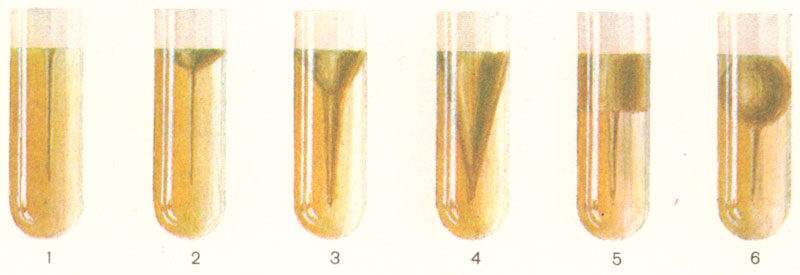
В процессе ферментации пептонов микроорганизмы образуют индол (С8Н7N), сероводород (Н2S), аммиак (NH3) и другие соединения.
Рис. 9.4. Определение протеолитических свойств бактерий - формы разжижения желатина: 1- в форме гвоздя; 2- в форме чашечки; 3 – воронкообразное; 4 – в форме треугольника; 5 – послойное; 6 – мешкообразное.
Методика определения сероводорода. Над культурой исследуемых микробов помещают полоску фильтровальной бумаги, смоченную раствором уксуснокислого свинца или сульфатом железа (бумага закрепляется между пробкой и стенкой пробирки). Пробирки помещают до трех суток в термостат. Почернение бумаги происходит при выделении сероводорода, который превращает уксуснокислый свинец в сернокислый или в нерастворимый сульфид железа. Продукцию сероводорода можно определить также путем посева исследуемой культуры микробов уколом в столбик с питательной средой, содержащей различные соли (сульфат железа, тиосульфат натрия, сульфит натрия). При образовании Н2S среда окрашивается в черный цвет за счет образования сульфида железа (FeS).
Методика определения индола. Определение индола по методу Морелли осуществляют с помощью полоски фильтровальной бумаги, обработанной горячим насыщенным 12 % водным раствором щавелевой кислоты и высушенной в термостате. Бумагу закрепляют между пробкой и стенкой пробирки. Пробирки с исследуемой культурой помещают в термостат на трое суток. Порозовение нижней части индикаторной бумаги указывает на наличие индола. Также индол можно определить по методу Эрлиха. Для этого в пробирку с исследуемой культурой микробов добавляют 2-3 мл эрифа, энергично перемешивают и прибавляют несколько капель реактива Эрлиха (спиртовой раствор параметиламидобензальдегид с хлористоводородной кислотой). При наличии индола наблюдается розовое окрашивание или розовое кольцо.
Методика определения аммиака. Над культурой исследуемых микробов помещают полоску увлажненной красной лакмусовой бумаги (бумага закрепляется между пробкой и стенкой пробирки). Пробирки помещают в термостат. В присутствии аммиака бумага синеет.
В бактериологической практике иногда ограничиваются изучением сахаролитических и протеолитических свойств исследуемых бактерий, если этого достаточно для их идентификации.
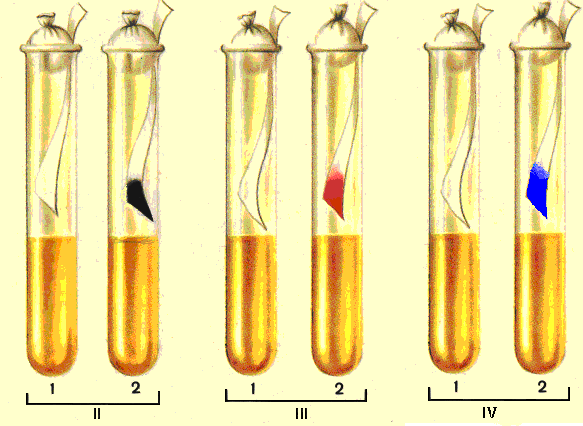
Рис 9.5. Определение протеолитических свойств бактерий: II – определение сероводорода; III - определение индола; IV – определение аммиака. 1- контроль, 2 - положительный результат.
Редуцирующие свойства микробов. Редукцией или восстановлением того или иного вещества называется химический процесс, состоящий в отнятии кислорода от данного вещества или замене его водородом. Имеются вещества, которые при редукции легко обесцвечиваются.
Важным признаком у микробов является способность к образованию фермента каталазы. Для ее обнаружения на предметное стекло наносят каплю 1-3% раствора перекиси водорода и в нее вносят бактериологической петлей исследуемую культуру микробов. При положительном результате наблюдают выделение пузырьков газа в результате разложения Н2О2 на кислород и воду.
При необходимости исследуют другие признаки, например способность восстанавливать нитраты в нитриты, карбоксилировать аминокилоты, образовывать оксидазу, плазмокоагулазу, фибринолизин и другие ферменты.
Тест на оксидаза - используются для дифференциации представителей родов Neisseria, Alcaligenes, Aeromonas, Vibrio, Campylobacter и Pseudomonas (обладают оксидазной активностью) от энтеробактерий (оксидазоотрицательные). Для постановки этого теста, например, используется флакончик, в котором находятся стерильные диски из фильтровальной бумаги, пропитанные оксалатом N,N-диметил-парафенилендиамина, аскорбиновой кислотой и a -нафтолом.
Для осуществления дыхания (биологического окисления с целью получения энергии) у некоторых бактерий имеется цитохромоксидаза, либо индофенолоксидаза – железосодержащий белок, гемопротеин, который катализирует перенос электронов от вещества-донора (например, НАД-Н) к веществам-реципиентам (обычно О2). Бесцветный N,N-диметил-парафенилендиамин служит искусственным реципиентом электронов. В ходе оксидазного теста из него в результате окислительно-восстановительных реакций с участием микробной оксидазы образуется индофенол – вещество синего цвета. В случае положительной реакции (наличие цитохромоксидазы) из оксалата N,N-диметил-парафенилендиамина и a -нафтола образуется синий индофенол.
Оксидазный тест проводят путем снятия микробной колонии и растирания ее по оксидазному диску. Учет реакции ведут в течение 5–10 секунд при 25–30°С. Замедленные положительные реакции появляются через 10–60 секунд. Отсутствие изменения цвета на диске или развитие окраски через 60 и более секунд расценивают, как отрицательную реакцию.
Ряд ферментов (нейраминидаза, гиалуронидаза, коагулаза и др.) способствуют проявлению патогенных свойств у возбудителей некоторых инфекционных заболеваний, поскольку субстратом их действия являются вещества, входящие в состав клеток и тканей организма человека.
Плазмокоагулаза — выявляется в пробирочном опыте путем определения скорости свертывания испытуемым микробом цитратной кроличьей или человеческой плазмы.


Коагулазний тест «+» Staphylococcus aureus Коагулазний тест «-» Staphylococcus epidermidis
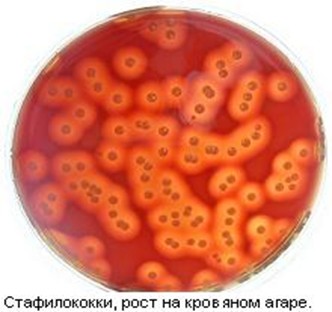
Гемотоксин — вызывает лизис эритроцитов. Определяется при посеве испытуемых микробов на кровяной агар. Вокруг колонии наблюдается зона просветления среды(гемолиза). Различают 3 типа гемолиза:
· Альфа (α )-гемолиз, при котором за счет превращения гемоглобина в метгемоглобин среда вокруг колонии приобретает зеленоватый оттенок; при этом мембрана эритроцитов не нарушается.
· Бета (b)-гемолиз, когда в результате полного лизиса эритроцитов вокруг колоний образуется прозрачная зона.
· Гамма (γ)-гемолиз свидетельствует об отсутствии гемолиза; целость эритроцитов не нарушена, цвет среды не изменен.
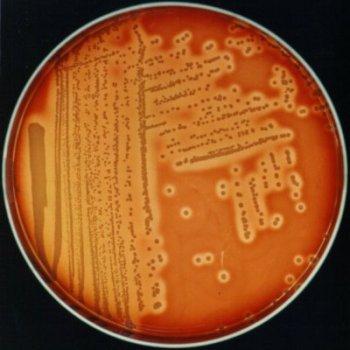

Лецитиназа — разрушает лецитовителлин яичного желтка. Обнаруживается при посеве испытуемых микробов на желточно-солевой агар (ЖСА) по образованию вокруг колоний зоны помутнения с радужным венчиком.
Гиалуронидаза— расщепляет гиалуроновую кислоту, входящую в состав соединительной ткани. В пробирку с испытуемой культурой вносится гиалуроновая кислота и после 30-минутной экспозиции при 37 °С добавляется 2 капли крепкой уксусной кислоты. При наличии фермента гиалуроновая кислота утрачивает способность образовывать сгусток.
Фибринолизин — растворяет фибрин плазмы крови, добавленной к питательной среде.
Дата добавления: 2019-02-22; просмотров: 911; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
