ПОСТОЯННАЯ ЭКС ПРИ БРАДИКАРДИЯХ 2 страница
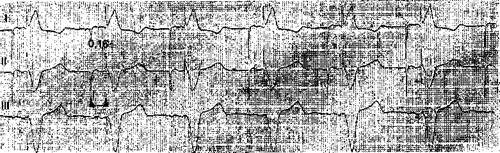
VAT (VATOO) (Р-синхронизиро-ванная стимуляция желудочков) — стимулятор «ощущает» спонтанные возбуждения предсердий через электрод, находящийся в правом предсердии, и через другой электрод в правом желудочке (рис. 40) стимулирует сокращения желудочков с нужным замедлением, имитируя естественную АВ задержку. Аппарат показан больным, сохранившим нормальную функцию СА узла, но имеющим выраженные нарушения АВ проводимости. Благодаря тому, что стимуляция желудочков управляется предсердными сигналами, происходит электрическое шунтирование зоны АВ блокады и сохраняется пред-сердная гемодинамическая «добавка», т. е. вклад предсердий в систолу желудочков (около 20—25% УО сердца). Устройство VAT было одним из первых аппаратов, которые стали относить к группе физиологических кардиостимуляторов [Schel-dach M. et al., 1967; Irnich W., 1975]. Они отвечают двум основным требованиям: а) обеспечивают с необходимой задержкой последовательное (секвенциальное) сокращение предсердий и желудочков; б) обладают способностью повышать частоту ритма сердца в ответ на физическую нагрузку. Правда, при урежении у больного синусового ритма ниже заданного предела стимулятор VAT начинает функционировать в режиме VOO. Во время предсердной тахикардии стимулы к желудочкам посылаются с частотой, не превышающей верхний установленный уровень, так что число воспринимаемых пред-сердных сигналов может быть значительно большим, чем сокращений желудочков (2:1 и т. д.). Стимуляции в режиме VAT присущи и существенные ограничения: не предусмотрена стимуляция предсердий, нет приспособления для выработки желудочковых импульсов «по потребности».
|
|
|
|
|
Рис. 40. Положение электродов в правом предсердии и у верхушки правого желудочка при двухполюс ной системе кардиостимуляции; справа обозначен вживляемый аппарат.
Более совершенным является стимулятор VDD (VDDOO) — Р-син-хронизированная, R-регулируемая стимуляция желудочков. Благодаря добавлению режима demand для желудочков, этот аппарат во время синусовой брадикардии функционирует как стимулятор VVI с утратой последовательного сокращения предсердий и желудочков. При возникновении предсердной тахикардии он посылает к желудочкам в 2 раза меньше регулярных стимулов. Противопоказание к имплантации пейсмекеров типов VAT и VDD — наличие у больного ретроградного проведения от желудочков к предсердиям с длинным интервалом V—А; оно может привести к возникновению искусственной (пейсмекерной) желудочковой тахикардии.
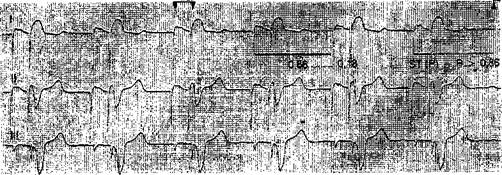
Шагом вперед в развитии физиологической кардиостимуляции было создание аппарата типа DVI (DVIOO) — двухкамерного (бифокального) стимулятора, АВ последовательного (секвенциального), R-pe-гулируемого [Berkovitz В., 1971]. Импульсы от стимулятора поступают к правому предсердию с заданной час-
|
|
|
тотой (с определенным интервалом выскальзывания), и вслед за ними с физиологическим замедлением (в обход АВ блокады) стимулируются желудочки (рис. 41). Если спонтанный желудочковый комплекс появляется до окончания предсердного интервала выскальзывания, то блокируется выработка как предсердного, так и следующего за ним желудочкового стимула; аппарат неспособен воспринимать естественную активность предсердий; в случае синусовой тахикардии это может привести к конкуренции двух ритмов. Последовательная АВ стимуляция показана больным с полной АВ блокадой, с СССУ, осложнившимся застойной недостаточностью кровообращения. Аппарат этого типа не может быть использован у больных с протяженными периодами ФП (ТП).
Пейсмекеры типа DDD (DDDMO^ отражают наибольший прогресс, достигнутый в технологии электрокар-диостимуляции [Funke H., 1981]. Это универсальные полностью автоматизированные АВ стимуляторы с широкими возможностями программирования их функций. Иногда стимуляцию
|
|
Рис. 41. Электрическая стимуляция сердца типа DVI. Двухкамерная предсердно-желудочковая стимуляция с интервалом Р — R = 0,16 с (по Ch. Buchner)
|
|
Рис. 42. Электрическая стимуляция сердца типа DDD, «физиологическая» (по Cli. Buchner).
типа DDD называют «синусовым ритмом в коробке»; время и интервалы такого ритма точно контролируются «внутренними часами». Через пред-сердный и желудочковый электроды обеспечивается последовательная стимуляция предсердий и желудочков с меняющейся АВ задержкой в зависимости от частоты ритмов (оис. 421. В отличие от аппаратов DVI и DDI, ко-тооые могут стимулировать обе полости, но фиксированы на одной частоте ритма, система DDD способна ощущать эндогенную предсердную активность и запускать импульсы к желудочкам в ответ на восприятие предсердных биопотенциалов. В аппаратах типа DDD предусмотрены Р-регулируемый и Р-синхронизиро-ванный, R-регулируемый и R-син-хронизированный режимы стимуляции. При исчезновении или резком замедлении предсердной (синусовой) активности аппарат стимулиру-
ет предсердия с АВ последовательным возбуждением желудочков на нижней заданной границе стимуля-ционного ритма. Верхняя граница частоты предсердного ритма, который может быть «проведен» 1: 1 к желудочкам с фиксированным АВ интервалом, является программируемым параметром, который устанавливает врач.
|
|
|
Пейсмекер ДДД соединяет в себе возможности AAI, VDD и DVI аппаратов. Если, например, у больного во время синусовой брадикардии восстанавливается АВ проведение, то устанавливается режим стимуляции типа AAI. В тех случаях, когда у больного нормализуется частота синусового ритма при резко сокращенном АВ проведении, стимуляция может проходить в режиме VDD. Для сочетания синусовой брадикардии с АВ блокадой показан переход к стимуляции в режиме DVI. При норма-
лизации функции СА узла и АВ проведения стимулятор отключается.
Устройства типа DDD, несомненно, повышают переносимость физических нагрузок даже у лиц с нарушенной сократительной функцией желудочков, уменьшают число эпизодов ФП и увеличивают продолжительность жизни больных [Button R., 1982]. Все же простые стимуляторы типа DDD обеспечивают, как упоминалось, только 4 временных цикла, или интервала: интервал нижней частоты (соответствует наименьшей частоте ЭКС); АВ задержку, т. е. электронный аналог интервала Р—R; предсердный и желудочковый ре-фрактерный периоды, во время которых частотные фильтры не чувствительны к приходящим из сердца сигналам. Между тем многие больные нуждаются по характеру своей деятельности в изменениях в течение суток частоты сердечных сокращений, однако у них нет четких проявлений электрической активности предсердий. Для такой категории людей созданы разновидности аппаратов DDD (DDDRO), которые способны связывать ритм стимуляции с физиологическими показателями, отражающими меняющиеся гемодинамические потребности организма. Один из таких стимуляторов снабжен акцелерометром, чутко улавливающим движения тела больного во время физической нагрузки. В другом устройстве фиксируется укорочение интервала Q—Т, связанное с повышением тонуса симпатической нервной системы, зависящим от нагрузки. В третьем варианте стимулятора DDD регистрируются изменения дыхания с помощью импедансного плетизмографа. Имеются стимуляторы, реагирующие на небольшие колебания температуры венозной крови, возникающие при возрастании физической активности больного, а также на содержание в крови Ог и ОСЬ (сенсорные датчики). Работающие стоматологические аппараты не нарушают функции вживленных стимуляторов (типов VVIMO, ДДДСО и др.).
Уже в 1985 г. в США на долю двухкамерных кардиостимуляторов приходилось более 30% первично-имдлантированных аппаратов [Par-sonnet V. et al., 1988].
ИМПЛАНТИРУЕМЫЕ УСТРОЙСТВА ДЛЯ ЛЕЧЕНИЯ ТАХИАРИТМИЙ
Еще в начале 60—70-х годов была показана принципиальная возможность того, что электрическая стимуляция сердца сама по себе либо в сочетании с лекарственными средствами может с успехом применяться для длительного лечения тахиаритмий [Sowton Е. et al., 1964; Escher D., Furman S., 1970]. В последующем развитие методов противотахикарди-ческой стимуляции шло в нескольких направлениях. Одно из них предусматривает использование стимуляторов типов VVIPP, DDDCP, обладающих соответствующими возможностями [Levy S., 1984; Hombach V., 1984; Ohe Т., 1985].
Другое направление связано с применением специальных импланти-руемых противотахикардических устройств, осуществляющих сканирующую или залповую стимуляцию предсердий либо желудочков. Сканирующие аппараты посылают к сердцу 1—2 или больше экстрастимулов низкой энергии, которые прерывают над-желудочковые или желудочковые ре-ципрокные (re-entry) тахикардии, когда попадают в «окно» тахикарди-ческого цикла. Устройства снабжены «памятью», что позволяет им в случае рецидива той же тахикардии сразу же нанести экстрастимул в нужный отрезок диастолы [Bertholet M. et al., 1985].
К числу аппаратов этой категории относятся, например, автоматический сканирующий пейсмекер для лечения наджелудочковых тахикардии [Spu-rell R. et al., 1984] и более универсальный противотахикардический пейсмекер, тоже используемый при наджелудочковых реципрокных тахи-кардиях [den Bulk К. et al., 1986]. По данным Н. Wellens и соавт. (1978),
сканирующая стимуляция становится неэффективной при частоте тахи-кардического ритма свыше 160 в
1 мин. Большего можно ожидать от залповой стимуляции. Ряду исследователей удавалось при таком лечении (без добавления противоаритмиче-ских средств или в сочетании с ними) быстро подавлять приступы надже-лудочковых тахикардии у 80% больных в течение длительного периода времени [Sowton E., 1980]. Другие клиницисты получили менее надежные результаты [Peters R. et al., 1985]. Трудности заключаются в провоци-ровании у части больных постоянной ФП. Естественно, что стимуляторы этого типа не следует устанавливать больным, у которых добавочные предсердно-желудочковые соединения обладают способностью проводить частые импульсы к желудочкам.
Риск возникновения ФЖ или ускорения тахикардии резко возрастает при сканировании желудочков одним или несколькими экстрастимулами и особенно, когда проводят залповую стимуляцию желудочков. Такая же опасность существует и при использовании имплантируемых кар-диовертеров, выделяющих R-синхро-низированные стимулы с энергией до
2 Дж [Zipes D. et al., 1984]. Как показали результаты одного из кооперативных исследований, с помощью аналогичного метода ЖТ устойчивого характера удавалось прерывать в 85% случаев, однако в 10% случаев произошло ускорение тахикардии, в 5% возникла ФЖ [Seger J., Griffin J., 1985; Fisher J. et al., 1985].
Весьма перспективная, вызывающая большой интерес группа проти-вотахикардических устройств представлена аппаратами, которые способны прерывать залповым током более высокой энергии ФЖ. а импульсами низкой энергии — ЖТ. Мы имеем в виду автоматические вживляемые кардиовертеры-дефибрилляторы типов AICD [Пекарский В. В. и др., 1986; Mirowski M. et al., 1980, 1981; Zipes D. et al., 1984; Jones D. et
al., 1986; Vlay S., 1986.; Furman 5., 1990].
В одной из моделей [Mirowski M. et al., 1985] два дефибриллирующих электрода (анод в верхней полой вене у места соединения ее с правым предсердием, катод в виде фиксированной прямоугольной пластинки над верхушкой сердца) используются и как датчики для анализа формы электрических волн сердца. Третий катетерный биполярный электрод помещают в верхушку правого желудочка; он осуществляет R-синхрони-зированную стимуляцию желудочков и кардиоверсию. Специальные литиевые батареи обеспечивают 100 разрядов с энергией до 30 Дж, что позволяет охранять жизнь больного в течение 3 лет. Созданы аппараты, рассчитанные на 250 разрядов, а также способные стимулировать сердце при возникновении последефибрил-ляционной брадикардии или асистолии. К началу 1990 г. в мире было осуществлено около 4500 имплантаций различных устройств этого типа больным с ИБС, кардиомиопатиями, синдромом длинного интервала Q—Т и первичной электрической болезнью сердца. Многие из них прежде переносили приступы ФЖ и не реагировали в среднем на 4 противоаритми-ческих препарата; не принесли им облегчения и хирургические операции на сердце. Период наблюдения за функцией имплантированных аппаратов колебался от 12 до 64 мес. Они улавливали желудочковые тахиарит-мии у 99% больных. Среднее время от начала тахиаритмии до ее подавления равнялось 17 с. Смерть от аритмии за 1 год произошла у 1,8— 2% больных, что значительно ниже показателя в группе таких же больных, лечившихся фармакологическими средствами [Echt D. et al., 1985; Mirowski M. et al., 1985]. Согласно последним данным, общая выживаемость больных в течение 5 лет после имплантации аппаратов (в том числе программируемых) составляет 60 % [Furman S., 1990]. По мнению некоторых исследователей, чувствителъ-
ность этих аппаратов достигает 100%, а специфичность—87% [Jordaens L. et al., 1986]. Ценность такого метода лечения угрожающих жизни больных желудочковых тахиаритмий очевидна, хотя противотахикардическая стимуляция и автоматическая дефи-брилляция несколько ограничены возможностью распознавания типа тахиаритмий, а также другими причинами. Заслуживают внимания попытки создать автоматический наружный дефибриллятор, способный анализировать электрокардиографические сигналы с поверхности тела больного и направлять к фибрилли-рующему сердцу разряды в 200— 335 Дж. Это — важный шаг вперед в борьбе с ФЖ и в предотвращении внезапной смерти больных с тяжелыми заболеваниями сердца [Cummins R. et al., 1986].
Электроды для постоянной ЭКС. Наряду со сложными электронными устройствами и источниками питания большой емкости (литиевые батареи различных типов), для современных водителей ритмов требуются электроды (провода-электроды, электроды-катетеры) с соответствующими электрохимическими и электрическими свойствами и таким важным, иногда решающим качеством, как возможность их надежно фиксировать в миокарде, в частности в стенке правого предсердия. Не без основания некоторые исследователи утверждают, что именно электроды в наше время определяют продолжительность функционирования эндо-кардиальной системы стимуляции — «ахиллесова пята» [Григоров С. С. и др., 1973; Думчюс А. С., Бреди-кис Ю. Ю., 1974; Бредикис Ю. Ю. и др., 1975—1983; Стирбис П. П., 1986; Макеев В. В., 1983; Стирбис П. П. и др., 1990; Angello D. et al., 1984; Litt-leford Ph. et al., 1984; Timmis G. et al., 1984]. Все более широко используются двухполюсные электроды, которые постоянно улучшаются.
Ю. Ю. Бредикис и П. П. Стирбис (1986) классифицировали основные медико-технические свойства элект-
родов и, по аналогии с кардиостиму-ляторами, представили их в кодовом буквенном выражении. Предлагаемое ими международное номенклатурное кодирование имплантируемых электродов включает 7 позиций. Буква в первой позиции отражает способ контактирования электрода со стенкой сердца (эндокардиальный, миокарди-альный, эпикардиалъный, эпимиокар-диальный); буква во второй позиции — локализацию электрода (предсердие и (или) желудочек, коронар-титан и т. д.); в пятой позиции — фиксирующие элементы электродов (ввинчиваемый, серповидный, яко-реобразный, геликоидный и др.); в четвертой позиции — материал контактной головки (углерод, стекло-углерод, платина, платина-иридий, титан и т.д.); в пятой позиции — форму контактной головки (цилиндрическая, кольцеобразная, сферическая, пористая, многогранная и др.); в шестой позиции — изогнутость внут-рисердечной части (J — крючкооб-разная, без изогнутости); в седьмой позиции — полярность электрода (монополярный, биполярный, многополярный) . Несомненно, что этот код электродов будет способствовать унификации их обозначения.
Представляют интерес обобщенные данные Ю. Ю. Бредикиса и П. П. Стирбиса о выборе вен для имплантации электродов в сердце. Электроды ими вводились через v. cephalica в 43 %, через v. jugularis ext. — почти в 45 % и через v. subclavia — только в 4% случаев. При желудочковой стимуляции 88% электродов вводили через левосторонние вены; предсерд-ные электроды чаще вводили через правосторонние вены.
ОСЛОЖНЕНИЯ КАРДИОСТИМУЛЯЦИИ
«Синдром кардиостимулятора» (мейсмекерный синдром). Этим термином, предложенным Т. Mitsui и со-авт. (1969), объединяют комплекс клинических расстройств, зависящий от неблагоприятных гемодинамичес-ких л (или) электрофизиологических
последствии постоянной стимуляции желудочков (но не от других причин). Основные признаки (симптомы) пейсмекерного синдрома можно сгруппировать следующим образом:
активации предсердий состоит: в утрате предсердной систолы в нужное время; в появлении пушечных волн в левом предсердии, приводящих к повышению среднего легочно-веноз-
Гипотензия: шок ортостатическис реакции
Неврологические расстройства (низкий МО сердца):
обмороки головные боли
головокружения ухудшение зрения
спутанность сознания ослабление слуха
летаргия общая слабость
ночное беспокойство изменения психики
| растяжение шейных вен отеки нарушения ритма сердца пульсация в области шеи и живота резкие колебания АД |
Застойная недостаточность кровообращения: сердцебиение одышка (тахипноэ) ортопноэ (застой в легких) кашель застойная печень
По наблюдениям Ю. Ю. Бредики-са и соавт. (1988), наиболее характерное проявление синдрома кардио-стимулятора — быстро возникающее у больного ощущение усталости при умеренной физической нагрузке; больной прилагает усилия, чтобы заставить себя выполнять привычную для него работу.
Согласно данным К. Ausubel и соавт. (1985), развитие пейсмекерного синдрома связано с рядом механизмов: потерей связи между сокращениями предсердий и желудочков; асинхронизмом систолы желудочков; недостаточностью створчатых клапанов (шумы регургитации крови); парадоксальными циркуляторными рефлексами (уменьшение ОПС при низком МО сердца); ретроградным предсердно-желудочковым (ВА) проведением; эхо-комплексами; аритмиями.
Заслуживает более подробного рассмотрения значение ретроградного ВА проведения в развитии пейсмекерного синдрома. Оно встречается более чем у 60 % больных с дисфункциями С А узла. Кроме того, до 40% больных с полной антероградной АВ блокадой (различного уровня) сохраняют при определенных условиях ретроградное В А проведение 1:1. Отрицательное влияние ретроградной
ного давления; в «захватах» правого предсердия желудочковыми импульсами с предотвращением спонтанных разрядов СА узла. Конечным результатом этих воздействий в условиях постоянной стимуляции желудочков бывают крайне низкий МО, перепады АД и венозный застой в легких, что и составляет сущность пейсмекерного синдрома.
Истинную частоту развития этого синдрома определить трудно; вероятно, она приближается к 7 %; чаще он встречается у пожилых больных. Для профилактики такого осложнения ЭКС необходима проверка гемодина-мики в период временной стимуляции. Лечение пейсмекерного синдрома сводится к репрограммированию кардиостимулятора, восстановлению АВ синхронизма и предотвращению ВА проведения [Бредикис Ю. Ю. и др., 1988].
Дата добавления: 2019-02-22; просмотров: 170; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!