Завдання № 20-28 мають на меті встановлення відповідності. До кожного рядка, позначеного цифрою, необхідно добрати відповідь, позначену буквою.
20 Встановіть відповідність між позначенням квантового і числа і його назвою:
| Квантове число | Назва квантового числа |
| 1 n; | А спінове квантове; |
| 2 m; | Б орбітальне квантове число; |
| 3 l; | В головне квантове число; |
| 4 s. | Г магнітне квантове число. |
21 Встановіть відповідність між йоном (атомом у певному ступені окиснення) та його електронною формулою:
| Йон (атом у певному ступені окиснення) | Електронна формула |
| 1 Na+; | А 4s03d5; |
| 2 As-3; | Б 4s05d10; |
| 3 Cd2+; | В 4s24p5; |
| 4 Fe3+. | Г 3s0. |
22 Встановіть відповідність між заданим елементом та його елементом-аналогом:
| Символ заданого елемента | Символ елемента-аналога |
| 1 Mn; | A I; |
| 2 Br; | Б Sn; |
| 3 Ti; | В Tc; |
| 4 Ge. | Г Zr. |
23 Встановіть відповідність між валентними електронами елемента в атомі та його положенням у періодичній системі:
| Електронна формула | Розташування елемента в періодичній системі |
| 1 4s23d5; | А IV період, VIIВ-група; |
| 2 3s23p5; | Б IІІ період, VIIA-група; |
| 3 5s14d10; | В V період, IВ-група; |
| 4 5s1. | Г V період, IA-група. |
24 Встановіть відповідність між елементом і загальною формулою його гідроксиду:
| Символ елемента | Загальна формула гідроксиду |
| 1 P; | A E(OH)3; |
| 2 Al; | Б H2EO3; |
| 3 Si; | В E(OH)2; |
| 4 Zn. | Г H3EO4. |
25 Встановіть відповідність між типами кристалічних ґраток і властивостями речовин:
| Тип кристалічної ґратки | Властивості речовин |
| 1 металічна; | А не розчиняються в жодних розчинниках; |
| 2 молекулярна; | Б пластичні; |
| 3 йонна; | В мають досить високі температури плавлення; |
| 4 атомна. | Г леткі. |
26 Встановіть відповідність між формулою та властивостями речовини:
|
|
|
| Формула речовини | Властивості речовини |
| 1 KCl; | А газоподібна речовина, добре розчинна у воді під тиском; |
| 2 CO2; | Б безбарвна кристалічна речовина, нерозчинна у воді; |
| 3 SiO2; | В безбарвна кристалічна речовина, добре розчинна у воді; |
| 4 C (графіт). | Г кристалічна речовина, жирна на дотик, із металічним блиском, нерозчинна у воді. |
27 Встановіть відповідність між молекулою і типом гібридизації орбіталей центрального атому:
| Формула молекули | Тип гібридизації орбіталей центрального атома |
| 1 CO2; | A sp2; |
| 2 CCl4; | Б sp; |
| 3 BCl3; | В sp3; |
| 4 O2. | Г гібридизації не відбувається. |
28 Встановіть відповідність між просторовою будовою частинки і типом гібридизації орбіталей центрального атому:
| Просторова будова | Тип гібридизації орбіталей центрального атома |
| 1 трикутник; | А sp3d; |
| 2 лінія; | Б sp2; |
| 3 тетраедр; | В sp; |
| 4 октаедр. | Г sp3. |
Завдання № 29-40 мають на меті розташування відповідей у певному порядку відповідно до запропонованого завдання.
|
|
|
29 Розташуйте символи елементів у порядку зростання кількості неспарених електронів у незбуджених атомах елементів:
А  ; Б
; Б  ; В
; В  ; Г
; Г  .
.
30 Розташуйте підрівні у порядку зростання суми головного і орбітального квантових чисел:
А  ; Б
; Б  ; В
; В  ; Г
; Г  .
.
31 Розташуйте запропоновані електронні структури відповідно до схеми перетворення:
 :
:
А  ; Б
; Б  ;
;
В  ; Г
; Г 
32 Розташуйте запропоновані електронні структури відповідно до схеми перетворення:  :
:
А  ; Б
; Б  ;
;
В  ; Г
; Г  .
.
33 Розташуйте елементи у порядку зростання електронегативності:
А  ; Б
; Б  ; В
; В  ; Г
; Г  .
.
34 Розташуйте елементи VA-групи у порядку послаблення неметалічних властивостей:
А  ; Б
; Б  ; В
; В  ; Г
; Г  .
.
35 Розташуйте елементи у порядку зростання атомних радіусів:
А  ; Б
; Б  ; В
; В  ; Г
; Г  .
.
36 Розташуйте елементи у порядку збільшення енергії йонізації:
А  ; Б
; Б  В
В  ; Г
; Г  .
.
37 Розташуйте елементи II A-групи у порядку посилення металічних властивостей:
А  ; Б
; Б  ; В
; В  ; Г
; Г  .
.
38 Розташуйтеформули речовин в порядку зменшення довжини хімічного зв’язку:
|
|
|
А  ; Б
; Б  ; В
; В  ; Г
; Г  .
.
39 Розташуйтеформули речовин в порядку зростання полярності хімічного зв’язку:
А  ; Б
; Б 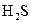 ; В
; В  ; Г
; Г  .
.
40 Розташуйте речовини в порядку зростання кількості  - зв’язків в молекулі:
- зв’язків в молекулі:
А карбон(ІV) оксид; Б пропен;
В кисень; Г пропан.
Комплексні сполуки
Значення розділу. Комплексні сполуки становлять найбільш поширену і неоднорідну групу речовин. Певні представники цього класу речовин мають значне біологічне значення, інші широко застосовуються в аналітичній хімії. Серед причин, які визначають цінність знань про склад, будову і властивості комплексних сполук для матеріалознавця, зазначимо такі: по-перше, розгляд комплексів дає можливість поглибити знання про просторову будову молекул та залежність властивостей речовин від їх будови, по-друге, комплексні сполуки використовуються для отримання нових матеріалів (карбоніл заліза – для отримання заліза високого степеня чистоти, фероцен – як каталізатор у реакціях полімеризації тощо).
Цілі вивчення розділу:
- формування знань про склад, будову, властивості комплексних сполук у світлі координаційної теорії;
|
|
|
- розгляд класифікації, номенклатури, ізомерії комплексних сполук;
- поглиблення знань про хімічний зв’язок речовин на прикладі розгляду координаційного зв’язку між комплексоутворювачем та лігандами і просторової будови комплексних йонів;
- формування вмінь складати рівняння реакцій первинної та вторинної дисоціації комплексних сполук, обмінних реакцій за їх участю, записувати вираз константи нестікості комплексного йону, а також рівняння реакцій утворення та руйнування комплексів;
- ознайомлення з елементами теорії кристалічного поля.
Результати вивчення розділу
Необхідно знати:
1 Основні поняття (комплексна сполука, комплексний йон, комплексоутворювач, ліганди, координаційне число, внутрішня сфера, зовнішня сфера) і положення координаційної теорії.
2 Види ізомеріїї (іонізаційну, гідратну, геометричну), класифікації комплексних сполук (за зарядом внутрішньої сфери і за природою лігандів) та їх номенклатуру.
3 Природу (тип і механізм утворення) хімічного зв’язку: між комплексним йоном та йонами зовнішньої сфери, між комплексоутворювачем та лігандами.
4 Хімічні властивості (первинну і вторинну дисоціацію, обмінні реакції) комплексних сполук.
5 Фізичний зміст константи нестійкості комплексного йону.
6 Сутність теорії кристалічного поля.
Необхідно вміти:
1 Розрізняти і використовувати основні поняття координаційної теорії комплексних сполук, визначати ступінь окиснення і координаційне число комплексоутворювача, заряди комплексного йона і протийона.
2 Складати формули комплексних сполук за назвами та їх назв за формулами.
3 Класифікувати комплексні сполуки.
4 Розрізняти види ізомерії комплексних сполук (геометричну, гідратну та іонізаційну).
5 Складати рівняння первинної та вторинної дисоціації, обмінних реакцій за участю комплексних сполук, записувати вираз константи нестійкості та аналізувати його, порівнювати міцність комплексних йонів за відомим значенням константи нестійкості.
6 Пояснювати природу хімічного зв’язку у комплексних сполуках у межах методу валентних зв’язків та теорії кристалічного поля.
7 Прогнозувати і пояснювати просторову будову і магнітні властивості комплексного йона.
Дата добавления: 2019-02-13; просмотров: 171; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
