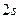Література для підготовки теоретичного матеріалу
Опрацювати розділи 2, 3, 4 підручника [6] та 1.2, 1.3, 1.4 посібника [3].
План вивчення теми
1 Перші моделі будови атома (моделі Томпсона, Резерфорда, Бора).
2 Квантово-механічна модель атома Гідрогену.
3 Закономірності послідовності розміщення електронів в атомі (принцип мінімуму енергії, правила Клечковського, принцип заборони Паулі, правило Гунда).
4 Електронні формули та електронно-графічні схеми атомів хімічних елементів.
5 Приклади виконання типових завдань.
6 Завдання для самоперевірки.
Приклади виконання типових завдань
Приклад 1Складіть електронну формулу і електронно-графічну схему двох зовнішніх енергетичних рівнів атома хімічного елемента з порядковим номером 28. Визначте: а) до якої електронної родини належить цей хімічний елемент; б) чи є він металом або неметалом.
Розв’язання. Оскільки елемент має порядковий номер 28, то кількість протонів в ядрі його атома дорівнює 28, отже, число електронів навколо ядра теж становить 28. Враховуючи правила послідовності заповнення електронами енергетичних підрівнів, складаємо електронну формулу атома хімічного елемента: 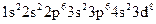 . Складаємо електронно-графічну схему двох зовнішніх енергетичних рівнів атома хімічного елемента – третього та четвертого:
. Складаємо електронно-графічну схему двох зовнішніх енергетичних рівнів атома хімічного елемента – третього та четвертого:
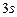
| 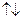
| 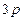
| 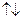
| 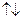
| 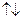
| 
| 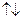
| 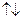
| 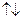
| 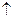
| 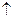
| 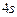
| 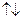
| . |
а) Оскільки формуючий електрон заповнює 3d-підрівень, то елемент належить до d-електронної родини;
|
|
|
б) оскільки на зовнішньому – четвертому енергетичному рівні містяться два електрони, цей елемент є металом.
Приклад 2Складіть електронну формулу і електронно-графічну схему двох зовнішніх енергетичних рівнів для таких частинок: а) атома  ; б) йона
; б) йона  ; в) йона
; в) йона 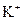 ; г) йона
; г) йона  . Які з наведених частинок є ізоелектронними? Відповідь поясніть.
. Які з наведених частинок є ізоелектронними? Відповідь поясніть.
Розв’язання: а) порядковий номер хімічного елемента Аргону дорівнює 18, отже, електронна оболонка атома  містить 18 електронів і має таку електронну формулу:
містить 18 електронів і має таку електронну формулу:  і таку електронно-графічну схему двох зовнішніх енергетичних рівнів:
і таку електронно-графічну схему двох зовнішніх енергетичних рівнів:
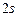
| 
| 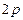
| 
| 
| 
| 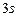
| 
| 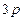
| 
| 
| 
| ; |
б) йон 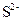 має на два електрони більше, ніж атом Сульфуру, який містить 16 електронів (порядковий номер хімічного елемента Сульфуру 16), отже, число електронів в електронній оболонці йона
має на два електрони більше, ніж атом Сульфуру, який містить 16 електронів (порядковий номер хімічного елемента Сульфуру 16), отже, число електронів в електронній оболонці йона 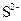 дорівнює 18. Тому електронна конфігурація йона
дорівнює 18. Тому електронна конфігурація йона 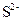 описується такою електронною формулою:
описується такою електронною формулою: 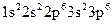 і такою електронно-графічною схемою двох зовнішніх енергетичних рівнів:
і такою електронно-графічною схемою двох зовнішніх енергетичних рівнів:
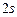
| 
| 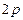
| 
| 
| 
| 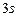
| 
| 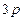
| 
| 
| 
|
і є частинкою, ізоелектронною атому 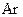 ;
;
в) йон 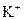 має на один електрон менше, ніж атом Калію, який містить 19 електронів (порядковий номер хімічного елемента 19), тому число електронів в електронній оболонці йона
має на один електрон менше, ніж атом Калію, який містить 19 електронів (порядковий номер хімічного елемента 19), тому число електронів в електронній оболонці йона 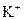 дорівнює 18. Отже, йон
дорівнює 18. Отже, йон 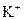 має таку електронну формулу:
має таку електронну формулу: 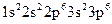 і таку електронно-графічну схему двох зовнішніх енергетичних рівнів:
і таку електронно-графічну схему двох зовнішніх енергетичних рівнів:
|
|
|
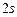
| 
| 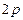
| 
| 
| 
| 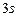
| 
| 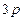
| 
| 
| 
|
і є частинкою, ізоелектронною атому 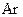 ;
;
г) йон 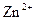 має на два електрони менше, ніж атом Цинку, який містить 30 електронів (порядковий номер хімічного елемента Цинку 30), тому число електронів в йоні
має на два електрони менше, ніж атом Цинку, який містить 30 електронів (порядковий номер хімічного елемента Цинку 30), тому число електронів в йоні 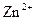 дорівнює 28. Таким чином, йон
дорівнює 28. Таким чином, йон 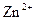 має таку електронну формулу:
має таку електронну формулу: 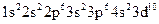 і таку електронно-графічну схему двох зовнішніх енергетичних рівнів:
і таку електронно-графічну схему двох зовнішніх енергетичних рівнів:
| 
| 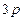
| 
| 
| 
| 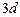
| 
| 
| 
| 
| 
|
і не є частинкою, ізоелектронною атому 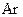 .
.
Приклад 3За допомогою чотирьох квантових чисел опишіть стан електрона в атомі:
| а) | 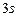
| 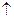
| ; |
| б) | 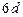
| 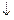
| . |
Розв’язання: а) електрон розміщений на третьому енергетичному рівні, отже, n=3; на s-підрівні, отже, l=0та m=0,значення спінового квантового числа s=+1/2;
б) електрон розміщений на шостому енергетичному рівні, отже, n=6; на d-підрівні, отже, l=2; m=0;значення спінового квантового числа 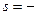 1/2.
1/2.
Приклад 4 Формуючий електрон атома деякого елемента характеризується набором таких квантових чисел: 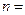 3,
3, 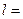 2,
2, 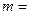 -1,
-1, 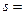 +1/2. Складіть електронну формулу цього атома.
+1/2. Складіть електронну формулу цього атома.
|
|
|
Розв’язання. Електрон знаходиться на 3d-підрівні, оскільки головне (n) і орбітальне (l) квантові числа дорівнюють відповідно 3 і 2. Значення магнітного квантового числа вказує на те, що він перебуває на другій з п’яти d-орбіталей, а спінове квантове число – на те, що цей електрон є неспареним. З урахуванням енергетичної шкали складаємо електронну формулу атома заданого елемента:  .
.
Приклад 5За наведеною електронною формулою хімічного елемента: 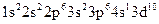 визначте його розміщення у періодичній системі Д. І. Менделєєва, не користуючись таблицею ПС. Складіть у загальному вигляді електронну конфігурацію зазначеного хімічного елемента та його електронних аналогів.
визначте його розміщення у періодичній системі Д. І. Менделєєва, не користуючись таблицею ПС. Складіть у загальному вигляді електронну конфігурацію зазначеного хімічного елемента та його електронних аналогів.
Розв’язання. Оскільки зовнішній енергетичний рівень у атома хімічного елемента четвертий, то елемент знаходиться у IV періоді ПС. Формуючий електрон заповнює 3d-підрівень, отже, елемент входить до складу побічної підгрупи. Оскільки передзовнішній 3d-підрівень повністю забудований (містить десять електронів), а на зовнішньому 4s-підрівні знаходиться лише один електрон, тому елемент належить до першої групи періодичної системи.
У загальному вигляді електронна конфігурація зазначеного хімічного елемента та його електронних аналогів може бути подана так: 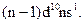
|
|
|
Приклад 6Визначте хімічні елементи, позначені символами Х: 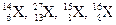 . Скільки всього хімічних елементів наведено в цьому рядку? Відповідь поясніть.
. Скільки всього хімічних елементів наведено в цьому рядку? Відповідь поясніть.
Розв’язання. Враховуючи, що протонне число дорівнює порядковому номеру хімічного елемента і користуючись таблицею ПС, визначаємо, що 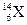 – ізотоп хімічного елемента
– ізотоп хімічного елемента 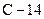 ,
,  - хімічного елемента
- хімічного елемента 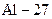 , а
, а  та
та 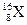 – ізотопи хімічного елемента
– ізотопи хімічного елемента 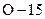 та
та 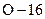 відповідно. Отже, всього наведено три хімічних елементи.
відповідно. Отже, всього наведено три хімічних елементи.
Приклад 7 Складіть формули і визначте хімічний характер вищих оксидів та відповідних гідроксидів для таких елементів: а) 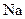 ;б)
;б) 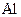 ;в)
;в) 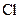 .
.
Розв’язання: а) електронна конфігурація зовнішнього енергетичного рівня атома Na описується формулою 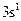 , тому цей елемент виявляє у сполуках лише валентність 1 і утворює вищий оксид складу – Na2O і відповідний гідроксид - NaOH;
, тому цей елемент виявляє у сполуках лише валентність 1 і утворює вищий оксид складу – Na2O і відповідний гідроксид - NaOH;
б) оскільки електронна конфігурація зовнішнього енергетичного рівня атома Al у збудженому стані 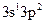 , то цей елемент у сполуках виявляє вищу валентність ІІІ, отже, формула вищого оксиду – Al2O3, а відповідного гідроксиду – Al(OH)3;
, то цей елемент у сполуках виявляє вищу валентність ІІІ, отже, формула вищого оксиду – Al2O3, а відповідного гідроксиду – Al(OH)3;
в) оскільки електронна конфігурація зовнішнього енергетичного рівня атома Cl у збудженому стані 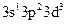
 , то цей елемент у сполуках виявляє вищу валентність VII, отже, формула вищого оксиду – Cl2O7, а відповідний гідроксид є оксигеновмісною кислотою і має формулу – HClO4.
, то цей елемент у сполуках виявляє вищу валентність VII, отже, формула вищого оксиду – Cl2O7, а відповідний гідроксид є оксигеновмісною кислотою і має формулу – HClO4.
Na2O– основний оксид, а NaOH – основа; Al2O3 – амфотерний оксид, а Al(OH)3 – амфотерний гідроксид; Cl2O7 – кислотний оксид, а HClO4 – кислота.
Приклад 8У якого елемента а) Хлору чи Йоду – сильніше виражені неметалічні властивості; б) Калію чи Купруму – сильніше виражені металічні властивості? Відповідь поясніть.
Розв’язання: а) елементи Хлор та Йод розміщені у VIIА-групі, отже, є електронними аналогами, проте Хлор знаходиться у ІІІ періоді та має три енергетичних рівня, а Йод – у V періоді, електронна оболонка атома Йоду складається з п’яти енергетичних рівнів. З цієї причини атомний радіус Хлору менший, ніж атомний радіус Йоду, тому спорідненість до електрона у Хлору більша, ніж у Йоду. Таким чином, неметалічні властивості у Хлору виражені сильніше, ніж у Йоду;
б) елементи Калій та Купрум розміщені в ІV періоді та I групі, але Калій – у головній, а Купрум – у побічній підгрупі. Обидва елементи мають по одному електрону на зовнішньому енергетичному рівні, проте атом Купруму містить на десять електронів більше, ніж атом Калію. Причому ці електрони знаходяться на передзовнішньому d-підрівні, тобто значно ближче до ядра, тому вони сильніше притягується до нього, що спричиняє помітне зменшення атомного радіуса. Отже, атомний радіус Калію більший, ніж атомний радіус Купруму, тому значення енергії йонізації у Калію менше, ніж у Купруму. Таким чином, металічні властивості у Калію виражені більше, ніж у Купруму.
Приклад 9Яку ковалентність можуть виявляти елементи C, O, S, Ti? Складіть електронно-графічні схеми розміщення валентних електронів в атомах цих елементів у збудженому стані.
Розв’язання. Ковалентність можна визначити за числом неспарених електронів в атомі, що перебуває в основному чи збудженому стані. В основному стані зазначені атоми мають такі електронні конфігурації:
| C | … |
|
|
|
|
|
| ; | |||||||||
|
| |||||||||||||||||
| O | … |
|
|
|
|
|
| ; | |||||||||
| S | … | 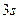
| 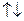
| 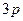
| 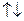
| 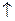
| 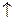
| ; |
| Ti | … | 
| 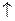
| 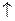
| 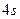
| 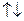
| . |
В основному стані атоми C, O, S, Ti містять по два неспарених електрони і виявляють ковалентність 2. Атоми C, S, Ti здатні підвищити свою ковалентність при переході у збуджений стан, а у атома О така можливість відсутня, оскільки він не має вакантних валентних орбіталей. Наводимо електронно-графічні схеми розміщення валентних електронів атомів C, S, Ti у збудженому стані:
| C٭ | … | 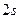
| 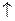
| 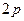
| 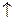
| 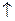
| 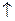
| ; |
| S٭ | 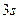
| 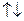
| 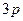
| 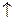
| 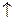
| 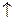
| 
| 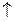
| ; |
| S٭ | 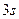
| 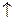
| 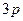
| 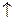
| 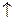
| 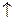
| 
| 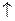
| 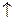
| ; |
| Ti٭ | 
| 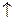
| 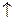
| 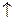
| 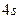
| 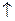
| . |
З електронно-графічних схем видно, що у збудженому стані атом С має чотири неспарених електрони, тому виявляє ковалентність 4; атом S може мати чотири або шість неспарених електронів, тому виявляє ковалентність 4 чи 6 відповідно. Атом Ti має чотири неспарених електрони, тому виявляє ковалентність 4.
Приклад 10Яку геометричну форму мають: а) молекула 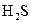 ; б) йон?
; б) йон?
Розв’язання. Під час аналізу геометричної будови молекул та йонів доцільно дотримуватися такого
алгоритму:
1 Складаємо графічну формулу сполуки, встановлюємо в ній кількість σ- та p- зв’язків.
2 Складаємо електронно-графічну схему для центрального атома, враховуючи його валентність у сполуці.
3 За видом та кількістю АО, що містять валентні електрони, визначаємо тип гібридизації центрального атома. Якщо в молекулі є p -зв’язки, то з передбаченої кількості гібридних орбіталей вилучаємо стільки зовнішніх АО, скільки p -зв’язків міститься у молекулі.
4 Визначаємо число незв’язувальних електронних пар.
5 Встановлюємо геометричну форму молекули, враховуючи тип гібридизації центрального атома та число незв’язувальних електронних пар.
а) з графічної формули молекули 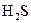 (
( 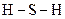 ) випливає, що в
) випливає, що в 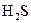 атом Сульфуру утворює два σ-зв’язки і не утворює p–зв’язків. Складаємо електронно-графічну схему Сульфуру, враховуючи, що в сполуці він виявляє ковалентність 2 (має два неспарених р-електрони, орбіталі яких розміщуються взаємно перпендикулярно ):
атом Сульфуру утворює два σ-зв’язки і не утворює p–зв’язків. Складаємо електронно-графічну схему Сульфуру, враховуючи, що в сполуці він виявляє ковалентність 2 (має два неспарених р-електрони, орбіталі яких розміщуються взаємно перпендикулярно ):
| S | 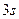
| 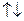
| 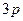
| 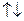
| 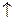
| 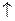
| . |
Для досягнення рівноцінності двох зв’язків 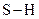 центральний атом
центральний атом 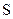 піддається sp3-гібридизації, яка теоретично повинна забезпечити тетраедричну форму молекули і валентний кут
піддається sp3-гібридизації, яка теоретично повинна забезпечити тетраедричну форму молекули і валентний кут 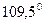 .
.
Неспарені електрони, що перебувають на двох sp3- гібридизованих орбіталях, і утворюють два 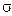 -зв’язки при перекриванні з
-зв’язки при перекриванні з 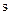 -орбіталями двох атомів
-орбіталями двох атомів 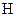 . На двох інших sp3- гібридизованих орбіталях атома
. На двох інших sp3- гібридизованих орбіталях атома 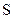 містяться дві незв’язувальні пари, підвищена електронна густина яких сприяє стисненню валентного кута і відхиленню його від
містяться дві незв’язувальні пари, підвищена електронна густина яких сприяє стисненню валентного кута і відхиленню його від 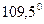 . Отже, молекула
. Отже, молекула 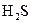 має кутову форму.
має кутову форму.
б) Графічна формула йона  має такий вигляд: має такий вигляд:
| 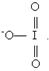
|
Формула показує, що в 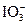 атом Йоду утворює три σ-зв’язки та два p-зв’язки. Складаємо електронно-графічну схему Йоду, враховуючи, що в йоні він виявляє ковалентність 5 (має п’ять неспарених електронів):
атом Йоду утворює три σ-зв’язки та два p-зв’язки. Складаємо електронно-графічну схему Йоду, враховуючи, що в йоні він виявляє ковалентність 5 (має п’ять неспарених електронів):
| I٭ | 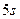
| 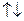
| 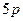
| 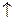
| 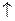
| 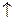
| 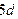
| 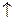
| 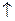
| . |
Оскільки σ-зв’язки утворюються трьома р-орбіталями атома Йоду (d-орбіталі беруть участь в утворенні π-зв’язків, атом Йоду піддається sp3-гібридизації і містить одну незв’язувальну електронну пару (на 5s-орбіталі, тому йон має форму тригональної піраміди.
Приклад 11Як можна пояснити, що за кімнатної температури вода є рідиною, а сірководень – газом?
Розв’язання. Оксиген має більшу електронегативність, ніж Сульфур, тому водневі зв’язки, що виникають між молекулами води, є більш міцними порівняно з водневими зв’язками, що виникають між молекулами сірководню. Розрив водневих зв’язків між молекулами води, необхідний для переходу води в газоподібний стан, потребує значних витрат енергії. Тому вода має більш високу температуру кипіння, ніж сірководень, і за кімнатної температури залишається рідиною.
Приклад 12За методом МО складіть електронні схеми молекули 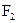 та йона
та йона 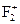 . Порівняйте їх за магнітними властивостями, кратністю та енергією зв’язків.
. Порівняйте їх за магнітними властивостями, кратністю та енергією зв’язків.
Розв’язання. Послідовність заповнення електронами молекулярних орбіталей для двоатомних молекул першого і початку другого періодів (до 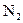 ) відображає така енергетична шкала:
) відображає така енергетична шкала:
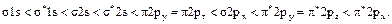
Молекулярні орбіталі двоатомних молекул кінця другого періоду із зростанням енергії розміщуються в дещо інший ряд:

Складаємо схему молекулярних орбіталей частинок F2 та F2+, в якій для зручності не показуємо атомні орбіталі.
| Молекулярні орбіталі | F2 | F2+ |
| σ٭2рx | - | - |
| π٭2рy π٭2рz |  
|  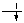
|
| σ2рx | 
| 
|
| π2рy π2рz |  
|  
|
| σ٭2s | 
| 
|
| σ2s | 
| 
|
Молекула 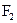 не містить неспарених електронів, тому вона діамагнітна, а в йоні
не містить неспарених електронів, тому вона діамагнітна, а в йоні 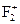 один неспарений електрон, наявність якого зумовлює парамагнітні властивості
один неспарений електрон, наявність якого зумовлює парамагнітні властивості 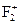 . Кратність зв’язків згідно з методом молекулярних орбіталей розраховується за формулою
. Кратність зв’язків згідно з методом молекулярних орбіталей розраховується за формулою
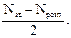
де Nзв - число зв’язувальних МО; Nрозп - число розпушувальних МО. Виходячи з наведеної формули, визначаємо, що для молекули 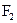 кратність зв’язку дорівнює
кратність зв’язку дорівнює

а для йона F2+:
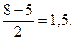
Енергія зв’язку в йоні 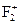 більша, ніж у молекулі
більша, ніж у молекулі 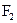 .
.
Завдання для самоперевірки
Дата добавления: 2019-02-13; просмотров: 167; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!