Завдання № 15-17 мають на меті розташування відповідей у певному порядку згідно із запропонованим завданням.
15 Розташуйте формули кислот у ряд за зростанням їх молярної маси:
A 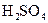 ; Б
; Б 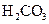 ; В
; В 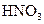 ; Г
; Г 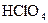 .
.
16 Розташуйте формули сполук у ряд за зростанням еквівалента Нітрогену в сполуках:
A 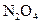 ; Б
; Б 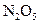 ; В
; В 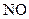 ; Г
; Г 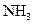 .
.
17 Розташуйте речовини, формули яких підкреслено, в ряд за зменшенням їх еквівалента:
| A | 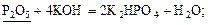
|
| Б | 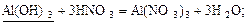
|
| В | 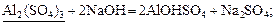
|
| Г | 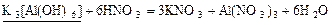 . .
|
Завдання № 18-20 вимагають проведення простих обчислень і наведення чисельної відповіді.
18 Скільки атомів Гідрогену міститься в 0,1 моль молекул води?
19 Який із перелічених газів за н.у. займає більший об’єм: 4,4 г 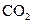 ; 2,24 л
; 2,24 л 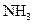 ;
; 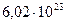 молекул Н2?
молекул Н2?
20 Скільки моль-еквівалентів речовини міститься у зразку 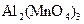 масою 76,8 г? (
масою 76,8 г? ( 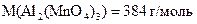 ).
).
Основи теорії будови речовини
Значення розділу. Матеріалознавцю необхідно бути обізнаним із властивостями різних видів матеріалів і вміти на цій підставі оцінювати можливі галузі їх використання. Також важливо знати, як склад і структура матеріалу визначають його властивості. Теоретичні основи цих знань формуються під час розгляду закономірностей щодо залежності властивостей: атому від його складу та електронної будови, молекули від її складу та хімічного зв’язку, кристалу від типу кристалічної ґратки. Саме під час вивчення теми «Основи теорії будови речовини» будуть розглянуті названі закономірності.
Цілі вивчення розділу:
- формування сучасних уявлень про будову атома, молекули;
- розгляд структури періодичної системи і розвиток знань про періодичність змінювання властивостей хімічних елементів та їх сполук;
|
|
|
- поглиблення знань про ковалентний (у світлі методів валентних зв’язків та молекулярних орбіталей, концепцію гібридизації атомних орбіталей), йонний та металічний види хімічного зв’язку;
- розгляд водневого зв’язку, вандерваальсових сил;
- поглиблення знань про типи кристалічних ґраток, про властивості твердих речовин.
Результати вивчення розділу
Необхідно знати:
1 Основні характеристики моделей атомів Томпсона, Резерфорда, Бора (для атома Гідрогену), постулати Бора.
2 Поняття: «хімічний елемент», «атом», «нуклід», «ізотоп», «протонне число», «нуклонне число».
3 Квантово-механічну модель атома Гідрогену, принцип невизначеності Гейзенберга.
4 Поняття: «хвильова функція», «атомна орбіталь», «квантові числа».
5 Принцип мінімуму енергії, правила Клечковського, принцип заборони Паулі, правило Гунда.
6Періодичний закон Д. І. Менделєєва, закон Мозлі; структуру короткої та довгої форм періодичної системи.
7Поняття: «атомний радіус», «енергія йонізації», «спорідненість до електрона», «електронегативність».
8 Закономірності змінювання властивостей хімічних елементів та їх сполук у межах періодів та підгруп.
|
|
|
9Види хімічного зв’язку: йонний, ковалентний, металічний, водневий. Вандерваальсові сили.
10Характеристики ковалентного зв’язку: енергію, довжину, кратність, полярність, направленість, насиченість, полярність.
11Метод валентних зв’язків, обмінний та донорно-акцепторний механізми утворення ковалентного зв’язку.
12 Концепцію гібридизації атомних орбіталей.
13 Метод молекулярних орбіталей.
14 Особливості аморфного та кристалічного стану твердих речовин.
15 Хімічні зв’язки у твердих тілах: ковалентні, йонні, металічні.
16 Типи кристалічних ґраток.
17 Елементи зонної теорії кристалів: валентна зона, заборонена зона, зона провідності.
Необхідно вміти:
1 Пояснювати переваги та недоліки моделей атомів Томпсона, Резерфорда, Бора (для атома Гідрогену).
2 Розрізняти ізотопи хімічного елемента, записувати їх символи, визначати заряд ядра, число протонів, електронів та нейтронів в атомі.
3 Пояснювати: сутність квантово-механічної моделі атома Гідрогену на підставі рівняння Де-Бройля, принципу невизначеності Гейзенберга, поняття «орбіталь».
4 Пояснювати фізичний зміст хвильової функції, квадрата хвильової функції, атомної орбіталі, квантових чисел (головного , орбітального, магнітного та спінового).
|
|
|
5 Описувати стан електрона в атомі за допомогою квантових чисел.
6 Складати електронні формули та електронно-графічні схеми атомів хімічних елементів за зазначеним порядковим номером елемента, спираючись на знання принципу мінімуму енергії, правил Клечковського, принципу заборони Паулі, правила Гунда.
7Пояснювати фізичний зміст порядкового номера елемента, причини «порушення» у послідовності розташування хімічних елементів ( 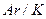 ,
, 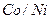 ,
, 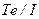 ) у періодичній системі, причини розподілу елементів на групи та підгрупи.
) у періодичній системі, причини розподілу елементів на групи та підгрупи.
8 Встановлювати період, групу та підгрупу, в яких розміщений хімічний елемент, елементи-аналоги.
9 Пояснювати розміщення у ПС s-, p-, d- та f-елементів.
10Пояснювати, як змінюються атомний радіус, енергія йонізації, спорідненість до електрона, електронегативність, металічні/неметалічні властивості, валентність хімічних елементів у періоді та головних і побічних підгрупах із зростанням заряду ядра.
12 Складати формули типових сполук хімічного елемента, визначати хімічний характер (кислотний, основний, амфотерний) оксидів та відповідних гідроксидів; пояснювати закономірності у змінюванні кислотно-основних властивостей оксидів та відповідних гідроксидів хімічних елементів у періоді та підгрупі.
|
|
|
13 Визначати за формулою тип хімічного зв’язку у сполуці.
14Пояснювати закономірності змінювання таких характеристик, як довжина, енергія, полярність хімічного зв’язку в ряді аналогічних сполук.
15 Визначати полярність зв’язку та молекули, наводити приклади полярних і неполярних сполук.
16 Складати формули Льюїса (електронно-точкові) для типових ковалентних сполук.
17 Пояснювати обмінний та донорно-акцепторний механізми утворення ковалентного зв’язку.
18 Визначати тип гібридизації ( sp3, sp2, sp ) центрального атома і встановлювати просторову форму молекул типових ковалентних сполук.
19 Складати і пояснювати електронні формули та енергетичні діаграми молекулярних орбіталей для гомоядерних молекул та молекулярних йонів, утворених елементами І - ІІ періодів.
20 Визначати порядок зв’язку у сполуці і прогнозувати можливість її існування, пояснювати наявність діамагнітних властивостей сполук.
21 Наводити приклади речовин, між молекулами яких виникають: а) водневі зв’язки, б) вандерваальсові сили.
22 Наводити приклади кристалів із різними типами хімічного зв’язку, пояснювати їх властивості.
23 Пояснювати електронні властивості кристалічних речовин на основі зонної теорії.
Дата добавления: 2019-02-13; просмотров: 146; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
