Хвильовий характер електрона.
Згідно з теорією Бора електрон розглядали як класичну частинку, і тому її рух описували законами класичної механіки та електродинаміки. У 1924 р. де Бройль запропонував поняття "корпускулярні хвилі" та висловив ідею про хвильову природу електрона.
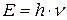 ;
;
 ;
;
 ;
; 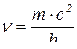 ;
; 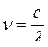 ;
;
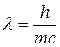
Для матеріальних частинок, подібних до електрона, які рухаються зі швидкістю 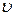 , цей вираз набуває вигляду:
, цей вираз набуває вигляду:
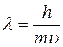
Гіпотеза де Бройля має загальний характер, і тому якому завгодно тілу масою 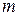 , що рухається зі швидкістю
, що рухається зі швидкістю 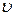 , має відповідати матеріальна хвиля. Довжина хвилі для макротіл, скажімо, тенісного м’яча, є настільки малою, що її неможливо виміряти за допомогою приладів. Для електронів же маса
, має відповідати матеріальна хвиля. Довжина хвилі для макротіл, скажімо, тенісного м’яча, є настільки малою, що її неможливо виміряти за допомогою приладів. Для електронів же маса 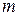 є набагато порядків меншою, тому величини
є набагато порядків меншою, тому величини 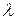 набувають вимірних значень.
набувають вимірних значень.
При розсіянні електронів кристалами спостерігається дифракція, подібна до дифракції рентгенівських променів. Це підтвердило припущення де Бройля про те, що електрону притаманні хвильові властивості: довжина хвилі, частота, фаза та здатність до інтерференції. Це припущення йде всупереч теорії Томсона про те, що електрон є частинкою з певною масою, енергією та моментом кількості руху.
Принцип додатковості Бора: електрон не може одночасно мати хвильові та корпускулярні властивості. Але для описання реальної поведінки електрона необхідно враховувати всі ці властивості, які взаємно доповнюють одне одного.
Відмінність у поведінці частинок мікросвіту та макротіл полягає в тому, що всі макротіла мають певне місце локалізації, тоді як стосовно мікрочастинок з їх двоїстою природою важко говорити про точну локалізацію. Хвиля як єдине ціле розподілена в просторі, тому її положення неможливо точно визначити.
|
|
|
Принцип невизначеності Гейзенберга (обмеження точності, з якою можна визначити положення  та імпульс
та імпульс 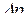 будь-якої мікрочастинки):
будь-якої мікрочастинки):
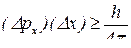
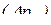 – невизначеність у величині імпульсу;
– невизначеність у величині імпульсу;
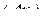 – невизначеність у положенні частинки у просторі.
– невизначеність у положенні частинки у просторі.
Таким чином, чим точніше виміряти імпульс, тим менш точно можна встановити положення в просторі.
Відповідно принципу невизначеності, електрон не можна уявляти як частинку, яка рухається від точки до точки, з певним імпульсом в кожній точці простору. Має сенс говорити тільки про деяку ймовірність перебування електрона у фіксованій точці простору. Не можна здійснити одночасне вимірювання з високою точністю таких фізичних величин, що дають можливість встановити, є електрон матеріальною частинкою чи хвилею.
Рівняння Шредінгера (описує хвильовий рух електрона в атомі).
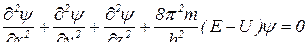
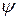 – хвильова функція;
– хвильова функція;
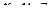 – координати;
– координати;
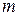 – маса електрона;
– маса електрона;
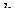 – стала Планка;
– стала Планка;
|
|
|
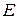 – повна енергія електрона;
– повна енергія електрона;
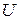 – потенційна енергія електрона.
– потенційна енергія електрона.
Змінна величина 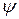 – хвильова функція. Вона є функцією координат, за якою можна знайти ймовірність. Вона пов’язана з амплітудою коливального руху електрона і може набувати як додатних, так і від’ємних значень, тоді як ймовірність завжди виражається додатним числом. Для розрахунків ймовірності знаходження електрона в певному місці використовують
– хвильова функція. Вона є функцією координат, за якою можна знайти ймовірність. Вона пов’язана з амплітудою коливального руху електрона і може набувати як додатних, так і від’ємних значень, тоді як ймовірність завжди виражається додатним числом. Для розрахунків ймовірності знаходження електрона в певному місці використовують 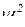 . Фізичний зміст
. Фізичний зміст 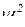 : добуток
: добуток 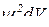 відповідає ймовірності перебування частинки в певному об’ємі
відповідає ймовірності перебування частинки в певному об’ємі  і має назву (для електрона) електронної густини.
і має назву (для електрона) електронної густини.
Хвильова функція має бути:
ü скінченною (не перетворюватись на ∞);
ü неперервною;
ü однозначною;
ü прямувати до нуля у разі нескінченного віддалення електрона від ядра.
Повне квантово-механічне розв’язання задачі про електронну будову атома 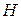 дає ряд хвильових функцій і відповідних їм енергій.
дає ряд хвильових функцій і відповідних їм енергій.
Стаціонарному стану електрона відповідає тільки одна дозволена комбінація трьох квантових чисел (цілочислові величини, за допомогою яких можна знайти кожну з виділених для розв’язання хвильових функцій)  . Кожній такій комбінації відповідає один із розв’язків хвильового рівняння Шредінгера, який і називають хвильовою функцією, орбіталлю або електронною хмарою.
. Кожній такій комбінації відповідає один із розв’язків хвильового рівняння Шредінгера, який і називають хвильовою функцією, орбіталлю або електронною хмарою.
|
|
|
Орбіталь цілком визначена, якщо для неї відомі значення квантових чисел 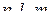 , цей набір є "адресою" електрона в атомі.
, цей набір є "адресою" електрона в атомі.
Квантові числа.
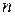 – головне квантове число.
– головне квантове число.
Характеризує енергетичний рівень та загальний запас енергії електрона в атомі.

Найменше значення енергії рівня відповідає найменшому 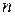 , зі збільшенням
, зі збільшенням 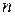 енергія рівнів збільшується. Якщо
енергія рівнів збільшується. Якщо 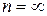 , електрон не зв’язаний з атомом, і йому, як вільній частинці, можна приписати будь-яке значення кінетичної енергії.
, електрон не зв’язаний з атомом, і йому, як вільній частинці, можна приписати будь-яке значення кінетичної енергії.
 – орбітальне квантове число.
– орбітальне квантове число.
Визначає форму орбіталей.

Табл. 6
Орбітальне квантове число 
| 0 | 1 | 2 | 3 |
| Позначення енергетичного підрівня | 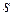
| 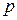
| 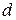
| 
|
Межі зміни орбітального квантового числа:
Табл. 7
| 
| Кількість значень 
| Позначення енергетичних підрівнів |
| 1 2 3 4 | 0 0, 1 0, 1, 2 0, 1, 2, 3 | 1 2 3 4 | 
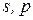
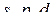
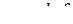
|
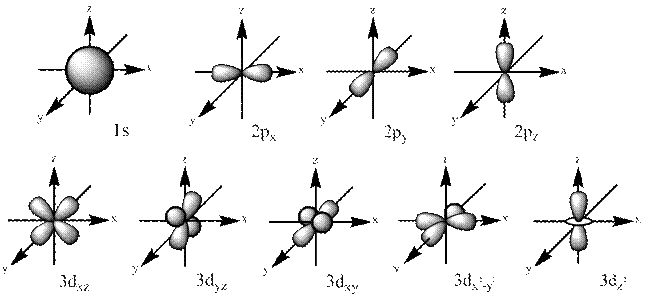
Рис. 5 Форми і просторова орієнтація 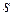 -,
-, 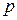 - і
- і 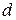 -орбіталей.
-орбіталей.
За заданим значенням числа  за рівнянням Шредінгера можна обчислити кутовий момент електрона. Найменшим є значення кутового моменту для
за рівнянням Шредінгера можна обчислити кутовий момент електрона. Найменшим є значення кутового моменту для 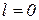 , в міру збільшення
, в міру збільшення  кутовий момент електрона зростає. Для орбіталей з
кутовий момент електрона зростає. Для орбіталей з 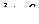 існує
існує  варіантів, якими орбіталь певної форми може бути орієнтована у просторі. За відсутності магнітного поля всі орієнтації вироджені, тобто однакові за енергією. Накладання магнітного поля усуває виродження орбіталей однакової форми. В цьому випадку значення кутового моменту будуть несхожими вздовж різних осей, що відповідає різній орієнтації однакових за формою орбіталей у просторі.
варіантів, якими орбіталь певної форми може бути орієнтована у просторі. За відсутності магнітного поля всі орієнтації вироджені, тобто однакові за енергією. Накладання магнітного поля усуває виродження орбіталей однакової форми. В цьому випадку значення кутового моменту будуть несхожими вздовж різних осей, що відповідає різній орієнтації однакових за формою орбіталей у просторі.
|
|
|
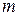 – магнітне квантове число.
– магнітне квантове число.
Пов’язане з просторовою орієнтацією електронних орбіталей атома.
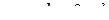
Кожному значенню магнітного квантового числа 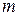 відповідає один енергетичний стан або одна електронна орбіталь з визначеною просторовою орієнтацією. Всі орбіталі одного підрівня в ізольованому атомі мають однакову енергію.
відповідає один енергетичний стан або одна електронна орбіталь з визначеною просторовою орієнтацією. Всі орбіталі одного підрівня в ізольованому атомі мають однакову енергію.
Межі зміни магнітного квантового числа:
Табл. 7
| Позначення підрівнів | 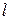
| 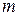
| Число орбіталей
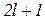
| Схематичне позначення |
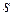
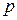
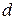

| 0 1 2 3 | 0 -1, 0, 1 -2, -1, 0, 1, 2 -3, -2, -1, 0, 1, 2, 3 | 1 3 5 7 | □ □□□ □□□□□ □□□□□□□ |
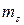 – спінове квантове число.
– спінове квантове число.
Для описання атомної орбіталі, тобто простору, в якому може знаходитись електрон в атомі, необхідно мати три квантових числа 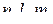 Для того, щоб повністю описати систему "електрон в атомі", потрібно ввести спінове квантове число
Для того, щоб повністю описати систему "електрон в атомі", потрібно ввести спінове квантове число 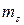 , оскільки електрон має власний магнітний момент, який квантується в напрямку паралельно чи протилежно застосованому магнітному полю.
, оскільки електрон має власний магнітний момент, який квантується в напрямку паралельно чи протилежно застосованому магнітному полю.
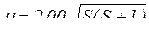
 .
.
μ вимірюється в магнетонах Бора 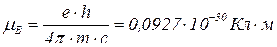
чи в дебаях 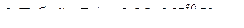 .
.
Атоми, які мають тільки спарені електрони 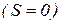 , виштовхуються з магнітного поля (діамагнітні). Атоми, які мають неспарені електрони
, виштовхуються з магнітного поля (діамагнітні). Атоми, які мають неспарені електрони 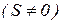 , втягуються в магнітне поле (парамагнітні).
, втягуються в магнітне поле (парамагнітні).
Спін виявляється в існуванні у електрона власного моменту імпульсу і спорідненого з ним магнітного моменту. Дуже спрощено спін передають як обертання електрона навколо власної осі. Дослідженнями встановлено, що проекція власного моменту імпульсу електрона може мати тільки два значення: 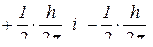 залежно від того, збігається напрямок власного обертання електрона з напрямком його руху навколо ядра чи протилежний.
залежно від того, збігається напрямок власного обертання електрона з напрямком його руху навколо ядра чи протилежний.
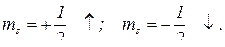
Багатоелектронні атоми.
Рівняння Шредінгера має точний розв’язок тільки для атома гідрогену.
Для багатоелектронних атомів використовують різноманітні методи наближень. Один з таких методів – метод Хартрі – Фока (метод самоузгодженого поля): обираються будь-які прийнятні значення хвильових функцій для кожного електрона в атомі, за виключенням одного, в розрахунку ефекту взаємодії ядра та всіх електронів, що залишились, з обраним електроном і в розрахунку так званої хвильової функції цього електрона. Потім обирають другий електрон (розрахунок проводять з урахуванням поліпшеної хвильової функції першого електрона) та розраховують поліпшену хвильову функцію для нього і далі до тих пір, поки не отримують поліпшені функції для усіх електронів в атомі. Потім весь цикл розрахунків повторюють, виходячи з поліпшених значень хвильових функцій, і отримують подальше поліпшення. Такі розрахунки повторюють доти, доки поліпшення не припиниться, тобто хвильові функції усіх електронів не стануть самоузгодженими.
У багатоелектронних атомах електрон взаємодіє не лише з ядром, а й з іншими електронами цього атома, відштовхуючись від них.
Багатоелектронні атоми можна уявити як системи, в яких у полі позитивно зарядженого ядра шарами розміщуються електрони, створюючи складні енергетичні рівні, побудовані з підрівнів. Стан електронів у багатоелектронних атомах відповідає принципу заборони Паулі:
в атомі не може бути двох електронів, у яких усі чотири квантові числа були б однакові.
Фізичний зміст цього принципу полягає в тому, що в одному й тому самому місці простору два електрони одночасно розміщуватися не можуть. Два електрони можуть займати одну орбіталь лише за умови, що вони мають протилежно спрямовані спіни. Кожна орбіталь незалежно від того, де вона розміщена, може мати максимум два електрони. Два електрони, які перебувають на одній орбіталі, називаються спареними.
Правило Хунда:
на підрівнях електрони розміщуються так, щоб сума їхніх спінових квантових чисел була максимальною.
Це пов’язане із взаємним відштовхуванням електронів, розміщених на підрівні. Електрони на вироджених орбіталях підрівня мають розміщуватись так, щоб взаємодіяти між собою з найменшою енергією, а це досягається за умови, що вони не спарюються. Утворення електронних пар енергетично невигідне і потребує затрат енергії, тому на схемі в усіх комірках підрівня, що заповнюється, спочатку розміщуються по одному електрону, а вже далі вони починають спарюватися.
Наприклад,
три електрони на  – підрівні:
– підрівні:
чотири електрони на  – підрівні:
– підрівні:
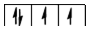
У багатоелектронних атомах електрони розміщуються в навколоядерному просторі в послідовності поступового підвищення енергії. Енергія підрівнів зростає в міру збільшення головного квантового числа 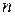 та орбітального квантового числа
та орбітального квантового числа 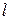 .
.
Правила Клечковського.
Перше правило:
Електрони заповнюють орбіталі в порядку зростання суми 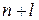 , в першу чергу заповнюється підрівень з меншою сумою
, в першу чергу заповнюється підрівень з меншою сумою 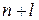 .
.
Друге правило:
У разі однакових значень сумм 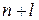 заповнення орбіталей електронами відбувається в міру збільшення значень головного квантового числа
заповнення орбіталей електронами відбувається в міру збільшення значень головного квантового числа 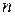 .
.
Приклади завдань.
1. Поясніть, чи існують підрівні:
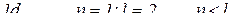 , що не відповідає умові існування підрівня
, що не відповідає умові існування підрівня 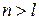 , отже
, отже  – підрівень не існує.
– підрівень не існує.
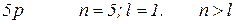 , що відповідає умові існування підрівня
, що відповідає умові існування підрівня 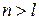 , отже
, отже 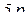 – підрівень існує.
– підрівень існує.
2. Яким набором квантових чисел характеризується кожна орбіталь та кожний електрон 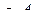 підрівня.
підрівня.
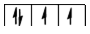
| № орбіталі | 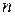
| 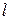
| 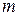
| № електрона | 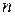
| 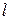
| 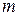
| 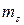
| |
| 1. | 4 | 1 | -1 | 1. | 4 | 1 | -1 | +1/2 | |
| 2. | 4 | 1 | 0 | 2. | 4 | 1 | -1 | -1/2 | |
| 3. | 4 | 1 | 1 | 3. | 4 | 1 | 0 | +1/2 | |
| 4. | 4 | 1 | 1 | +1/2 |
3. Наведіть електронні формули та схеми для атомів елементів, що мають порядкові номери 17, 27, 75.
№ 17.
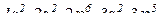
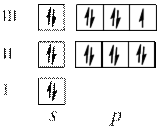
№ 27.
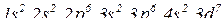 (за правилами Клечковського).
(за правилами Клечковського).
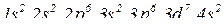 (електронна формула)
(електронна формула)

№ 75.
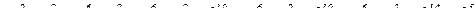 (за правилами Клечковського).
(за правилами Клечковського).
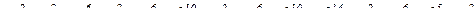 (електронна формула).
(електронна формула).

ПЕРІОДИЧНИЙ ЗАКОН.
У 1869 р. Д.І.Менделєєв розмістив 64 хімічних елемента у порядку зростання їх атомних мас та виявив періодичність повторення їх властивостей.
Властивості простих тіл, а також форми і властивості сполук елементів перебувають у періодичній залежності від величин атомних ваг елементів.
Менделєєв не зміг пояснити справжньої причини встановленої періодичності під час розміщення Co та Ni, Te та I та віддав перевагу характеру зміни хімічних властивостей.
У 1913 р. Мозлі під час дослідження рентгенівського випромінювання простих речовин виявив, що частота 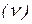 цих променів більшою мірою пов’язана з порядковими номерами елементів, ніж з їхніми відносними атомними масами.
цих променів більшою мірою пов’язана з порядковими номерами елементів, ніж з їхніми відносними атомними масами.
Рентгенівське випромінювання виникає, коли хімічний елемент у вигляді простої твердої речовини бомбардується пучком електронів з високою енергією. Цей електронний потік вибиває і несе за собою електрони з внутрішніх оболонок багатоелектронних атомів. На звільнені місця відразу переміщуються електрони з вищих етичних рівнів, випромінюючи енергію. Це випромінювання залежить від природи елемента і називається характеристичним.
Закон Мозлі.
Корені квадратні із обернених значень довжин хвиль характеристичного рентгенівського випромінювання перебувають у лінійній залежності від порядкових номерів елементів.
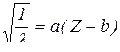
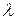 – довжина хвилі;
– довжина хвилі;
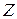 – порядковий номер елемента;
– порядковий номер елемента;
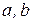 – сталі величини для однотипних ліній рентгенівських спектрів атомів різних елементів.
– сталі величини для однотипних ліній рентгенівських спектрів атомів різних елементів.
Енергія квантів рентгенівського випромінювання має залежати від відстані між ядром та електроном на відповідному енергетичному рівні та від заряду ядра. Коли електрони повертаються з більш віддалених на один і той самий енергетичний рівень, то довжина хвилі відповідної спектральної лінії має залежати тільки від заряду ядра, оскільки відстань від ядра до відповідного енергетичного рівня змінюється дуже мало (Н. Бор).
Більшому заряду ядра відповідає більша енергія кванта, що випромінюється, або менша довжина хвилі.
Порядковому номеру елемента в періодичній системі відповідає позитивний заряд ядра атома цього елемента.
Сучасне формулювання періодичного закону:
властивості елементів, а також форми та властивості їх сполук перебувають у періодичній залежності від зарядів ядер їхніх атомів.
Характер заповнення електронами енергетичних рівнів у атомах елементів взаємозв’язаний з положенням елементів у ПС.
Структура ПС.
Періоди – горизонтальні ряди елементів, розміщених у порядку поступового зростання зарядів атомних ядер.
У межах періодів властивості елементів змінюються від типових металів до типових неметалів. Закінчується кожний період інертним газом.
Усі періоди, за винятком першого (два елементи), парні, тобто попарно вміщують однакове число елементів.
ІІ та ІІІ – 8 елементів;
ІV та V – 18 елементів;
VI – 32 елемента;
VII – не закінчений.
Періоди розміщені один під одним так, що хімічні елементи з подібними властивостями виявляються згрупованими.
Групи – вертикальні ряди елементів. Групи містять підгрупи: головну (А) та побічну (В).
До головної підгрупи входять елементи, розміщені під елементами ІІ та ІІІ періодів (типових елементів).
Елементи, зміщені відносно елементів головної підгрупи, становлять побічну підгрупу.
Побічна підгрупа VIII групи складається з трьох елементів – тріад.
Ускладненою є побічна підгрупа ІІІ групи VI та VII періодів. Її винесено під таблицю. Ці елементи – лантаноїди та актиноїди.
У межах елементів, які складають період, відбувається поступова забудова електронами зовнішнього, а часто і передостаннього підрівнів. Підрівні, що заповнюються, називають валентними. Електрони та орбіталі цих підрівнів беруть участь в утворенні хімічних зв’язків. Число таких електронів збільшується на одиницю в разі переходу від попереднього елемента до наступного, отже і змінюється хімічна поведінка атомів елементів.
Номер періоду, в якому знаходиться елемент, збігається з найбільшим значенням головного квантового числа.
Кожен період починається забудовою 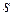 - підрівня, а закінчується формуванням
- підрівня, а закінчується формуванням 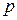 – підрівня. В IV періоді з’являється
– підрівня. В IV періоді з’являється 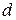 - підрівень, в VI та VII періодах -
- підрівень, в VI та VII періодах -  підрівень.
підрівень.
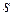 – елементів (у яких забудовується
– елементів (у яких забудовується 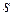 – підрівень) у кожному періоді по 2. Вони утворюють головні підгрупи 1 та 2 груп.
– підрівень) у кожному періоді по 2. Вони утворюють головні підгрупи 1 та 2 груп.

Ці елементи – типові метали (крім Н, Не).
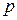 – елементів (у яких
– елементів (у яких 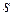 – підрівень вже сформований і поступово забудовується
– підрівень вже сформований і поступово забудовується 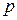 – підрівень) у кожному періоді по 6. Вони утворюють головні підгрупи 3 - 8 груп.
– підрівень) у кожному періоді по 6. Вони утворюють головні підгрупи 3 - 8 груп.

Властивості цих елементів змінюються від металічних до типово неметалічних.
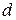 - елементів (у атомах яких заповнюється
- елементів (у атомах яких заповнюється  – підрівень) – по 10. Вони утворюють побічні підгрупи елементів усіх груп.
– підрівень) – по 10. Вони утворюють побічні підгрупи елементів усіх груп.

Всі вони є металами (наз. перехідні метали).
 - елементів (у атомах яких заповнюється
- елементів (у атомах яких заповнюється  – підрівень) – по 14. Вони утворюють побічні підгрупи ІІІ групи елементів VI та VII періодів.
– підрівень) – по 14. Вони утворюють побічні підгрупи ІІІ групи елементів VI та VII періодів.

Всі вони є металами.
"Проскок" електрона.
Оскільки найбільш стійкими є конфігурації з наполовину або повністю заповненими підрівнями, для деяких елементів спостерігається "проскок" електрона.
Cr 
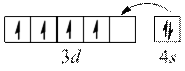

наполовину заповнений  – підрівень.
– підрівень.
Cu 

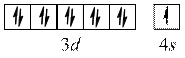
повністю заповнений  – підрівень.
– підрівень.
Отже, загальна електронна конфігурація елементів, у яких спостерігається "проскок" електрона:

Визначення, виходячи з будови електронних оболонок атомів, у якому періоді, групі, підгрупі знаходиться елемент:
ü номер періоду – найбільше значення головного квантового числа  ;
;
ü номер групи – сума валентних електронів;
ü підгрупа – 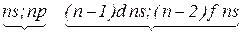
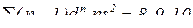 – елемент знаходиться в 8 групі побічній підгрупі.
– елемент знаходиться в 8 групі побічній підгрупі.
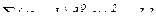 – елемент знаходиться в 1 групі побічній підгрупі.
– елемент знаходиться в 1 групі побічній підгрупі.
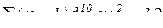 – елемент знаходиться в 2 групі побічній підгрупі.
– елемент знаходиться в 2 групі побічній підгрупі.
Приклади завдань.
1. Наведіть електронні формули атомів елементів, що мають порядкові номери 35, 46, 59, 80. Знайдіть валентні електрони, поясніть, виходячи з будови електронних оболонок атомів, у якому періоді, групі, підгрупі знаходиться елемент.
№35.
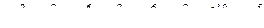
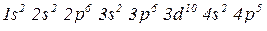
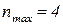 , отже елемент знаходиться у IV періоді;
, отже елемент знаходиться у IV періоді;
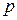 – елемент (заповнюється останнім р – підрівень) – в головній підгрупі;
– елемент (заповнюється останнім р – підрівень) – в головній підгрупі;
∑ валентних електронів 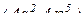 = 7 – в 7 групі.
= 7 – в 7 групі.
Отже елемент знаходиться в IV періоді, 7 групі, головній підгрупі.
№46.
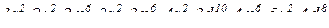
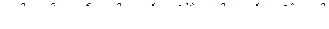
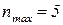 , отже елемент знаходиться у V періоді;
, отже елемент знаходиться у V періоді;
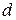 – елемент (заповнюється
– елемент (заповнюється 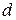 – підрівень) – в побічній підгрупі;
– підрівень) – в побічній підгрупі;
∑ валентних електронів 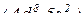 = 10 – в 8 групі.
= 10 – в 8 групі.
Отже елемент знаходиться в V періоді, 8 групі, побічній підгрупі.
№59.
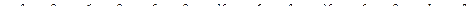

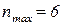 , отже елемент знаходиться у VI періоді;
, отже елемент знаходиться у VI періоді;
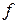 – елемент (заповнюється
– елемент (заповнюється 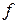 – підрівень) – в побічній підгрупі;
– підрівень) – в побічній підгрупі;
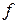 – елементи – 3 група.
– елементи – 3 група.
Отже елемент знаходиться в VI періоді, 3 групі, побічній підгрупі.
№80.


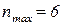 , отже елемент знаходиться у VI періоді;
, отже елемент знаходиться у VI періоді;
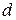 – елемент (заповнюється
– елемент (заповнюється 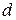 – підрівень) – в побічній підгрупі;
– підрівень) – в побічній підгрупі;
∑ валентних електронів 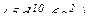 = 12 – в 2 групі.
= 12 – в 2 групі.
Отже елемент знаходиться в VI періоді, 2 групі, побічній підгрупі.
Періодичний характер зміни мають ті властивості, які залежать від будови валентних електронних підрівнів атомів. Це – хімічні властивості, розміри атомів, атомні об’єми, енергетичні характеристики (енергія іонізації, спорідненість до електрону, ін.).
Неперіодично змінюються властивості, які залежать від значення заряду ядра – атомні маси, довжини хвиль окремих ліній рентгенівського спектра.
Енергія іонізації  .
.
Коли атом перетворюється на позитивно заряджений іон, то відбувається його іонізація. Цей процес завжди пов’язаний із затратою енергії.
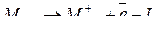
Енергія іонізації – енергія, яку потрібно затратити, щоб від ізольованого (що перебуває у газоподібному стані) атома чи іона відщепити електрон.
Здатним до відщеплення є електрон, який найслабше зв’язаний з ядром. Його енергію визначають за формулою:
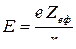
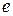 – заряд електрона;
– заряд електрона;
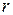 – радіус атома;
– радіус атома;
 – ефективний заряд ядра (під час його розрахунку враховують екрануючу дію інших електронів атома на той, що відщеплюється).
– ефективний заряд ядра (під час його розрахунку враховують екрануючу дію інших електронів атома на той, що відщеплюється).
Екранування.
Оскільки заряд ядра збільшується швидше, ніж головне квантове число (наприклад, за n = 1, Z = 1 та 2; n = 2, Z = 3…10), то можна очікувати, що енергія, необхідна для відщеплення електрона від атома, повинна збільшуватися зі збільшенням Z . Це не так.
І(Н) = 1312 кДж/моль
І(Li) = 520 кДж/моль
Менше значення енергії іонізації Li пояснюється:
ü середня відстань 2s – електрона від ядра більша, ніж 1s – електрона;
ü 2s – електрон атома Li відштовхується від внутрішніх 1 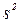 – електронів, що полегшує його відщеплення.
– електронів, що полегшує його відщеплення.
"Внутрішнє" відштовхування пояснюється також "екрануванням" ядра внутрішніми електронами, що спричиняє притягання валентних електронів лише часткою загального заряда ядра. Ця частка називається ефективним зарядом ядра Zеф.
Zеф(Li) = +1,3 (замість 3).
Електронна густина 1s – орбіталі знаходиться ближче до ядра, ніж густина 2s - орбіталі. Закони електростатики стверджують, що коли пробний заряд (2s – електрони) не накладається на інший заряд (1s – електрони), потенціал буде таким самим, якби цей інший заряд знаходився у центрі (в ядрі). Тоді валентному електрону на 2s – орбіталі відповідав би потенціал, еквівалентний одиничному ефективному заряду ядра (Zеф = 1,0).
Якби заряд 2s – електрона проникав у поле 1s – електрона, він був би екранований і відповідав би потенціалу, еквівалентному повному заряду ядра
(Zеф = 3,0).
За часткового проникнення енергія орбіталі 2s – електрона не змінюється, але енергія іонізації 2s – електрона визначається вже ефективним ядерним зарядом Zеф, який дещо менший дійсного заряду ядра:
Zеф = Z - S
S – константа екранування.
Завдяки наявності одного чи декількох максимумів електронної густини біля ядра s – орбіталі є сильно проникаючими в орбіталі попередніх рівнів і менш екрановані електронами, які розташовані на цих попередніх рівнях, ніж орбіталі з більшим значенням l.
В свою чергу, s – орбіталі екранують в більшій мірі, ніж інші орбіталі. Найбільш проникаючими та найменш екрануючими є орбіталі з високими значеннями l (d –та f – орбіталі).
Розрахунок константи екранування (за Сл етером) на ns - або np – орбіталі:
а) записують електронну конфігурацію атома елемента як наступні групи орбіталей: (1s) (2s 2p) (3s 3p) (3d) (4s 4p) (4d) (4f) (5s 5p) (5d) (5f) …
б) електрони будь-якого угруповання справа від (ns np) – групи не уносять внеску у константу екранування;
в) приймають, що усі електрони цієї (ns np) – групи, що залишилися, екранують валентний електрон з внеском 0,35 на кожний з них;
г) припускають, що усі електрони на (n – 1) – рівні екранують з внеском 0,85 на кожний з них, усі електрони (n – 2) – рівня або нижче екранують валентний електрон повністю (внесок 1,00).
Якщо екранований електрон знаходиться у nd –або nf – групах, правила б) та в) залишаються, а правило г) змінюється: усі електрони в групах, які розташовані зліва nd –або nf – груп, вносять 1,00 у константу екранування.
Розрахунок Zеф для валентного 2р – електрона в атомі нітрогену:
згрупована електронна конфігурація (1s)2 (2s 2p)5
S = 2 ∙ 0,85 + (5-1) ∙ 0,35 = 3,10 (5ē 2s 2p мінус один, для якого проводиться розрахунок).
Zеф = Z – S = 7,0 – 3,1 = 3,9.
Розрахунок Zеф для валентного 4s – електрона в атомі цинку:
згрупована електронна конфігурація (1s)2 (2s 2p)8 (3s 3p)8 (3d)10 (4s)2
S = (2 + 8) ∙ 1,00 + (8 + 10) ∙ 0,85 + (2 – 1) ∙ 0,35 = 25,65 (2ē 4s мінус один, для якого проводиться розрахунок).
Zеф = Z – S = 30,0 – 25,65 = 4,35.
Розрахунок Zеф для валентного 3d – електрона в атомі цинку:
згрупована електронна конфігурація (1s)2 (2s 2p)8 (3s 3p)8 (3d)10 (4s)2
S = (2 + 8 + 8) ∙ 1,00 + (10 – 1) ∙ 0,35 = 21,15 (10ē 3d мінус один, для якого проводиться розрахунок).
Zеф = Z – S = 30,0 – 21,15 = 8,85.
Енергія іонізації залежить від ефективного заряду ядра 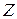 , радіусу атома
, радіусу атома 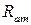 , екрануючої дії електронів:
, екрануючої дії електронів:
а) 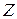 збільшується (більша взаємодія електрона з ядром),
збільшується (більша взаємодія електрона з ядром), 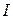 збільшується;
збільшується;
б) 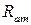 збільшується (менша взаємодія ē з ядром),
збільшується (менша взаємодія ē з ядром), 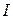 зменшується;
зменшується;
в) характер підрівнів (чим міцніше електрон на підрівні сполучений з ядром, тим важче його відщепити), 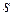 – електрон відщепити важче, ніж
– електрон відщепити важче, ніж 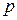 – електрон,
– електрон, 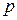 – електрон відщепити важче, ніж
– електрон відщепити важче, ніж 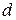 – електрон.
– електрон.
г) ефект екранування ( 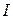 зменшується в міру збільшення числа внутрішніх екрануючих електронів);
зменшується в міру збільшення числа внутрішніх екрануючих електронів);
д) характер забудови електронами підрівнів: наполовину або повністю заповнені підрівні (окрім 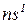 )
) 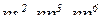 відрізняються підвищеною стійкістю.
відрізняються підвищеною стійкістю.
Наприклад, зміна енергії іонізації атомів елементів ІІ періоду:
У періоді (від початку до кінця періоду) зростає заряд ядер атомів, що повинно призводити до зростання енергії іонізації. У тій же послідовності зменшуються радіуси атомів, що також повинно призводити до зростання енергії іонізації.
екрануюча дія електронів – однакова.
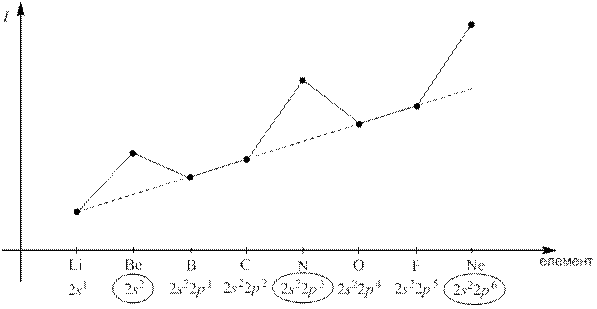
Рис. 6 Зміна енергії іонізації атомів елементів ІІ періоду
Енергія іонізації змінюється періодично. В межах періоду  зростає зліва направо, в порядку зростання зарядів ядер атомів, у головних підгрупах зменшується зверху вниз.
зростає зліва направо, в порядку зростання зарядів ядер атомів, у головних підгрупах зменшується зверху вниз.
Спорідненість до електрона  .
.
Спорідненість до електрона – енергія, яка виділяється чи поглинається внаслідок приєднання електрона до ізольованого атома (який перебуває у газоподібному стані).

Спорідненість до електрона залежить від ефективного заряду ядра, радіусу атома:
а) 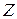 збільшується (більша взаємодія електрона з ядром),
збільшується (більша взаємодія електрона з ядром), 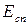 збільшується;
збільшується;
б) 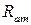 збільшується (менша взаємодія електрона з ядром),
збільшується (менша взаємодія електрона з ядром), 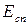 зменшується;
зменшується;
в) характер забудови електронами підрівнів: 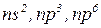 відрізняються підвищеною стійкістю.
відрізняються підвищеною стійкістю.
Спорідненість до електрона змінюється періодично. В межах періоду 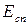 зростає зліва направо, в головних підгрупах зменшується зверху вниз.
зростає зліва направо, в головних підгрупах зменшується зверху вниз.
Наприклад, зміна спорідненості до електрона атомів елементів ІІ періоду:
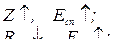

Рис. 7 Зміна спорідненості до електрона атомів елементів ІІ періоду
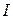 та
та 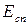 певною мірою характеризують здатність елементів взаємодіяти між собою. Коли один елемент має низьку енергію іонізації, а інший – велику спорідненість до електрона, вони легко взаємодіють з утворенням стійких сполук.
певною мірою характеризують здатність елементів взаємодіяти між собою. Коли один елемент має низьку енергію іонізації, а інший – велику спорідненість до електрона, вони легко взаємодіють з утворенням стійких сполук.
Електронегативність.
Електронегативність є узагальненою емпіричною характеристикою хімічних властивостей елементів.
Електронегативність – відносна здатність атомів елемента притягати до себе електрони у будь-якому хімічному оточенні.
Енергія іонізації атома показує його здатність утримувати валентні електрони, а енергія спорідненості до електрона – здатність приєднувати додаткові електрони. Отже, енергія іонізації є мірою металічних властивостей елемента; чим вона менша, тим легше атоми певного елементу можуть віддавати електрони, що характерно для елементів-металів. З іншого боку, енергія спорідненості до електрона є показником неметалічності характеру елемента; чим вона менша, тим менша є у атома можливість приєднати електрони, що характерно для елементів-неметалів. Отже, чим менша енергія спорідненості до електрона та енергія іонізації атома, тим краще виявляються в елемента металічні властивості, і, відповідно, гірше виявляються неметалічні. Відносна ж здатність атомів елемента притягати до себе електрони у будь-якому хімічному оточенні визначається як енергією іонізації, так і енергією спорідненості до електрона, тому було запропоновано в першому наближенні визначати електронегативність як міру атома утримувати біля себе електрони хімічних зв’язків через півсуму енергій іонізації та спорідненості до електрона:
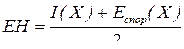
Можна відзначити, що для тих елементів, для яких спостерігається зниження енергії спорідненості до електрона (мінімуми на рис. 7) відбувається зростання енергії іонізації (максимуми на рис. 6), тому загалом у періоді у разі зростання заряду ядра атома відбувається монотонне збільшення значень електронегативності (рис. 8). Це відповідає зростанню неметалічного характеру елементів та послабленю металічних у межах одного періоду.
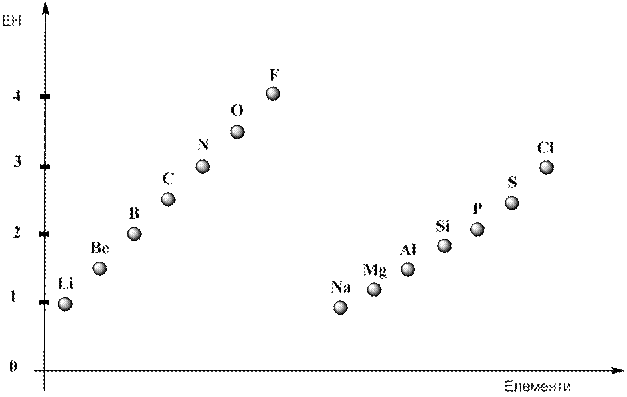
Рис. 8
Чим більша електронегативність атома, тим сильніше він притягує спільну електронну пару. Інакше кажучи, при утворенні ковалентного зв’язку між двома атомами різних елементів спільна електронна хмара зміщується до більш електронегативного атома, і в тим більшій мірі, чим більша різниця електронегативності взаємодіючих атомів. Значення електронегативностей атомів елементів наведені у додатку Г .
Дата добавления: 2019-02-13; просмотров: 171; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
