ОСНОВНІ ПОНЯТТЯ АТОМНО-МОЛЕКУЛЯРНОГО ВЧЕННЯ
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ УКРАЇНИ
“КИЇВСЬКИЙ ПОЛІТЕХНІЧНИЙ ІНСТИТУТ”
Хімія
ОСНОВНІ ПОНЯТТЯ.
БУДОВА РЕЧОВИНИ
Навчальний посібник
для студентів фізико-математичного факультету
Рекомендовано Міністерством освіти і науки України
Київ
НТУУ “КПІ”
2015
Хімія: Основні поняття. Будова речовини: Навчальний посібник для студентів фізико-математичного факультету/ Автори: Шульженко О.О., Шпак А.Є., Гріщенко Л.П. – К.: НТУУ "КПІ", 2015. - 133 с.
Гриф надано Міністерством освіти і науки України
(протокол №___від___________2015 р.)
Електронне навчальне видання
Хімія
Основні поняття. Будова речовини
Навчальний посібник
для студентів фізико-математичного факультету
Автори Шульженко Олена Олександрівна, ст. викл.
Шпак Арсеній Євгенович, асистент
Гріщенко Лариса Петрівна, асистент
Відповідальний
редактор О.О. Андрійко, д. х. н., зав. кафедри загальної та неорганічної хімії ХТФ НТУУ “КПІ”
Рецензенти Г.Г. Жалніна, канд. хім. наук, доц. кафедри хімії факультету природничих наук Національного університету “Києво-Могилянська академія”
В.П. Плаван, доктор техн. наук, професор, зав. каф. прикладної екології, технології полімерів і хімічних волокон Київського національного університету технології та дизайну
|
|
|
ЗМІСТ
Зміст…………………………………………………………………………...3
Вступ…………………………………………………………………………..4
Атомно-молекулярне вчення…..………………………………………….....5
Основні поняття атомно-молекулярного вчення.…………………………..8
Стехіометричні закони хімії
Закон збереження маси………………………………………………...…….14
Закон сталості складу……..……………………………………...…………..14
Закон еквівалентів…………………………………...………………………..15
Закони ідеальних газів…………………………………………..………...….25
Класи неорганічних сполук…………………………………………………..35
Будова атомів хімічних елементів……………………………………………74
Періодичний закон……………………………………………………………..98
Завдання для самостійної підготовки……….……………………….…..…..115
Список рекомендованої літератури………………………………...………...127
Додатки
1. Додаток А. Назви деяких простих речовин і елементів……………...129
2. Додаток Б. Значення деяких фундаментальних сталих...…….………130
3. Додаток В. Розчинність кислот, основ та солей у воді……………….131
4. Додаток Г. Таблиця електронегативностей………………………...….133
5. Додаток Д. Періодична система елементів Д.І.Менделєєва…………..134
|
|
|
ВСТУП
Навчальний посібник „Хімія. Атомно-молекулярне вчення. Основні поняття атомно-молекулярного вчення. Стехіометричні закони хімії. Класи неорганічних сполук. Будова атомів хімічних елементів. Періодичний закон” складений у відповідності до програми з загальної хімії для технологічних спеціальностей вищих учбових закладів і призначений для організації самостійної роботи студентів перед лабораторними заняттями з хімії, контролю знань та підготовки студентів до контрольних робіт.
До кожної теми подано теоретичні відомості, які необхідні для самостійного виконання задач, завдання для домашньої підготовки та приклади розв’язання цих завдань.
При підготовці теми необхідно вивчити програмні питання, користуючись даним посібником та за літературними джерелами, вказаними в кінці даного посібника. Потім треба письмово розв’язати задачі, дати обгрунтовані відповіді на поставлені запитання.
АТОМНО-МОЛЕКУЛЯРНЕ ВЧЕННЯ
Атомно-молекулярне вчення розвинув і вперше застосував в хімії видатний російський вчений М.В.Ломоносов. Основні положення його вчення викладені у роботі „Елементи математичної хімії” (1741) та ін. Суть вчення Ломоносова зводиться до положень:
|
|
|
1. Всі речовини складаються з „корпускул” (молекул).
2. Молекули складаються з „елементів” (атомів).
3. Частинки – молекули та атоми – знаходяться у безперервному русі. Теплота складається з внутрішнього руху цих частинок.
4. Молекули простих речовин складаються з однакових атомів, молекули складних речовин – з різних атомів.
Через 67 років після вказаної роботи Ломоносова вийшла книга англійського вченого Д.Дальтона „Нова система хімічної філософії” (1808), де були викладені основні положення хімічної атомістики. Дальтон вперше визначив атомні маси відомих тоді елементів та запровадив знаки для позначення атомів.
Але Дальтон заперечував існування молекул у простих речовин. Він вважав, що прості речовини складаються тільки з атомів і лише складні речовини – з „складних атомів” (у сучасному розумінні – молекул).
Сучасні формулювання було прийнято в 1860 р. на І міжнародному конгресі хіміків в м. Карлсруе, засновані на вченнях Епікура, Дальтона, Ломоносова:
1. Усі речовини є сукупністю молекул або кристалами, які побудовані з атомів.
2. Атоми одного елемента однакові між собою, але відрізняються від атомів іншого елемента.
|
|
|
3. Атом є найменшою частинкою елемента і носієм його хімічних властивостей; його не можна розкласти хімічним способом; під час хімічних перетворень атоми не з’являються з нічого і нікуди не зникають, змінюються лише способи зв’язування атомів.
4. Внаслідок взаємодії атомів утворюються молекули: гомоядерні у простих речовин  , гетероядерні – у складних
, гетероядерні – у складних  .
.
5. Під час фізичних явищ (кипіння, плавлення, ін.) молекули зберігаються, під час хімічних перетворень – руйнуються.
6. Хімічні реакції полягають в утворенні нових речовин із тих самих атомів, з яких складалися вихідні речовини.
Згідно сучасних уявлень, з молекул складаються речовини у газоподібному стані. У твердому (кристалічному) стані з молекул складаються лише речовини, які мають молекулярну структуру, наприклад органічні речовини, неметали (за невеликим виключенням), оксид карбону (ІV), вода. У молекулярних кристалах відстані між окремими групами атомів більші, ніж між атомами у цих групах, тобто у їхній структурі можна виділити поодинокі молекули. Сили, що діють між атомами у молекулі більші, ніж між окремими молекулами у кристалі.
Але більшість твердих неорганічних речовин не мають молекулярної структури. Вони складаються не з молекул, а з інших частинок (іонів, атомів) та існують у вигляді макротіл (кристали хлориду натрію, кварц, залізо, ін.). Наприклад, солі, оксиди та сульфіди металів, алмаз, кремній, метали. Формули речовин з немолекулярною будовою, наприклад  , лише відображають співвідношення між частинками, що їх утворюють. Тому для таких речовин використовують поняття формульної одиниці, яка включає найменшу кількість частинок, необхідних для відображення цього співвідношення.
, лише відображають співвідношення між частинками, що їх утворюють. Тому для таких речовин використовують поняття формульної одиниці, яка включає найменшу кількість частинок, необхідних для відображення цього співвідношення.
У речовин з молекулярною структурою хімічний зв’язок між молекулами менш міцний, ніж у речовин з атомною структурою. Тому вони мають порівняно низькі температури плавлення та кипіння. У речовин з немолекулярною структурою хімічний зв’язок між частинками міцний. Тому вони мають високі температури плавлення та кипіння.
ОСНОВНІ ПОНЯТТЯ АТОМНО-МОЛЕКУЛЯРНОГО ВЧЕННЯ
Атом – найменша хімічно неподільна частинка елемента, яка є носієм його хімічних властивостей. Це електронейтральна система, що складається з позитивно зарядженого ядра та негативно заряджених електронів, що рухаються навколо нього.
Хімічний елемент – певний вид атомів з однаковими хімічними властивостями (з однаковим зарядом ядра). Хімічні властивості того чи іншого елемента визначаються будовою електронних оболонок, що оточують ядро атома. Будова цих оболонок, в свою чергу, залежить від кількості електронів у атомі, а ця кількість визначається зарядом ядра. Отже хімічні властивості елементу залежать від заряду ядра.
Молекула – угруповання атомів, сполучених між собою хімічними зв’язками і здатних до самостійного існування; найменша частинка, що зберігає хімічні властивості речовини.
Проста речовина – макротіло, яке складається з атомів одного і того ж хімічного елемента.
Багато хімічних елементів утворюють декілька простих речовин, які різняться за будовою та властивостями. Це явище називають алотропією, а речовини, які утворюються – алотропними модифікаціями. Так, елемент оксиген утворює дві алотропні модифікації – кисень та озон, елемент карбон утворює чотири – алмаз, графіт, карбін та фулерен, декілька модифікацій утворює елемент фосфор.
Явище алотропії викликано двома причинами:
1. Різним числом атомів в молекулі, наприлад, кисень  та озон
та озон  ,
,
2. Утворенням різних кристалічних форм, наприклад, алмаз, графіт, карбін та фулерен.
Хімічна сполука – макротіло, яке складається з атомів різних елементів.
Атоми мають постійну масу. Але маса одного атома – дуже маленька величина. Наприклад, 
 Тому користуватися абсолютними масами атомів (вираженими у грамах) незручно, і тому існує інший спосіб визначення маси атома – використання відносної атомної маси.
Тому користуватися абсолютними масами атомів (вираженими у грамах) незручно, і тому існує інший спосіб визначення маси атома – використання відносної атомної маси.
Відносна атомна маса  – відношення середньої маси атомів природної суміші ізотопів певного елемента до
– відношення середньої маси атомів природної суміші ізотопів певного елемента до 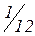 частини маси атома
частини маси атома  .
.
Відносна атомна маса показує, у скільки разів маса атома даного елемента більше 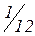 маси атома
маси атома  .
.
Маси атомів:



Одиниця виміру маси атома – атомна одиниця маси (а.о.м.). Маса атома, виражена у а.о.м., чисельно дорівнює відносній атомній масі.

Ізотопи – різновиди атомів одного елемента (з однаковим зарядом ядра), які різняться атомною масою.
Ізотопи гідрогену:
 ;
;
 ;
;
 .
.
Відносна молекулярна маса  – відношення маси молекули простої чи складної речовини до
– відношення маси молекули простої чи складної речовини до  частини маси атома
частини маси атома 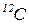 .
.

Чисельне значення відносної молекулярної маси можна визначити як суму відносних атомних мас атомів, які складають молекулу.

Фактично відносна молекулярна маса показує, у скільки разів молекула речовини важча за  частини маси атома
частини маси атома 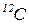 .
.
У хімічних реакціях, що відбуваються на практиці, беруть участь дуже багато молекул. Тому у реальних розрахунках незручно користуватися одночасно дуже великими кількостями молекул і дуже маленькими абсолютними масами молекул. Тому вводиться поняття кількості речовини. Кількість речовини пов’язують із певним числом частинок у певній порції речовини. Одиницею кількості речовини у СІ є моль.
Моль  – одиниця кількості речовини, що містить стільки її структурних одиниць (атомів, молекул, іонів, ін.), скільки атомів міститься в 12 г ізотопа
– одиниця кількості речовини, що містить стільки її структурних одиниць (атомів, молекул, іонів, ін.), скільки атомів міститься в 12 г ізотопа 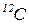 .
.
Знаючи масу одного атома карбону  , можна визначити число атомів
, можна визначити число атомів  в 0,012 кг карбону:
в 0,012 кг карбону:
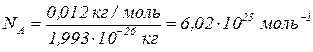

 – стала Авогадро – число структурних одиниць в одному молі будь-якої речовини.
– стала Авогадро – число структурних одиниць в одному молі будь-якої речовини.
Молярна маса  – маса 1 моль речовини, виражена в грамах; відношення маси речовини до її кількості. Чисельно дорівнює молекулярній масі і виражається в г/моль. Молярну масу можна визначити через кількість речовини
– маса 1 моль речовини, виражена в грамах; відношення маси речовини до її кількості. Чисельно дорівнює молекулярній масі і виражається в г/моль. Молярну масу можна визначити через кількість речовини
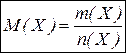
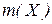 – маса речовини, г;
– маса речовини, г;
 – кількість речовини, моль.
– кількість речовини, моль.
Кількість молекул в n моль речовини  :
:

Абсолютна маса атома (молекули)  – маса атома (молекули), виражена в грамах.
– маса атома (молекули), виражена в грамах.
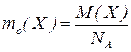
Для газоподібних речовин:
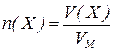
 – об’єм газу, л;
– об’єм газу, л;
 - об’єм 1 моль газу (молярний об’єм), л/моль.
- об’єм 1 моль газу (молярний об’єм), л/моль.

за нормальних умов: 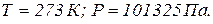
Приклади завдань.
1. Розрахуйте кількість речовини  , яка міститься в 36 г рідкоі води, кількість молекул в цієї кількості речовини, масу однієї молекули води.
, яка міститься в 36 г рідкоі води, кількість молекул в цієї кількості речовини, масу однієї молекули води.
Кількість речовини:


Кількість молекул:

Маса однієї молекули:

2. Поясніть, де міститься більше атомів: в 1 г магнію чи в 1 г вуглецю.
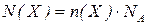





Відповідь: 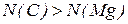
3. Скільки атомів гідрогену міститься в 10 моль бутану.


СТЕХІОМЕТРИЧНІ ЗАКОНИ ХІМІЇ
Закон збереження маси
Сума мас речовин, які вступили в реакцію, дорівнює сумі мас продуктів реакції.
Під час перебігу хімічних реакцій руйнуються зв’язки між атомами вихідних речовин, атоми перегруповуються і між ними утворюються нові зв’язки. Атоми при цьому не зникають і не виникають з нічого. Вони входять до складу продуктів реакції у таких самих кількостях, як і у вихідних речовинах.
Цей закон виконується для процесів з порівняно невеликими енергетичними ефектами. В ядерних перетвореннях ці ефекти дуже великі, а це, відповідно до співвідношення Ейнштейна  cпричиняє помітні зміни мас (дефект мас).
cпричиняє помітні зміни мас (дефект мас).
Закон сталості складу
Кожна чиста речовина, незалежно від способу її добування, має сталий якісний і кількісний склад.
Речовини складаються з атомів, сполучених між собою певних співвідношеннях відповідно до їх валентностей.
Валентність – здатність атома утворювати хімічні зв’язки з певним числом інших елементів.
За одиницю валентності прийнято валентність гідрогену.
Дальтоніди – сполуки, для яких справедливий закон сталості складу:  .
.
Бертоліди – речовини, в яких атомні співвідношення не є точно фіксованими (змінного складу):  .
.
Закон еквівалентів
Еквівалент елемента – частка атома, що припадає на одиницю валентності. Еквівалент елемента – така його кількість, яка з’єднується з 1 моль атомів 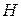 чи заміщує ту ж саму кількість атомів
чи заміщує ту ж саму кількість атомів 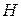 в хімічних реакціях.
в хімічних реакціях.

 - валентність елемента у сполуці.
- валентність елемента у сполуці.
Еквівалент нітрогену в 

Еквівалент нітрогену в 

Еквівалент нітрогену в 
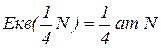
Еквівалентна маса – частина атомної маси, що припадає на одиницю валентності; чисельно дорівнює масі одного еквівалента елемента, вираженої в а.о.м.

Еквівалентна маса нітрогену в 

Еквівалентна маса нітрогену в 

Еквівалентна маса нітрогену в 

Молярна маса еквівалентів – чисельно дорівнює еквівалентній масі і виражається в г/моль.

Молярна маса еквівалентів нітрогену в 
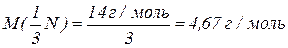
Молярна маса еквівалентів нітрогену в 


Молярна маса еквівалентів нітрогену в 

Еквівалент складних сполук.

 – фактор еквівалентності (число еквівалентності).
– фактор еквівалентності (число еквівалентності).
 для кислот – це їх основність (кількість активних атомів гідрогену).
для кислот – це їх основність (кількість активних атомів гідрогену).
 для гідроксидів – це їх кислотність (кількість груп
для гідроксидів – це їх кислотність (кількість груп  ).
).
 для солей – це добуток валентності металу на кількість атомів металу у формульній одиниці.
для солей – це добуток валентності металу на кількість атомів металу у формульній одиниці.
 для оксидів – це подвійна кількість атомів оксигену.
для оксидів – це подвійна кількість атомів оксигену.


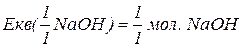
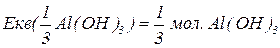




Еквівалентна маса складних сполук – відношення молекулярної маси речовини до фактору еквівалентності.

Молярна маса еквівалентів складних сполук – відношення молярної маси речовини до фактору еквівалентності. Чисельно дорівнює еквівалентній масі і виражається в г/моль.

H3PO4



В реакціях, які проходять без зміни ступенів окиснення елементів,  для однієї і тієї ж самої речовини може приймати різні значення в залежності від реакції, в яку вона вступає. Максимально можливе значення
для однієї і тієї ж самої речовини може приймати різні значення в залежності від реакції, в яку вона вступає. Максимально можливе значення  визначається за кількістю зв’язків, які сполучають основні складові частини речовини. Наприклад, для кислот
визначається за кількістю зв’язків, які сполучають основні складові частини речовини. Наприклад, для кислот  відповідає їх основності, тобто кількості атомів
відповідає їх основності, тобто кількості атомів  , зв’язаних з кислотним залишком, здатних заміщуватися на метал. Але якщо кислота не використовує в реакції всі атоми гідрогену, то її
, зв’язаних з кислотним залишком, здатних заміщуватися на метал. Але якщо кислота не використовує в реакції всі атоми гідрогену, то її  буде меншим за максимальне значення, і визначається реальною кількістю атомів гідрогену у молекулі кислоти, що заміщуються на метал, утворюючи певні продукти реакції. Наприклад, для ортофосфатної кислоти:
буде меншим за максимальне значення, і визначається реальною кількістю атомів гідрогену у молекулі кислоти, що заміщуються на метал, утворюючи певні продукти реакції. Наприклад, для ортофосфатної кислоти:









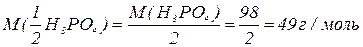





Для основ  відповідає їх кислотності, тобто кількості груп
відповідає їх кислотності, тобто кількості груп  , зв’язаних з катіонами металу, здатних заміщуватися на кислотний залишок. Але якщо основа не використовує в реакції всі групи
, зв’язаних з катіонами металу, здатних заміщуватися на кислотний залишок. Але якщо основа не використовує в реакції всі групи  , то її
, то її  буде меншим за максимальне значення, і визначається реальною кількістю груп
буде меншим за максимальне значення, і визначається реальною кількістю груп  у молекулі основи, що заміщуються на кислотний залишок, утворюючи певні продукти реакції. Наприклад, для гідроксиду алюмінію:
у молекулі основи, що заміщуються на кислотний залишок, утворюючи певні продукти реакції. Наприклад, для гідроксиду алюмінію:







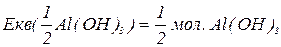




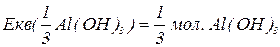

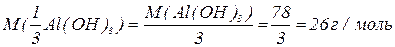
В окисно-відновних реакціях частинкою, еквівалентною атому гідрогену, є електрон, тому  дорівнює числу електронів, приєднаних або відданих частинкою в певній реакції.
дорівнює числу електронів, приєднаних або відданих частинкою в певній реакції.




Закон еквівалентів:
Маси реагуючих елементів співвідносяться між собою так само, як їх еквівалентні маси.

У разі утворення хімічних сполук на одиницю валентності одного атома припадає одиниця валентності іншого атома, а кожній одиниці валентності відповідає одиниця еквівалента елемента: на один еквівалент одного елемента в хімічних реакціях припадає один еквівалент іншого елемента.
Для визначення еквівалентних мас складних речовин можна використати те, що еквівалентна маса речовини відповідає сумі еквівалентних мас її складових частин. Наприклад, за визначенням, кислоти містять атоми гідрогену, здатні заміщуватися на атоми металу, зв'язані з кислотними залишками. Тому еквівалентну масу кислоти можна визначити, додавши еквівалентну масу гідрогену (що дорівнює 1) та еквівалентну масу кислотного залишку. Цей принцип застосовується і до розрахунку еквівалентних мас інших складних речовин (основ, солей, оксидів).
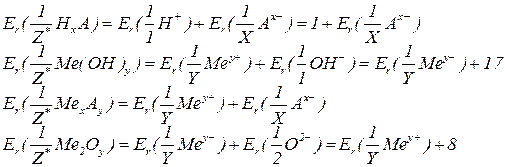
 – кислота;
– кислота;
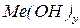 – гідроксид;
– гідроксид;
 – сіль;
– сіль;
 – оксид.
– оксид.
 - заряд кислотного залишку;
- заряд кислотного залишку;
 - заряд катіона металу;
- заряд катіона металу;
Приклади завдань.
1. 3 г металу взаємодіє з 1,64 г сірки. Розрахуйте еквівалентну масу металу. Валентність сірки дорівнює 2.




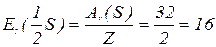

2. Розрахуйте еквівалентну масу металу, маса основи якого 1,4 г, а маса йодиду 4,15 г.




3. Визначте еквівалентну масу металу, 2,81 г якого витісняє з кислоти 560 мл водню (н.у).
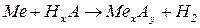
 ;
;  ;
;
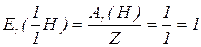 ;
;
 ;
;  ;
;


Закони ідеальних газів
Газоподібний стан характеризується слабкою взаємодією між молекулами, і тому властиві для нього закономірності залежать насамперед не від природи молекул газу, а від їх числа в одиниці об’єму та температури.
Фізичні властивості газів (на відміну від рідин та твердих речовин):
ü заповнюють весь наданий їм об’єм;
ü під дією зовнішнього тиску здатні сильно змінювати об’єм, стискатися, а під час розширення заповнювати весь наданий їм об’єм;
ü необмежено змішуються між собою з утворенням однорідної газової суміші.
Газовий стан описують за допомогою таких характеристик:
 – об’єм,
– об’єм,  ;
;
 – тиск,
– тиск, 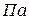 ;
;
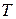 – температура,
– температура,  ;
;
 – кількість речовини газу,
– кількість речовини газу,  .
.
Закон Бойля – Маріотта
(співвідношення між тиском і об’ємом певної кількості газу за сталої температури)
За сталої температури добуток тиску на об’єм є сталою величиною.
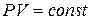
В разі підвищення тиску в певне число разів у стільки ж разів зменшується об’єм, а розширення газу завжди супроводжується зменшенням тиску. Якщо для однієї й тієї самої кількості газу змінювати тиск і вимірювати об’єм, то за сталої температури:
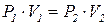
Закон Шарля
(співвідношення між тиском газу, що підвищується під час нагрівання, та його температурою за сталих об’єму і кількості газу)
Тиск газу за сталої маси та об’єму пропорційний абсолютній температурі.

 – коефіцієнт пропорційності.
– коефіцієнт пропорційності.
Закон Гей – Люссака
(залежність об’єму газу, що розширюється під час нагрівання, від температури за сталих тиску та кількості газу)
Об’єм газу за незмінних маси і тиску прямо пропорційний його абсолютній температурі.

 – коефіцієнт пропорційності.
– коефіцієнт пропорційності.
Цей закон використовується для зіставлення об’єму і температури однієї кількості газу у двох різних станах. Якщо тиск для одного й того ж самого зразка газу залишається сталим, то за різних температур сталим також буде співвідношення  :
:

Закон Менделєєва – Клапейрона
(об’єднаний закон стану ідеального газу)
Застосовується у разі, коли потрібно знайти об’єм за умов одночасної зміни температури і тиску:
Відношення добутку тиску на об’єм газу до його абсолютної температури для даної маси газу є сталою величиною.
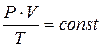
Для 1 моль газу за н.у. 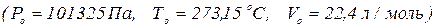
 універсальна газова стала
універсальна газова стала

Універсальній газовій сталій відповідає робота, яку виконує під час розширення один моль газу в разі його нагрівання на один градус.


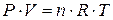

Якщо взяти певну кількість газу, то вплив одночасної зміни тиску і температури на об’єм газу можна виразити таким співвідношенням:

Закон Авогадро
В однакових об’ємах різних газів за однакових умов (температури і тиску) міститься однакова кількість молекул.
Наслідки:
ü Однаковому числу молекул різних газів за однакових умов  відповідають однакові об’єми.
відповідають однакові об’єми.
ü Однакові кількості різних газів за однакових умов займають однакові об’єми.
ü Маси однакових об’ємів різних газів за однакових умов співвідносяться між собою, як їхні молярні маси:
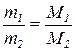
Кожна речовина характеризується густиною:  .
.
Відносна густина  – відношення густини одного газу до густини іншого за однакових умов:
– відношення густини одного газу до густини іншого за однакових умов:


В однакових об’ємах різних газів за однакових умов міститься однакова кількість молекул, а отже, і однакова кількість молів 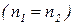 , тоді:
, тоді:

Закон Дальтона
Різні гази необмежено змішуються між собою (дифундують один в одному). За винятком зіткнень між молекулами, які є миттєвими і пружними, кожна молекула в суміші рухається незалежно від інших. Об’єм, у якому міститься газова суміш, залишається однаковим для всіх її компонентів і дорівнює об’єму наданого їй простору. Кількості газів у суміші є різними і тому різними мають бути часткові тиски, які чинять ці гази. Використовуючи рівняння стану для кожного з індивідуальних газів суміші, маємо:

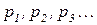 – парціальні (часткові) тиски компонентів суміші.
– парціальні (часткові) тиски компонентів суміші.
 .
.
Оскільки  то
то

Сумарний тиск газової суміші дорівнює сумі парціальних тисків компонентів цієї суміші.
Приклади завдань.
1.Густина газу за повітрям становить 2. Знайдіть його молярну масу, масу однієї молекули та відносну густину за воднем.
 ;
; 


2. Вуглеводень, густина якого за повітрям дорівнює 1,448, містить 14,29 % гідрогену. Визначте молекулярну формулу речовини.
Знайдемо молярну масу вуглеводню:



І спосіб.

Молекулярна формула вуглеводню -  .
.
ІІ спосіб.

Елементарна формула вуглеводню –  .
.


Молекулярна формула вуглеводня –  .
.
3. Розрахуйте молярну масу газу, 20 г якого займають об’єм 10000 мл за температури 200  і тиску 131кПа ( R = 8,314 Дж/К∙моль).
і тиску 131кПа ( R = 8,314 Дж/К∙моль).


4. Розрахуйте середню молярну масу повітря, в якому об’ємні частки газів такі: 21 %  , 78 %
, 78 %  , 0,5 %
, 0,5 %  та 0,5 %
та 0,5 %  .
.
Оскільки об’єми газів пропорційні їх кількостям (закон Авогадро), то середню молярну масу суміші можна виражати як через об’єми, так і через кількості речовин:

Якщо взяти 1 моль повітря, то в ньому будуть міститися такі кількості речовин кожного з газів:

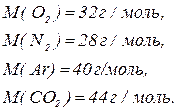
Тоді  .
.
5. Маса газової суміші об’ємом 12 л (н.у.), що складається з водню і оксиду карбону (ІV), дорівнює 18 г. Який об’єм кожного з газів у суміші?
Нехай 

Маси газів дорівнюють:


Складемо систему рівнянь:
 (об’єм суміші),
(об’єм суміші),
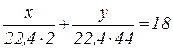 (маса суміші).
(маса суміші).
Розв’язуючи систему, знаходимо:

Отже

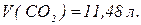
КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
Оксиди
Оксиди – сполуки елементів з оксигеном, в яких оксиген виявляє ступінь окиснення -2. За здатністю утворювати солі вони поділяються на несолетворні (  та солетворні. Останні поділяють на основні, кислотні та амфотерні.
та солетворні. Останні поділяють на основні, кислотні та амфотерні.
Назви оксидів елементів, які мають постійний ступінь окиснення, складаються з двох слів: оксид + назва елемента в родовому відмінку. Наприклад,  - оксид магнію,
- оксид магнію,  - оксид натрію. Якщо елемент утворює декілька оксидів, після назви елемента вказують його ступінь окиснення (римською цифрою в дужках). Наприклад,
- оксид натрію. Якщо елемент утворює декілька оксидів, після назви елемента вказують його ступінь окиснення (римською цифрою в дужках). Наприклад,  - оксид мангану (ІІ),
- оксид мангану (ІІ),  - оксид мангану (IV),
- оксид мангану (IV),  - оксид мангану (VII).
- оксид мангану (VII).
Основними називають оксиди, яким відповідають основи, і які утворюють солі при взаємодії з кислотами та кислотними оксидами та реагують з амфотерними оксидами та гідроксидами (за високих температур). До основних оксидів належать, наприклад,  та ін. Основними можуть бути тільки оксиди металів. Але не всі оксиди металів є основними: багато з них належать до амфотерних чи кислотних оксидів. Реагуючи з кислотами, кислотними оксидами, амфотерними оксидами та гідроксидами, основні оксиди утворюють солі:
та ін. Основними можуть бути тільки оксиди металів. Але не всі оксиди металів є основними: багато з них належать до амфотерних чи кислотних оксидів. Реагуючи з кислотами, кислотними оксидами, амфотерними оксидами та гідроксидами, основні оксиди утворюють солі:




Кислотними називають оксиди, яким відповідають кислоти, і які утворюють солі при взаємодії з основами, основними оксидами, амфотерними оксидами та гідроксидами. До кислотних оксидів належать, наприклад,  та ін. Кислотними можуть бути оксиди неметалів та оксиди металів у високих (+5 та більше) ступенях окиснення.
та ін. Кислотними можуть бути оксиди неметалів та оксиди металів у високих (+5 та більше) ступенях окиснення.




Амфотерними називають оксиди, яким відповідають амфотерні гідроксиди, і які утворюють солі при взаємодії з кислотами, основами, кислотними та основними оксидами. Амфотерні оксиди залежно від умов виявляють властивості основних і кислотних оксидів. До амфотерних оксидів належать, наприклад,  та ін. Амфотерними можуть бути тільки оксиди металів.
та ін. Амфотерними можуть бути тільки оксиди металів.

В цій реакції оксид цинку поводить себе як основний оксид. Сіль, яка утворюється, можна розглядати, як продукт заміщення гідрогену хлоридної кислоти цинком.

В цій реакції оксид стануму поводить себе як кислотний оксид: він утворює сіль, в якій станум входить до складу кислотного залишку.

В цій реакції оксид хрому(ІІІ) поводить себе як основний оксид.

В цій реакції оксид алюмінію поводить себе як кислотний оксид.
Способи добування оксидів
1. Взаємодія простих речовин з киснем (горіння). Але так можна одержати не всі оксиди:
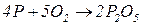


 .
.
2. Розклад основ. Деякі основи або амфотерні гідроксиди за нагрівання втрачають воду, утворюючи відповідні основні або амфотерні оксиди. Ступінь окиснення металу не повинна змінюватися.

(  - основний оксид);
- основний оксид);

(  - основний оксид);
- основний оксид);

(  - амфотерний оксид);
- амфотерний оксид);

( 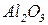 - амфотерний оксид).
- амфотерний оксид).
3. Розклад нестійких кислот. Нестійкі кисневмісні кислоти (при спробі їх добування за реакціями обміну) втрачають воду, перетворюючись на кислотні оксиди:

 .
.
4. Розклад солей, утворених кисневмісними кислотами. В результаті розкладу утворюються оксид металу (основний чи амфотерний) та кислотний оксид:
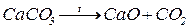
(  - основний оксид,
- основний оксид,  - кислотний оксид);
- кислотний оксид);

(  - амфотерний оксид,
- амфотерний оксид,  - кислотний оксид).
- кислотний оксид).
5. Взаємодія складних речовин з киснем (горіння):



6. Взаємодія кислот – сильних окисників (концентрованої сульфатної, розведеної або концентрованої нітратної) з деякими металами:




Кислоти
Кислотами називаються сполуки, які мають у своєму складі атоми гідрогену, які здатні заміщуватись на атоми металу, та кислотний залишок.
Кількість атомів гідрогену, здатних заміщуватись на метал з утворенням солей, визначає основність кислоти. Розрізняють кислоти одноосновні (  ), двохосновні (
), двохосновні (  ), трьохосновні (
), трьохосновні ( 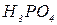 ), чотирьохосновні (
), чотирьохосновні (  ). В деяких кислотах не всі атоми гідрогену здатні заміщуватись металами. Наприклад, молекула ацетатної (оцтової) кислоти
). В деяких кислотах не всі атоми гідрогену здатні заміщуватись металами. Наприклад, молекула ацетатної (оцтової) кислоти  має чотири атоми гідрогену, але заміщуватись на метал здатен лише атом гідрогену карбоксильної групи
має чотири атоми гідрогену, але заміщуватись на метал здатен лише атом гідрогену карбоксильної групи  , тому ацетатна кислота є одноосновною.
, тому ацетатна кислота є одноосновною.
За хімічним складом розрізняють кислоти безоксигенові та оксигеновмісні. Прикладами безоксигенових кислот є фторидна (плавикова)  , хлоридна (соляна)
, хлоридна (соляна)  , бромідна
, бромідна 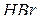 , йодидна
, йодидна  , сульфідна
, сульфідна  , ціанідна
, ціанідна  та інші кислоти. Прикладами оксигеновмісних кислот є нітратна (азотна)
та інші кислоти. Прикладами оксигеновмісних кислот є нітратна (азотна)  , нітритна (азотиста)
, нітритна (азотиста)  , сульфатна (сірчана)
, сульфатна (сірчана)  , сульфітна (сірчиста)
, сульфітна (сірчиста)  та інші. Оксигеновмісні кислоти є гідратами кислотних оксидів. Більшість кислотних оксидів утворюють оксигеновмісні кислоти шляхом безпосереднього приєднання води. Молекули деяких кислотних оксидів за різних умов можуть приєднувати різні кількості молекул води. Тоді сполуку з меншим вмістом води позначають префіксом мета-, а сполуку з більшим вмістом води – префіксом орто-. Наприклад:
та інші. Оксигеновмісні кислоти є гідратами кислотних оксидів. Більшість кислотних оксидів утворюють оксигеновмісні кислоти шляхом безпосереднього приєднання води. Молекули деяких кислотних оксидів за різних умов можуть приєднувати різні кількості молекул води. Тоді сполуку з меншим вмістом води позначають префіксом мета-, а сполуку з більшим вмістом води – префіксом орто-. Наприклад:


Назви деяких безоксигенових кислот наведені в табл. 1.
Табл.1
| Формула кислоти | Назви кислоти | Формули відповідних солей | Назви відповідних солей |

| Фтороводнева Фторидна Плавикова | 
| Фториди |

| Хлоридна Хлороводнева Соляна | 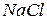
| Хлориди |

| Бромідна Бромоводнева | 
| Броміди |

| Йодидна Йодоводнева | 
| Йодиди |
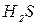
| Сульфідна Сірководнева | 

| Сульфіди Гідросульфіди |

| Селенідна Селеноводнева | 

| Селеніди Гідроселеніди |

| Телуридна Телуроводнева | 

| Телуриди Гідротелуриди |

| Ціанідна Ціановоднева | 
| Ціаніди |

| Тіоціанатна Тіоціановоднева | 
| Тіоціанати |
Назви деяких оксигеновмісних кислот наведені в табл. 2.
Табл.2
| Елемент | Кислотний оксид | Формула кислоти, що відповідає оксиду | Назви кислот | Формули відповідних солей | Назви відповідних солей |
|
| 
| 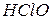
| Гіпохлоритна Хлорнуватиста | 
| Гіпохлорити |

| 
| Перхлоратна Хлорна | 
| Перхлорати | |
|
| 
| 
| Сульфітна Сірчиста | 

| Сульфіти Гідросульфіти |

| 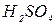
| Сульфатна Сірчана | 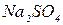

| Сульфати Гідросульфати | |
|
| 
| 
| Нітритна Азотиста | 
| Нітрити |

| 
| Нітратна Азотна | 
| Нітрати | |
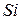
| 
| 
| Силікатна Кремнієва | 
| Силікати |
Продовження табл.2.
|
| 
| 
| Карбонатна Вугільна | 
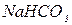
| Карбонати Гідрокарбонати | |
| - | 
| Ацетатна Оцтова | 
| Ацетати | ||
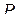
| 
| 

| Метафосфатна Метафосфорна Ортофосфатна Ортофосфорна | 



| Метафосфати Ортофосфати (фосфати) Гідроорто-фосфати (гідрофосфати) Дигідроорто-фосфати (дигідро-фосфати) | |

| 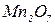
| 
| Перманганатна Манганова | 
| Перманганати | |

| 
| 

| Хроматна Хромова Дихроматна Дихромова | 

| Хромати Дихромати | |
Кислоти також можна розділити за їхньою здатністю до дисоціації у водних розчинах на слабкі (наприклад  ,
,  ,
,  , які дисоціюють частково та оборотно) та сильні (
, які дисоціюють частково та оборотно) та сильні ( 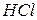 ,
,  ,
,  ,
,  ,
,  ,
, 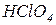 ,
,  тощо), які дисоціюють практично повністю та необоротно. Це необхідно враховувати під час визначення можливості здійснення реакції між кислотами та солями. Такі реакції на практиці можна здійснити, якщо дією сильної кислоти на сіль може утворитися слабка (або нестійка) кислота.
тощо), які дисоціюють практично повністю та необоротно. Це необхідно враховувати під час визначення можливості здійснення реакції між кислотами та солями. Такі реакції на практиці можна здійснити, якщо дією сильної кислоти на сіль може утворитися слабка (або нестійка) кислота.
Кислоти реагують:
а. з основами з утворенням солей:

Якщо кислота багатоосновна, в реакціях з основами можуть утворюватись декілька солей в залежності від молярних співвідношень кислоти та основи. Наприклад, в реакції між сульфатною кислотою та гідроксидом натрію з молярним співвідношенням 1:1 утворюється кисла сіль (продукт неповного заміщення гідрогену кислоти на катіони металу):

Якщо це співвіднонення становитиме 1:2 (надлишок основи) утворюється середня сіль як продукт повного заміщення гідрогену кислоти катіонами металу:

б. з основними оксидами з утворенням солей:

в. з амфотерними гідроксидами з утворенням солей:

г. з амфотерними оксидами з утворенням солей (іноді за нагрівання):

д. з солями, якщо в результаті реакції обміну утворюється малорозчинна сіль:

малорозчинна кислота:

нестійка кислота:

слабка кислота:
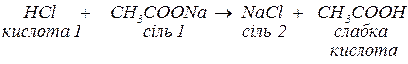
Способи добування кислот
1. Взаємодія кислотних оксидів з водою. Більшість кислотних оксидів безпосередньо реагують з водою з утворенням оксигеновмісних кислот.



2. Реакціями обміну між солями слабких кислот та сильними кислотами добувають відповідні слабкі кислоти:


3. Реакціями обміну, в результаті яких утворюється нерозчинні солі:


4. Взаємодією неметалів з воднем можна добути деякі сполуки, водні розчини яких є безоксигеновими кислотами:
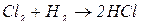

Основи
Основами називають сполуки, які складаються з катіона металу та гідроксогруп  . Необхідно зазначити, що
. Необхідно зазначити, що  - це гідроксид-аніон, заряд якого дорівнює -1. Число гідроксид-аніонів в формулі основи дорівнює ступеню окислення металу.
- це гідроксид-аніон, заряд якого дорівнює -1. Число гідроксид-аніонів в формулі основи дорівнює ступеню окислення металу.
Назва основи складається зі слів гідроксид + назва металу в родовому відмінку. Якщо метал виявляє змінну валентність, її вказують римською цифрою в дужках після назви металу. Наприклад, 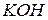 - гідроксид калію;
- гідроксид калію;  - гідроксид феруму (ІІ);
- гідроксид феруму (ІІ);  - гідроксид ванадію (ІІІ).
- гідроксид ванадію (ІІІ).
Число гідроксигруп  , зв’язаних з катіоном металу, визначає кислотність основи. Наприклад,
, зв’язаних з катіоном металу, визначає кислотність основи. Наприклад,  - однокислотні основи;
- однокислотні основи; 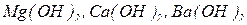 - двокислотні;
- двокислотні;  - трикислотні.
- трикислотні.
Основи можна розділити за їхньою здатністю до дисоціації у водних розчинах на слабкі (наприклад  ,
,  ,
,  , які дисоціюють частково та оборотно) та сильні (
, які дисоціюють частково та оборотно) та сильні (  ,
, 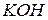 ,
,  тощо), які дисоціюють практично повністю та необоротно. Сильні основи часто також називають лугами.
тощо), які дисоціюють практично повністю та необоротно. Сильні основи часто також називають лугами.
Основи реагують:
а. з кислотами з утворенням солей та води:

Якщо основа багатокислотна, в реакціях з кислотами можуть утворюватись декілька солей в залежності від молярних співвідношень основи та кислоти. Наприклад, в реакції між гідроксидом магнію та хлоридною кислотою з молярним співвідношенням 1:1 утворюється основна сіль (продукт неповного заміщення гідроксигруп основи на кислотні залишки):

Якщо це співвіднонення становитиме 1:2 (надлишок кислоти) утворюється середня сіль як продукт повного заміщення гідроксигруп основи кислотними залишками:

б. з кислотними оксидами з утворенням солей тих кислот, яким відповідають ці кислотні оксиди:
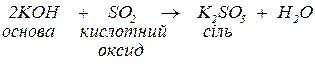
Кислотному оксиду  відповідає кислота
відповідає кислота  , тому в цій реакції утворюється її сіль
, тому в цій реакції утворюється її сіль  .
.
в. з амфотерними гідроксидами:
Якщо ця реакція проходить у водному розчині, утворюється комплексна сіль.

Якщо ця реакція проходить за високої температури, утворюється сіль.

г. з амфотерними оксидами з утворенням солей (за високої температури):

д. з солями, якщо в результаті реакції обміну утворюється нерозчинний у воді гідроксид або нерозчинна сіль:


Способи добування основ
1. Якщо основа малорозчинна, то для добування застосовують реакцію обміну між сіллю металу (у розчині), що повинен дати відповідну основу, та розчином лугу чи аміаку. При цьому в осад повинна випадати тільки основа, яку необхідно добути. Решта учасників реакції повинні бути добре розчинними. Наприклад, для добування нерозчинного гідроксиду магнію до розчину солі магнію потрібно додати розчин лугу:


2. Реакції основних оксидів з водою:

Амфотерні гідроксиди
Гідроксидами називають сполуки, які складаються з катіона металу та гідроксогруп  . Амфотерні гідроксиди – це гідроксиди, які виявляють основні та кислотні властивості залежно від умов, тобто від природи другого компонента, який бере участь у кислотно-основній взаємодії.
. Амфотерні гідроксиди – це гідроксиди, які виявляють основні та кислотні властивості залежно від умов, тобто від природи другого компонента, який бере участь у кислотно-основній взаємодії.
До амфотерних гідроксидів належать гідроксиди деяких металів головних підгруп (берилію, алюмінію), а також багатьох металів побічних підгруп періодичної системи елементів у проміжних ступенях окислення:  та інші.
та інші.
Назва гідроксиду складається зі слів гідроксид + назва металу в родовому відмінку. Якщо метал виявляє змінну валентність, її вказують римською цифрою в дужках після назви металу. Наприклад,  - гідроксид цинку;
- гідроксид цинку;  - гідроксид купруму (ІІ);
- гідроксид купруму (ІІ); 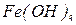 - гідроксид феруму (ІІІ).
- гідроксид феруму (ІІІ).
Амфотерні гідроксиди реагують:
а. з кислотами, утворюючи солі (основні та середні):



В цих реакціях амфотерні гідроксиди виявляють основні властивості.
б. з кислотними оксидами, утворюючи солі:

В цих реакціях амфотерні гідроксиди виявляють основні властивості.
в. з основами:
Якщо ця реакція проходить у водному розчині, утворюється комплексна сіль.

Якщо ця реакція проходить за високої температури, утворюється сіль.
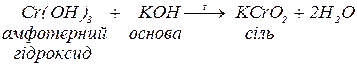
В цих реакціях амфотерні гідроксиди виявляють кислотні властивості.
г. з основними оксидами з утворенням солей:

В цих реакціях амфотерні гідроксиди виявляють кислотні властивості.
Дата добавления: 2019-02-13; просмотров: 85; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!




