Генетичний зв’язок між основними класами неорганічних сполук

Приклади завдань.
1. Усіма можливими способами добудьте оксид магнію, охарактеризуйте його хімічні властивості. Наведіть рівняння відповідних хімічних реакцій.
Добування  :
:
 ;
;
 ;
;
 .
.
Хімічні властивості:
 - основний оксид, реагує з
- основний оксид, реагує з
1. водою з утворенням основного гідроксиду:
 ;
;
2. кислотами з утворенням солей:
 ;
;
3. кислотними оксидами з утворенням солей:
 ;
;
4. амфотерними оксидами з утворенням солей:
 ;
;
5. амфотерними гідроксидами з утворенням солей:
 .
.
2. Усіма можливими способами добудьте ортофосфатну кислоту, охарактеризуйте її хімічні властивості. Наведіть рівняння відповідних хімічних реакцій.
Добування  :
:
 ;
;
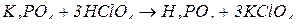 .
.
Хімічні властивості:
 реагує з
реагує з
1. основами з утворенням двох кислих та середньої солей:
 ;
;
 ;
;
 .
.
2. основними оксидами з утворенням солей:
 .
.
3. амфотерними гідроксидами з утворенням солей:
 .
.
4. амфотерними оксидами з утворенням солей:
 ;
;
5. солями з утворенням нестійкої кислоти:

6. солями з утворенням слабкішої кислоти:

3. Усіма можливими способами добудьте гідроксид цинку, охарактеризуйте його хімічні властивості. Наведіть рівняння відповідних хімічних реакцій.
Добування  :
:
 ;
;
 .
.
Хімічні властивості:
 - амфотерний гідроксид, реагує з
- амфотерний гідроксид, реагує з
1. кислотами, утворюючи солі (основну та середню):


В цих реакціях  виявляє основні властивості.
виявляє основні властивості.
2. кислотними оксидами з утворенням солей:
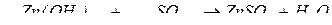
В цій реакції  виявляє основні властивості.
виявляє основні властивості.
3. основами (у розчині) з утворенням комплексної солі:

Якщо ця реакція проходить за високої температури, утворюється сіль.

В цих реакціях  виявляє кислотні властивості.
виявляє кислотні властивості.
4. з основними оксидами з утворенням солей:
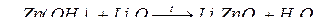
В цих реакціях амфотерні гідроксиди виявляють кислотні властивості.
4. Усіма можливими способами добудьте оксид карбону (ІV), охарактеризуйте його хімічні властивості. Наведіть рівняння відповідних хімічних реакцій.
Добування  :
:
 ;
;
 ,
,
 ,
,
 .
.
Хімічні властивості:
 - кислотний оксид, реагує з
- кислотний оксид, реагує з
1. основами з утворенням солей:

2. основними оксидами з утворенням солей:

3. амфотерними оксидами з утворенням солей:

БУДОВА АТОМІВ ХІМІЧНИХ ЕЛЕМЕНТІВ.
У 1879 р. Крукс відкрив катодні промені (ідентифіковані як поток електронів).
У 1886 р. Гольдштейн відкрив каналові промені (ідентифіковані як поток іонів з позитивним зарядом, кратним заряду електрона).

До двох електродів, впаяних в скляну трубку з розрідженим газом, прикладають високу напругу (до 10000 В). Це спричинює руйнування молекул газу, що супроводжується утворенням електронів та позитивно заряджених іонів, а також виникненням світного розряду.
Електрони прямують до анода і утворюють катодні промені, а позитивно заряджені іони – до катода і утворюють каналові промені. Дослідження каналових променів показало, що вони складаються з важких заряджених частинок, подібних за масою до вихідних атомів, а їх природа залежить від природи газу. Катодні промені однакові для всіх газів.
У 1895 р. Рентген відкрив Х-промені (рентгенівські промені), які виявилися електромагнітним випромінюванням з дуже короткою довжиною хвилі –  м.
м.
Ці відкриття підтверджували, що атоми містять позитивно і негативно заряджені частинки, зв’язані між собою особливими внутрішньоатомними силами.
У 1897 р. Томсон відкрив електрон і за відхиленням пучка катодних променів у електричному та магнітному полях знайшов відношення заряду електрона до його маси. Після визначення у 1909 р. Маллікеном заряду електрона було обчислено масу спокою електрона  , що становить
, що становить  маси атома найлегшого елемента – гідрогену.
маси атома найлегшого елемента – гідрогену.

У 1896 р. Бекерель відкрив явище природного радіоактивного розпаду і розділив випромінювання, яке супроводжувало цей процес, на три складові:
ü  відхилялися до негативно зарядженого полюса зовнішнього електричного поля, мали невелику проникну здатність (ядра атомів гелію
відхилялися до негативно зарядженого полюса зовнішнього електричного поля, мали невелику проникну здатність (ядра атомів гелію  );
);
ü  відхилялися до позитивно зарядженого полюса зовнішнього електричного поля (потік електронів з високою енергією);
відхилялися до позитивно зарядженого полюса зовнішнього електричного поля (потік електронів з високою енергією);
ü  були ідентифіковані як короткохвильове електромагнітне випромінювання.
були ідентифіковані як короткохвильове електромагнітне випромінювання.
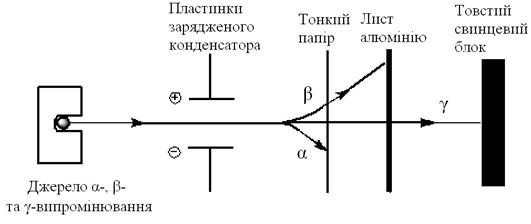
Рис.1 Проникна здатність  випромінювання
випромінювання
У 1903 році Томсон запропонував кавуноподібну модель будови атома:
атом – згусток позитивно зарядженої матерії, в яку вкраплено негативно заряджені електрони, що компенсують позитивний заряд.
У 1911 році Резерфорд зі співробітниками поставили досліди з „бомбардування” тонкої металевої фольги потоком  - частинок. Вони мали проникати крізь металеву фольгу завтовшки майже 1000 атомних шарів без зміни напрямку руху. Схема цього досліду зображена на рис.2. Джерело
- частинок. Вони мали проникати крізь металеву фольгу завтовшки майже 1000 атомних шарів без зміни напрямку руху. Схема цього досліду зображена на рис.2. Джерело  -випромінювання розмістили у свинцевому кубі з просвердленим у ньому каналі, так що вдалося отримати потік
-випромінювання розмістили у свинцевому кубі з просвердленим у ньому каналі, так що вдалося отримати потік  - частинок, що летять в одному напрямку. Попадаючи на екран, на який нанесено сульфід цинку,
- частинок, що летять в одному напрямку. Попадаючи на екран, на який нанесено сульфід цинку,  - частинки викликали його світіння, а в лупу можна було побачити і порахувати окремі спалахи, які виникали на екрані при попаданні на нього кожної
- частинки викликали його світіння, а в лупу можна було побачити і порахувати окремі спалахи, які виникали на екрані при попаданні на нього кожної  - частинки. Між джерелом випромінювання та екраном розміщували тонку металеву фольгу. По спалахам на екрані можна було зробити висновок про розсіювання
- частинки. Між джерелом випромінювання та екраном розміщували тонку металеву фольгу. По спалахам на екрані можна було зробити висновок про розсіювання  - частинок, тобто про їх відхилення від початкової траекторії при проходженні крізь металеву фольгу.
- частинок, тобто про їх відхилення від початкової траекторії при проходженні крізь металеву фольгу.

Рис. 2. Схема досліду по розсіюванню  - частинок
- частинок
Проведені досліди довели, що переважна більшість  - частинок безперешкодно проходить крізь фольгу, не змінюючи напрямку руху.Однак приблизно одна з 8000
- частинок безперешкодно проходить крізь фольгу, не змінюючи напрямку руху.Однак приблизно одна з 8000  - частинок змінює напрямок руху, відхиляючись від прямолінійного руху на деякий кут або навіть відкидається назад. Випадки такого відхилення
- частинок змінює напрямок руху, відхиляючись від прямолінійного руху на деякий кут або навіть відкидається назад. Випадки такого відхилення  - частинок можна було спостерігати, переміщуючи екран з лупою по дузі.
- частинок можна було спостерігати, переміщуючи екран з лупою по дузі.
За результатами цих дослідів зробили висновок, що у переважній частині простору, який займає атом металу, відсутні важкі частинки – там можуть знаходитись тільки електрони. Оскільки маса електрона майже у 7500 разів менша за масу  - частинки, то зіткнення з електроном практично не впливає на напрямок її руху. Випадки різкого відхилення і навіть відштовхування
- частинки, то зіткнення з електроном практично не впливає на напрямок її руху. Випадки різкого відхилення і навіть відштовхування  - частинок вказують на те, що в атомі є якесь важке ядро, в якому зосереджена переважна частина всієї маси атома. Ядро займає дуже маленький об’єм, тому
- частинок вказують на те, що в атомі є якесь важке ядро, в якому зосереджена переважна частина всієї маси атома. Ядро займає дуже маленький об’єм, тому  - частинки так рідко з ним зіштовхуються, і повинно мати позитивний заряд, який і викликає відштовхування однойменно заряджених
- частинки так рідко з ним зіштовхуються, і повинно мати позитивний заряд, який і викликає відштовхування однойменно заряджених  - частинок.
- частинок.
На основі дослідів Резерфорд запропонував планетарну модель будови атома, згідно з якою атом складається з позитивно зарядженого ядра, яке розміщене в центрі атома та електронів, що рухаються навколо ядра по колових орбітах. Практично вся маса зосереджена в малому об’ємі ядра. Число електронів відповідає зарядові ядра. В цілому атом електронейтральний. Відцентрова сила, що виникає внаслідок обертання електронів, врівноважується силою електростатичного притягання електронів до протилежно зарядженого ядра. Розміри ядра дуже малі в порівнянні з розмірами атома в цілому: діаметр атома – величина порядка  см, а діаметр ядра – порядка
см, а діаметр ядра – порядка 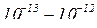 см. Чим більший заряд атомного ядра, тим сильніше буде відштовхуватись від нього
см. Чим більший заряд атомного ядра, тим сильніше буде відштовхуватись від нього  - частинка, тим частіше будуть зустрічатися випадки сильних відхилень
- частинка, тим частіше будуть зустрічатися випадки сильних відхилень  - частинок, які проходять крізь шар металу, від початкового напрямку руху. Тому досліди по розсіюванню
- частинок, які проходять крізь шар металу, від початкового напрямку руху. Тому досліди по розсіюванню  - частинок дають змогу не тільки виявити існування атомного ядра, а й визначити його заряд. З дослідів Резерфорда можна було зробити висновок, що заряд ядра (виражений в одиницях заряду електрона) чисельно дорівнює порядковому номеру елемента у періодичній системі.
- частинок дають змогу не тільки виявити існування атомного ядра, а й визначити його заряд. З дослідів Резерфорда можна було зробити висновок, що заряд ядра (виражений в одиницях заряду електрона) чисельно дорівнює порядковому номеру елемента у періодичній системі.
Поняття про спектр.
Будь-яке джерело електромагнітного випромінювання надсилає врізнобіч безліч хвиль різної довжини, які називають спектром. Це випромінювання поширюється у просторі зі швидкістю 300000 км/с та має властивості хвиль. Кількісно його характеризують довжиною хвилі 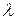 , частотою
, частотою  та амплітудою коливання. Частоту хвильового процесу визначають числом хвиль, які проходять через фіксовану точку впродовж однієї секунди. Вона залежить від довжини хвилі
та амплітудою коливання. Частоту хвильового процесу визначають числом хвиль, які проходять через фіксовану точку впродовж однієї секунди. Вона залежить від довжини хвилі 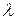 та швидкості її поширення
та швидкості її поширення  :
:
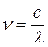
1900 р. М. Планк вивчав спектр світла, який випромінювали нагріті тіла. Він виявив найменшу порцію, яку можна виділити в одному акті випромінювання – квант енергії (або фотон). Енергія кванта прямо пропорційна частоті випромінювання:

 - cтала Планка.
- cтала Планка.

Під час проходження крізь призму сонячні промені заломлюються, розкладаються (дисперсія світла), і на екрані, поставленому за призмою, утворюється суцільний спектр, видима частина якого є кольоровою смугою кольорів веселки. Потрапивши на фотографічну пластину, світло її "засвічує" і спричинює затемнення.

Рис.3
Випромінювання розжарених твердих тіл та розігрітих рідин завжди дає суцільний спектр, оскільки складається з електромагнітних хвиль найрізноманітніших частот. Випромінювання розжарених газів та пари складається з хвиль тільки певної довжини, тому замість суцільної смуги на екрані з’являється низка окремих кольорових ліній, розділених темними проміжками. Число та розміщення цих ліній залежать від природи розжареного газу. Такі спектри – лінійчасті.
Спектр атомарного водню.
Атоми гідрогену при збудженні електричним розрядом випромінюють спектр, у якому виявлено лінії в різних ділянках:
ü серія Лаймана (УФ-ділянка);
ü серія Бальмера (видима ділянка);
ü серія Пашена (ІЧ-ділянка);
ü серія Бреккета (ІЧ-ділянка);
ü серія Пфунда (ІЧ-ділянка);
ü серія Хампфрі (ІЧ-ділянка).
Бальмер припустив, що частоти спектральних ліній серії пропорційні одному цілому числу, яке змінюється. Положення ліній у спектрі описується рівнянням Рідберга:

 - число, обернене довжині хвилі спектральної лінії в спектрі, має одиницю вимірювання
- число, обернене довжині хвилі спектральної лінії в спектрі, має одиницю вимірювання  і показує, скільки довжин хвиль вміщується на 1 см;
і показує, скільки довжин хвиль вміщується на 1 см;
 – стала Рідберга, для атома гідрогену
– стала Рідберга, для атома гідрогену 
 – невеликі цілі числа, завжди
– невеликі цілі числа, завжди 
Табл. 5
| Серія спектральних ліній | Довжина хвилі 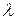 , нм , нм
| Хвильове число | 
| 
| |
| Лаймана (УФ) | 93,8 95,0 97,3 102,6 121,6 | 106 600 105 300 102 800 97 480 82 260 | 6 5 4 3 2 | 1 1 1 1 1 | |
| Бальмера (видима) | 397,0 410,2 434,0 486,1 656,3 | 25 190 24 380 23 040 20 570 15 240 | 7 6 5 4 3 | 2 2 2 2 2 | |
| Пашена (ІЧ) | 954,6 1005,0 1093,8 1281,8 1875,1 | 10 470 9 950 9 142 7 801 5 333 | 8 7 6 5 4 | 3 3 3 3 3 | |
| Бреккета (ІЧ) | 2630,0 4050,0 | 3 800 2 470 | 6 5 | 4 4 | |
| Пфунда (ІЧ) | 7400,0 | 1 350 | 6 | 5 | |
Постулати Бора.
Згідно з найпростішою моделлю, запропонованою Бором, електрон в атомі гідрогену поглинає або випромінює енергію тільки цілими квантами.
Електрон, який розглядають як матеріальну частинку, рухається навколо ядра по замкненій коловій орбіті. Для того, щоб орбіта була сталою, повинна виконуватись умова: відцентрова сила, обумовлена рухом електрона, повинна бути рівною силі притягання між електроном і ядром.

Рис 4
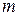 – маса спокою електрона;
– маса спокою електрона;
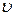 – швидкість руху електрона;
– швидкість руху електрона;
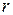 – радіус орбіти;
– радіус орбіти;
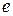 – заряд електрона.
– заряд електрона.


Рівняння сталості орбіт:

Енергія електрона, який рухається по одній з борівських орбіт:

 – кінетична енергія;
– кінетична енергія;
 – потенційна енергія.
– потенційна енергія.

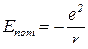

Виходячи з умов сталості орбіт


Бор намагався пояснити поведінку атомів в межах простої динамічної моделі. Ця модель пояснювала спектр атома гідрогену у відсутності магнітного поля. У магнітному полі спектр атома гідрогену ускладнюється (ефект Зеємана). Зоммерфельд припустив, що електрон може рухатись не тільки по коловим, але і по еліптичним орбітам.
Перший постулат Бора.
Електрон в атомі може обертатися лише по тих орбітах, на яких коловий момент руху  є цілим числом, кратним сталій Планка, поділеній на
є цілим числом, кратним сталій Планка, поділеній на  :
:

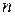 – 1, 2, 3,…,∞
– 1, 2, 3,…,∞
Такі орбіти – стаціонарні. Під час руху електрона по стаціонарній орбіті він не випромінює електромагнітної енергії.
 підставимо в рівняння сталості орбіт:
підставимо в рівняння сталості орбіт:

Тоді радіус електронних орбіт в атомі гідрогену:


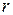 виражається в Ả (1 Ả =
виражається в Ả (1 Ả = 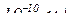 .
.
Енергія орбіти

 .
.
 – основний стан;
– основний стан;
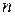 > 1 – збуджений стан.
> 1 – збуджений стан.
У разі поглинання енергії атомом маленькими порціями (квантами) відбувається стрибкоподібне переміщення електрона по стаціонарних орбітах від ядра атома. Зворотній перебіг супроводжується виділенням енергії.
Умови переміщення електрона з одного квантового рівня на інший визначає другий постулат Бора:
Під час стрибкоподібного переходу електрона з більш віддаленого квантового рівня на ближчу до ядра орбіту атом випромінює квант енергії з певною частотою коливань 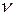 :
:

Дата добавления: 2019-02-13; просмотров: 80; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

