Токсикологическая характеристика
ОВ нервно-паралитического действия способны воздействовать на организм человека в любом боевом состоянии: парообразном, аэрозольном, капельно-жидком, поступая ингаляционным путем, через кожу, желудочно-кишечный тракт, через раны и т.д. Основные пути поступления в организм в боевой обстановке - ингаляционный и через кожу (перкутанный).
| Токсичность ОВ | Ингаляционно LC50 мг*мин/л | Через кожу LD50 мг/кг |
| Зарин | 0,1 | 25 |
| Зоман | 0,03 | 1,0 |
| Vх | 0,01 | 0,1 |
Механизм токсического действия и патогенез интоксикации
Механизм действия ОВ НПД двояк:
1. Нарушение функционирования холинергических нервных синапсов.
2. Эффекты, не связанные с нарушением синаптической передачи.
В связи с этим, в механизме действия ОВ НПД различают:
А. Синаптические действия, связанные с воздействием ФОС на ацетилхолинэстеразу (антихолинэстеразное действие (теория) и на холинорецептор - неантихолинэстеразное действие (теория).
В. Внесинаптическое действие, связанное с эффектами, развивающимися вне синапсов.
Итак, синаптическое действие.
Антихолинэстеразная теория
По современным представлениям о строении и функции холинэргических синапсов, химическая передача нервного импульса в холинергическом синапсе распадается на четыре этапа: первые два - синтез медиатора и его освобождение из нервного окончания - пресинаптические, вторые два этапа - взаимодействие с постсинаптическими рецепторами и освобождение синапса от медиатора - постсинаптические.
|
|
|
Процесс медиации начинается с поступления холина в нервные окончания и в другие части нейрона. Вторым компонентом синтеза ацетилхолина является уксусная кислота, образующаяся в митохондриях в виде ацетил-КоА. Перенос ацетила с коэнзима на холин катализируется холинацетилэстеразой. Синтезированный ацетилхолин накапливается в синаптических везикулах. Каждый нервный импульс, приходящий из нервного волокна, подталкивает везикулы по направлению к синаптической мембране. Одновременно этот же импульс вызывает в мембране изменения, которые ведут к увеличению вероятности высвобождения ацетилхолина из везикул.
Выделившийся из нервного окончания ацетилхолин попадает в синаптическую щель и взаимодействует с рецепторными структурами постсинаптической мембраны. Ее проницаемость при этом для ионов Nа и К, определяющих в основном величину потенциала покоя, увеличивается.
Увеличение проницаемости приводит к перераспределению ионов, что сопровождается изменением разности потенциалов между внутренней и наружной поверхностями мембраны (деполяризация). Как следствие этого возникает возбуждение (или торможение) иннервируемой клетки.
|
|
|
Восстановление нарушенного соотношения концентраций ионов по обе стороны мембраны достигается при помощи “натрий - калиевого насоса”. При этом наблюдается активный транспорт ионов против электрохимических градиентов.
Прекращение действия ацетилхолина, выделившегося в синаптическую щель, происходит главным образом при помощи энзима ацетилхолинэстеразы, гидролизующего ацетилхолин на физиологически малоактивные холин и уксусную кислоту.
Механизм взаимодействия ацетилхолина с холинэстеразой изучен достаточно подробно. Известно, что в состав молекулы ацетилхолина входят реакционно-способные атомы, которые образуют две группы :катионную (четвертичный атом азота с тремя метильными радикалами) и сложноэфирную (эфирный кислород и карбонильные углерод и кислород).
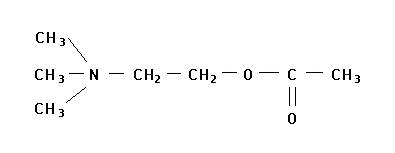 |
Катионная группа несет положительный заряд. Сложно-эфирная группа - поляризована. Вследствие смещения электронных пар кислород становится более электроотрицательным, а углерод - электроотрицательным (электрофильным):
|
|
|
Соответственно реакционным группам ацетилхолина в активных центрах холинэстеразы выделяют два участка: анионный и эстеразный. Предполагается, что анионный участок образован карбоксилат-анионом двухосновной аминокислоты. На расстоянии 4-5 А (0,4-0,5 нм) от анионного центра расположен эстеразный участок, в котором важную роль играет гидроксил серина.
Взаимодействие ацетилхолина с холинэстеразой начинается с сорбции катионной “головки” ацетилхолина на определенном расстоянии от эстеразного пункта. Ферментный гидролиз ацетилхолина протекает на эстеразном пункте.
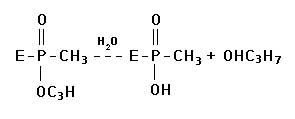
Реакция гидролиза сложных эфиров относится к реакциям нуклеофильного замещения. Для ее осуществления гидроксильная группа серина должна провести нуклеофильную атаку на соответствующий электрофильный атом субстрата, что возможно только в случае существования на кислороде гидроксильного радикала избыточного отрицательного заряда. При этом рвутся связи О = С - О в ацетилхолине и О-Н в гидроксиле серина и возникает новая ковалентная связь:
О = С - О - серин.
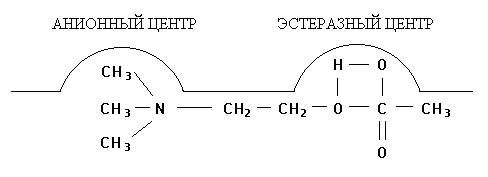
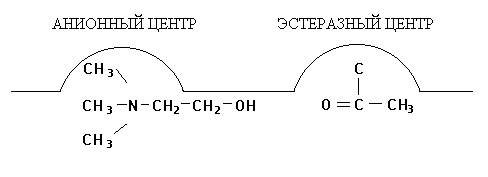
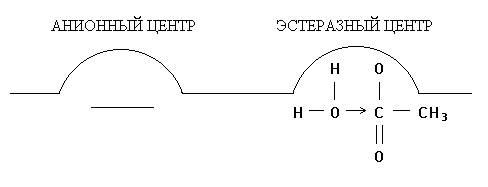
В результате реакции образуются ацетилированный по серину фермент и холин, сорбированный на анионном участке. В последующем холин десорбируется с анионного участка фермента, происходит также деацетилирование холинэстеразы и восстановление ее первоначальной структуры. Последовательность этих реакций представлена на рис. 1 (А, Б, В, Г):
|
|
|
А
Б
В
Г
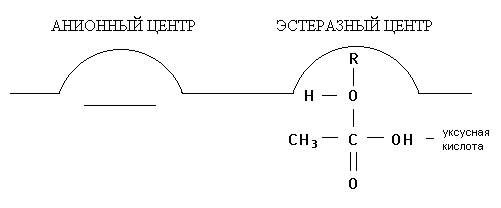
Рис. 1. Взаимодействие ацетилхолина с холинэстеразой
Структура ФОС позволяет им при взаимодействии с холинэстеразой имитировать реакционную способность ацетилхолина. Некоторые из ФОС (зарин, ДДВФ и др.) имитируют только эфирную часть молекулы медиатора. В молекулах этих веществ имеется группировка Р - О, которая тоже поляризована, как и карбонильная группа С - О ацетилхолина.
Таким образом, можно представить, что взаимодействие таких ФОС с эстеразным участком фермента приводит к фосфорилированию серинового гидроксила холинэстеразы, по-видимому, по тому же механизму, по которому происходит его ацетилирование ацетилхолином. Взаимодействие зарина с активным центром холинэстеразы показано на рис. 2:
Рис. 2. Взаимодействие зарина с холинэстеразой
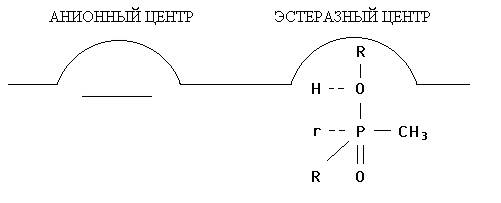
А
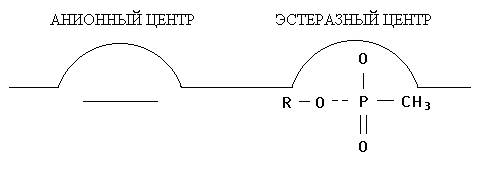
Б
Другие ФОС (фосфорилхолины) могут имитировать как эфирную, так и катионную часть ацетилхолина. Это может быть проиллюстрировано схемой (рис. 3), на которой показано взаимодействие метилфторфосфорилхолина (1) и тиохолинового производного метилфосфоновой кислоты (2) с холинэстеразой. При этом с эстеразным центром реагирует фосфорсодержащая часть яда, а катионная головка взаимодействует с анионным центром фермента.
При образовании сорбционного фермент-ингибитор комплекса большую роль играет ион-ионное взаимодействие заряженной группы ингибитора с анионным центром холинэстеразы, подобно тому, как это взаимодействие имеет значение в реакции холинэстеразы с ацетилхолином или другим заряженным субстратом.
Принципиальное различие в действии ФОС и ацетилхолина состоит в том, что обратная реакция - дефосфорилирование - протекает исключительно медленно. В результате происходит “необратимое” ингибирование фермента.
Степень обратимости зависит от того, происходят или не происходят какие-либо изменения с ингибитором на ферменте.
Если ингибитор взаимодействует с холинэстеразой целой молекулой и при реакции его молекула не распадается, то после выхода из реакции, ингибитор полностью восстанавливает свою активность. Реакция обратима и может протекать в обе стороны. Взаимодействие таких ингибиторов (И) с ферментом (Ф) происходит в одну стадию: И + Ф = ИФ.
Рис. 3. Взаимодействие фосфорилхолинов с холинэстеразой
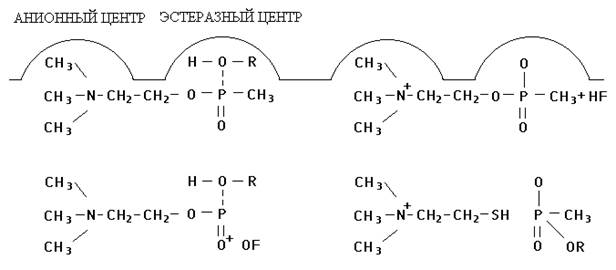 |
Первичный комплекс ИФ образуется за счет слабого ионного и электростатического взаимодействия, а потому все обратимые ингибиторы являются к тому же короткодействующими.
Если вещество реагирует с холинэстеразой в две стадии:
И + Ф = ИФ - И Ф, то во вторую стадию за счет превращения ингибитора на ферменте образуется новый комплекс И- Ф, с установлением ковалентной связи между ферментом и фосфорным остатком ингибитора. Такие вещества являются необратимыми, поскольку после выхода из реакции они неактивны. Разница между обратимыми и необратимыми ингибиторами выявляется при способности ацетилхолина не только предупреждать, но и устранять ингибирование холинэстеразы конкурентными обратимыми препаратами в любой срок существования их комплекса с ферментами, в то время как торможение холинэстеразы обратимыми конкурентными ингибиторами предупреждается ацетилхолином, но устраняется лишь в первую стадию их взаимодействия.
Длительность действия антихолинэстеразных веществ определяется скоростью восстановления активности холинэстеразы, скоростью распада комплекса ИФ или И - Ф. Постепенная утрата фермент-ингибиторным комплексом способности к диссоциации определяется как “старение” холинэстеразы. В основе механизмов старения лежит постепенное изменение конформации белковой структуры фосфорилированной холинэстеразы, сопровождающееся деалкилированием остатка ФОС на ферменте:
 |
В опытах, в которых использовались ФОС с радиоактивной меткой, было показано, что скорость старения холинэстеразы совпадает со скоростью деалкилирования фосфорорганического остатка ингибитора на ферменте. Время полного старения фосфорилированной холинэстеразы колеблется от минут до нескольких суток и зависит от строения фосфорильного остатка на ферменте и свойств холинэстеразы. Вместе с этим необходимо учитывать возможность связывания ФОС не только с активными центрами холинэстеразы, но и с аллостерическими, локализованными вне активной поверхности.
С антихолинэстеразной теорией согласуются факты, свидетельствующие о существовании параллелизма между степенью угнетения холинэстеразы и токсичностью; степенью угнетения холинэстеразы различных органов и выраженностью соответствующих эффектов. Установленная в опытах in vitro и in vivo способность обратимых ингибиторов холинэстеразы (прозерина и эзерина) защищать холинэстеразу от последующего угнетения ФОС и предупреждать действие этих ядов на некоторые органы, также подтверждает, что ФОС и обратимые ингибиторы холинэстеразы конкурируют за одни и те же активные центры фермента. Наконец, способность реактиваторов холинэстеразы восстанавливать активность угнетенного ФОС фермента и ослаблять выраженность токсического процесса может быть объяснена с позиции антихолинэстеразной теории действия ФОС.
В лабораторной практике при определении холинэстеразной активности крови для диагностики отравления ФОС, а также при индикации для обнаружения ядов в воде и пищевых продуктах используются различные методы определения активности холинэстеразы. По угнетению активности ацетилхолинэстеразы можно судить о степени тяжести поражения:
| % активности АХЭ | Степень поражения |
| 50% 25-50% 10-25% 10% и менее | Стертая Легкая Средняя Тяжелая |
Неантихолинэстеразная теория
ОВ НПД напрямую взаимодействует с холинорецептором. Взаимодействие АХ с ХР приводит к изменению конформации последнего, что и способствует открытию ионных канальцев, перераспределению ионов натрия и калия, деполяризации постсинаптической мембраны, генерированию и проведению нервного импульса по постсинаптическому волокну. Считается, что строение ХР сходно со строением АХЭ. Следовательно, механизмы воздействия ОВ НПД на ХР и АХЭ также сходны. Поскольку фосфорилхолины взаимодействуют с ХР по двум активным центрам (анионному и эстератическому), то это вызывает изменение конформации ХР и открытию ионных канальцев, т.е. образованию нервного импульса, как это происходит при взаимодействии ХР АХ.
Зарин взаимодействует с ХР только по эстератическому центру и при этом канальцы не открываются, следовательно, нервный импульс не генерируется. Таким образом, при воздействии на синапс фосфорилхолинов происходит следующее: в начальном периоде воздействия избыток АХ способствует сохранению АХЭ от необратимого угнетения, хотя часть ее сразу инактивируется Vх с потерей ею способности разрушать АХ. ХР оказываются под двойным воздействием: часть из них занята АХ, часть - фосфорилхолинами. Воздействие этих агентов открывает ионные канальцы, что приводит к генерации нервного импульса. Это усугубляется тем, что инактивированная АХЭ не снимает с ХР АХ. Впрочем, если это происходит, то освободившийся от АХ ХР занимается Vх, что усугубляет эффект.
Роль зарина несколько иная: часть его блокирует свободную от АХ АХЭ и выключает ее из активного функционирования, часть - занимает свободные ХР, что, впрочем, не приводит к генерации нервного импульса. Таким образом, воздействие на синапс зарина оказывает менее выраженный эффект, чем такое же влияние фосфорилхолинов.
В процессе воздействия ОВ НПД на ХР развивается четыре явления:
1. Эти вещества оказывают холиномиметическое действие, т.е. возбуждающе действуют на ХР. Впрочем, это относится лишь к тем веществам, которые взаимодействуют с ХР по двум его активным центрам.
2. Облегчающее действие, которое заключается в усиленном освобождении АХ из пресинаптической мембраны и более активном его взаимодействием с ХР.
3. Сенсибилизирующее действие - повышение чувствительности ХР к АХ и ОВ НПД.
4. В терминальных стадиях поражения ОВ НПД оказывают холинолитический эффект.
К внесинаптическому действию относятся следующие явления:
1. Эти вещества ингибируют ложные эстеразы (сыворотки крови, эритроцитов, печени).
2. Они блокируют протеолитические ферменты.
3. Они угнетают активность АТФ, в первую очередь ЦНС.
4. Эти вещества повышают проницаемость мембран, активируя перекисное окисление липидов.
5. Они оказывают иммунодепрессивное действие, что приводит на вторые, третьи сутки к присоединению инфекционных осложнений органов дыхания.
6. При хронических интоксикациях они оказывают эмбриотоксическое и тератогенное действие за счет нарушения структуры ДНК.
Однако первый и второй эффекты можно рассматривать как положительное действие, снижающее общее количество попавшего в организм вещества, которое может оказать влияние на синапс. Таким образом, основное действие БТХВ НТД - это изменение активности нервной системы.
Патогенез поражения
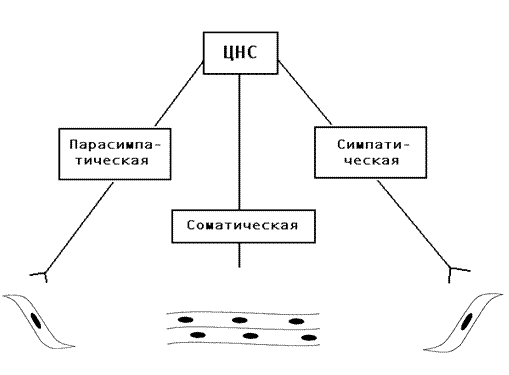 Для того чтобы представить развитие симптомов поражения, их причины, необходимо знать локализацию холинэргических систем в организме, локализацию синапсов, медиатором в которых является ацетилхолин (АХ).
Для того чтобы представить развитие симптомов поражения, их причины, необходимо знать локализацию холинэргических систем в организме, локализацию синапсов, медиатором в которых является ацетилхолин (АХ).
Рис. 4. Поскольку рецепторы холинергической нервной системы неоднородны, то различают М- и Н-холинорецепторы, рисунок требует дополнения.
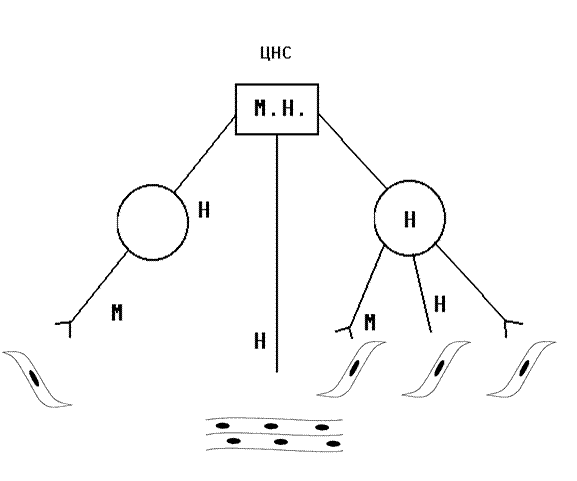
Рис. 5. Ведущим звеном патогенеза являются нарушения функции ЦНС, гипоксия и расстройства кровообращения, которые взаимосвязаны и определяют цепной механизм развития патологического процесса. Непосредственной причиной смерти пораженных чаще всего является паралич дыхания. Он может развиться в результате действия ОВ НПД или в результате курареподобного действия яда (периферический паралич дыхания)
| СИНДРОМ | КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ | МЕХАНИЗМ ВОЗНИКНОВЕНИЯ |
| Поражение периферической нервной системы | ||
| Мускариноподобный “М” Никотиноподобный “Н” | Миоз, спазм аккомодации, слюнотечение, бронхоспазм, брадикардия, рвота, понос, гиперперистальтика, потливость. Миофибрилляции, мышечная слабость, в первую очередь дыхательной мускулатуры, диплопия. | Усиленная деятельность парасимпатического отдела вегетативной нервной системы в области М-холинореактивных структур. Воздействие в области Н-холинореактивных структур |
|
Поражения ЦНС | ||
| Психотический “П” Экстрапирамидный “Э” | Напряженность,подавленность,двигатель-ное возбуждение, чу- вство страха, эмоцио- нальная неустойчивость,галлюцинации, потеря сознания. Тремор,мышечная регидность,клонические и тонико-клони- ческие субхореоидальные судороги. | Нарушение деятельности коры больших полушарий и ее взаимоотношений с подкоркой. Нарушение функций отдельных звеньев и всей экстрапирамидной системы |
Дата добавления: 2019-02-12; просмотров: 237; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
