Выражение коэффициента массопередачи через коэффициенты массоотдачи


 « G » « L »
« G » « L »
 | |||||||
 | |||||||
 | |||||||
 | |||||||
y Угр
 Хгр
Хгр
 x
x
 M
M
Закон Щукарева дает возможность определить количество переданного распределяемого вещества из ядра фазы к поверхности раздела фаз или наоборот. Поскольку в гетерогенных процессах в массобмене участвуют 2 фазы, то количество распределяемого вещества, переданного из фазы G к поверхности раздела и от нее в фазу L может быть определено для установившегося процесса уравнениями:
d М = b 1 dF ( y - y гр ) (!), d М = b 2 dF ( x гр - x ) (*) .
Если существует линейная зависимость между равновесными и рабочими концентрациями, то y * = mx, x =  , x гр =
, x гр = 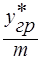 подставим в (*)
подставим в (*)
dM = b 2 dF ( y *- y *гр)  ,
,  = y - y гр ;
= y - y гр ;  = y гр * - y *.
= y гр * - y *.
Складывая почленно полученные уравнения и учитывая, что y гр = y *гр (скачка концентраций быть не может) получаем:


 (
( 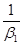 +
+  ) = y – y гр + y *гр - y * = y – y * и
) = y – y гр + y *гр - y * = y – y * и
dM= 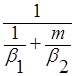 dF(y – y*). (**)
dF(y – y*). (**)
Сравним (**) с (ОУМП), видим,что Ky =  (***).
(***).
Выражая движущие силы через разность концентраций и заменяя в (!) значения концентраций у через соответствующие концентрации y = mx *,
y гр = mx *гр , аналогичным путем находим:
Ky =  .
.
Если равновесная линия кривая, то для нахождения коэффициента массопередачи по коэффициентам массоотдачи приходится процесс разбивать на участки и считать величину m постоянной в пределах каждого участка. Коэффициент массопередачи будет изменяться в этом случае по длине аппарата. Расчет упрощается, если один из коэффициентов массоотдачи >> другого.В этом случае коэффициент массопередачи можно принимать равным по значению меньшему коэффициенту массоотдачи.
|
|
|
Подобие диффузионных процессов
Уравнение конвективной диффузии математически описывает процесс массопереноса в одной фазе и для вывода критериев подобия оно должно быть дополнено соответствующими условиями, характеризующими массообмен на границе раздела фаз.
При одномерном диффузионном потоке в соответствии с 1-м законом Фика к поверхности раздела фаз будет передано количество вещества:
dM = - D  dFd τ. По Закону Щукарева: dM =
dFd τ. По Закону Щукарева: dM =  dF Δ C d t , отсюда:
dF Δ C d t , отсюда:
 - D
- D  =
=  .
.
На основе теории подобия после деления правой части на левую без учета знаков математических операций, замены x на  (определяющий размер) получим:
(определяющий размер) получим:
 - диффузионный критерий Нуссельта – характеризует массообмен на границе фаз и является аналогом теплового критерия Нуссельта.
- диффузионный критерий Нуссельта – характеризует массообмен на границе фаз и является аналогом теплового критерия Нуссельта.
Из дифференциального уравнения конвективной диффузии для одномерного случая:

 путем деления правой части уравнения на 1-ое слагаемое левой части, после преобразований получаем:
путем деления правой части уравнения на 1-ое слагаемое левой части, после преобразований получаем:
|
|
|
 - диффузионный критерий Фурье, который характеризует нестационарный диффузионный процесс.
- диффузионный критерий Фурье, который характеризует нестационарный диффузионный процесс.
Поделив 2-ое слагаемое левой части на правую, получим:
 - диффузионный критерий Пекле, который характеризует подобие полей концентраций по длине пути.
- диффузионный критерий Пекле, который характеризует подобие полей концентраций по длине пути.
Гидродинамическое подобие в массообменных аппаратах характеризуется критерием: Re =  ;
; 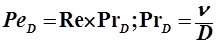 ,
,
PrD- диффузионный критерий Прандтля, характеризует подобие полей физических величин.
Учитывая, что критерий NuD является определяемым, общее критериальное уравнение конвективной диффузии записывается следующим образом:  .
. 
При вынужденном движении исключается Gr, т.к. естественной конвекцией можно пренебречь, и  или
или  .
.
Для естественной конвекции из общего уравнения выпадает критерий Re:  или
или  .
.
Значения коэффициентов А, m и n определяются исходя из опытных данных для конкретных случаев диффузионных процессов.
Критерий NuD вычисляется по полученным критериальным уравнениям и по нему определяют  :
:  .
.
Абсорбция
Абсорбция – процесс поглощения газов или паров из газовой или парогазовой смеси жидким поглотителем.
Поглощаемое вещество – абсорбтив, распределен в инертном газе.
|
|
|
Поглотитель – абсорбент (жидкость).
Процесс – избирательный и обратимый. Различают физическую и химическую абсорбцию. Примеры абсорбции: получение Н2S04, аммиачной воды, чистка отходящих газов.
Равновесие при абсорбции
Условия равновесия – равенство температур и Р обеих фаз и равновесие концентраций для всех компонентов в обеих фазах, которое характеризуется константой фазового равновесия m. В общем случае m = f ( P , T , x). В большинстве случаев эта функция находится экспериментально. В системе газ-жидкость  - закон Генри (
- закон Генри (  - парциальное давление газа над раствором, Е – константа Генри, х – концентрация газа в растворе в мольном выражении). Е зависит от природы растворимого газа и температуры. С ростом температуры растворимость газов уменьшается.
- парциальное давление газа над раствором, Е – константа Генри, х – концентрация газа в растворе в мольном выражении). Е зависит от природы растворимого газа и температуры. С ростом температуры растворимость газов уменьшается.
Согласно закону Дальтона p = Py; сопоставим и получим  ,
, 
 . Условия абсорбции улучшаются, если Р - повысить, а температуру снизить.
. Условия абсорбции улучшаются, если Р - повысить, а температуру снизить.
Дата добавления: 2019-02-12; просмотров: 304; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
