Примеры расчетов горения топлива
Пример 1.
Определить расход воздуха, состав и количество продуктов сгорания, а также калориметрическую температуру горения мазута. Состав мазута, %: CР=85,6, НР=10,5, NР=0,7, ОР=0,5, SР=0,7, АР=0, WР=2. Провести расчет при величине коэффициента избытка воздуха n=1,15. Температура подогрева воздуха tВ=300 оС.
Решение:
Расход воздуха, состав и количество продуктов сгорания определим, пользуясь табличным методом. Для удобства расчет горения жидкого топлива следует вести на 100 кг горючего.
В основу расчета положены реакции полного сгорания отдельных элементов:
С + О2 = СО2; Н2 + ½ О2 = Н2О; S + О2 = SО2.
Таблица 5 – Форма таблицы для записи результатов определения расхода воздуха, количества и состава продуктов сгорания
| Участвуют в горении | Газообразные продукты, образующиеся при горении | |||||||||||||||
| Топливо | Воздух | СО2, кмоль | Н2О, кмоль | SО2, кмоль | О2, кмоль | N2, кмоль | всего | |||||||||
| Составляющие | Содержание | Масса, кг | Молекулярная масса | Количество, кмоль | О2, кмоль | N2, кмоль | всего | |||||||||
| кмоль | м3 | |||||||||||||||
| кмоль | м3 | |||||||||||||||
| С Н S О N W | 85,6 10,5 0,7 0,5 0,7 2,0 | 85,6 10,5 0,7 0,5 0,7 2,0 | 12 2 32 32 28 18 | 7,13 5,25 0,022 0,016 0,025 0,111 | 7,13 2,625 0,022 -0,016 - - | 9,761∙3,762 | 9,761+36,72 | 46,481∙22,4 | 7,13 - - - - - | - 5,25 - - - 0,111 | - - 0,022 - - - | - - - - - - | 36,72 (из воздуха) 0,025 - | 49,238∙22,4 | ||
| Суммарное значение: при n=1 (%) при n=1,15 (%) | 9,761 (21) 11,22 (21) | 36,72 (79) 42,23 (79) | 46,481 (100) 53,45 (100) | 1041,17 1197,35 | 7,13 (14,48) 7,13 (12,68) | 5,361 (10,89) 5,361 (9,54) | 0,022 (0,045) 0,022 (0,04) | - 1,459 (2,59) | 36,745 (74,58) 42,255 (75,15) | 49,258 (100) 56,227 (100) | 1103,4 1259,5 | |||||
|
|
|
Для определения калориметрической температуры необходимо знать теплоту сгорания топлива. Для жидкого топлива ее можно определить по формуле (15)
 =339 ∙ 85,6 + 1256 ∙ 10,5 – 109 (0,5 – 0,7) – 25 ∙ (9 . 10,5+2) = 39815,7 кДж/кг.
=339 ∙ 85,6 + 1256 ∙ 10,5 – 109 (0,5 – 0,7) – 25 ∙ (9 . 10,5+2) = 39815,7 кДж/кг.
Определим энтальпию продуктов сгорания при условии, что воздух подогрет до 300 оС:
I0= 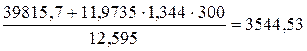 кДж/м3.
кДж/м3.
Задаемся возможной температурой горения tК = 1800 оС.
Для этой температуры энтальпия продуктов сгорания (приложение В) будет равна
СО2 + SО2 . . . . . . . . . (0,1268+0,0004) ∙ 4360,67=554,68
Н2О . . . . . . . . . . . . . . . . . . . . . . . 0,0954 ∙ 3429,9=327,21
О2 . . . . . . . . . . . . . . . . . . . . . . . . .0,259 ∙ 2800,48=725,32
N2 . . . . . . . . . . . . . . . . . . . . . . . . .0,7515 ∙ 2646,74=1989,03
––––––––––––––––––––––––––––––––––––––––––––––––
Итого . . . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . 3596,24 кДж/м3.
Поскольку I0<I1800 оС, то действительная калориметрическая температура будет ниже 1800 оС.
Примем tК = 1700 оС, тогда энтальпия составит
СО2 + SО2 . . . . . . . . . (0,1268+0,0004) ∙ 4087,1=519,88
Н2О . . . . . . . . . . . . . . . . . . . . . . . 0,0954 ∙ 3203,05=305,57
|
|
|
О2 . . . . . . . . . . . . . . . . . . . . . . . . .0,259 ∙ 2632,09=681,71
N2 . . . . . . . . . . . . . . . . . . . . . . . . .0,7515 ∙ 2486,28=1868,44
––––––––––––––––––––––––––––––––––––––––––––––––
Итого . . . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . 3375,6 кДж/м3.
Поскольку I1700 ˚С<I0, действительная калориметрическая температура лежит в пределах 1700 – 1800 оС. Калориметрическую температуру горения определяют интерполяцией по формуле
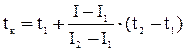 ,
,
где  – калориметрическая температура горения, оС,
– калориметрическая температура горения, оС,
tК=1700 + 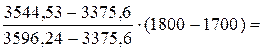 1777 оС.
1777 оС.
Пример 2.
Для случая сжигания смешанного газа с теплотой сгорания 21 МДж/м3 определить расход воздуха, состав и количество продуктов сгорания, калориметрическую температуру горения при коэффициенте расхода (избытка) воздуха n=1,12. Температура подогрева воздуха 380 оС. Температура подогрева топлива 200 оС. Составить материальный баланс процесса горения.
Состав топлива А, %: СО2=15, СО=16, Н2=39, СН4=24, С2Н4=3, N2=3. Влажность топлива А: WА=31 г/м3.
Состав топлива Б, %: СН4=93,2, С2Н4=0,3, С2Н6=0,4, С3Н8=0,6, С4Н10=0,6, N2=4,9. Влажность топлива Б: WБ=4,5 г/м3.
Решение:
Выполним пересчет каждого топлива с сухой массы на влажную, используя формулы (11) и (12)
Для топлива А
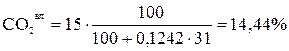 ;
;
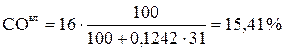 ;
;
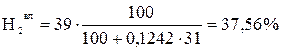 ;
;
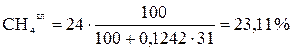 ;
;
 ;
;
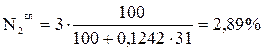 ;
;
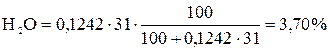 .
.
Проверяем правильность расчета, складывая все компоненты топлива А:
|
|
|
 =14,44 +15,41 +37,56 +23,11 +2,89+2,89+3,70 = 100 %.
=14,44 +15,41 +37,56 +23,11 +2,89+2,89+3,70 = 100 %.
Для топлива Б
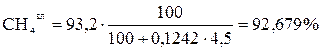 ;
;
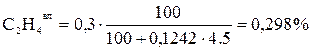
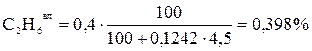 ;
;
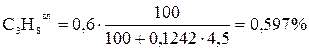 ;
;
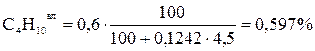 ;
;
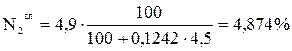 ;
;
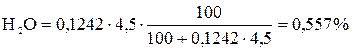 .
.
Проверяем правильность расчета, складывая все компоненты топлива Б:
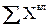 =92,679 +0,298 +0,398 +0,597 +0,597+4,874+0,557 = 100 %.
=92,679 +0,298 +0,398 +0,597 +0,597+4,874+0,557 = 100 %.
Определяем теплоту сгорания каждого топлива по формуле (16).
Теплота сгорания топлива А
Qрн(А) = 127·15,41+108·37,56+358·23,11+590.2,89 = 15992 кДж/м3.
Теплота сгорания топлива Б
Qрн(Б) = 358.92,679+590.0,298+635·0,398+913.0,597+1185.0,597 =34860 кДж/м3.
Определяем состав смеси двух топлив.
Для этого необходимо определить долю топлива А в смеси газообразных топлив из выражения таблицы 4
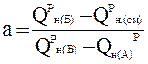 ,
,
где а – доля топлива А в смеси двух топлив;
Qрн(А), Qрн(Б) – теплота сгорания соответственно топлива Б и топлива А, кДж/м3;
Qрн(см) – теплота сгорания смеси топлив, кДж/м3,
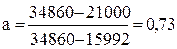 .
.
Состав смеси определяется по формуле, указанной в таблице 4
Хвл(см) = Хвл(А).а + Хвл(Б).(1-а),
где Хвл(см), Хвл(А), Хвл(Б) – содержание компонента в смеси топлив и в топливах А и Б соответственно, %.
Тогда с учетом формулы состав смеси топлив будет следующий
СО2см =14,44.0,73+0 = 10,54 %;
СОсм =15,41· 0,73+0 = 11,25 %;
Н2см = 37,56.0,73+0 = 27,42 %;
СН4см =23,11.0,73+92,679.(1-0,73) = 41,89 %;
С2Н4см =2,89.0,73+0,298.0,27 = 2,19 %;
С2Н6см=0+0,398.0,27 = 0,11 %;
С3Н8см=0+0,597.0,27 = 0,16 %;
С4Н10см=0+0,597.0,27 = 0,16 %;
N2cм =2,89· 0,73+4,874.0,27 = 3,43 %;
|
|
|
Н2Осм =3,70· 0,73+0,557· 0,27 = 2,85 %.
Проверяем правильность расчета, складывая все компоненты смеси топлив
 =10,54 +11,25 +27,42 +41,89 +2,19+0,11+0,16+0,16+3,43+2,85=100 %.
=10,54 +11,25 +27,42 +41,89 +2,19+0,11+0,16+0,16+3,43+2,85=100 %.
Определяем расход воздуха, состав и количество продуктов сгорания. Расчет ведем на 100 м3 смеси топлив.
Составляем реакции горения горючих компонентов смеси топлив и на их основе определяем количество требуемого для горения кислорода, а также количество образующихся продуктов сгорания.
а) СО + 1/2 О2 = СО2
1 м3СО - 0,5 м3 О2
11,25 м3 СО - 5,625 м3 О2 ;
1 м3СО - 1 м3 СО2
11,25 м3 СО - 11,25 м3 СО2.
б) Н2 + 1/2О2 = Н2О
1 м3Н2 - 0,5 м3 О2
27,42 м3 Н2 - 13,71 м3 О2 ;
1 м3 Н2 - 1 м3 Н2О
27,42 м3 Н2 - 27,42 м3Н2О.
в) СН4 + 2О2 = СО2 + 2Н2О
1 м3 СН4 -2м3 О2
41,89 м3 СН4 - 83,78 м3 О2 ;
1 м3 СН4 - 1 м3 СО2 и 2 м3 Н2О
41,89 м3 СН4 – 41,89 м3 СО2 и 83,78 м3Н2О.
г) С2Н4+ 3О2 = 2СО2 + 2Н2О
1 м3 С2Н4 - 3 м3 О2
2,19 м3 С2Н4 - 6,57 м3 О2 ;
1 м3 С2Н4 - 2 м3 СО2 и 2 м3 Н2О
2,19 м3 С2Н4 - 4,38 м3 СО2 и 4,38 м3 Н2О.
д) 2С2Н6 + 7О2 = 4СО2 + 6Н2О
2 м3 С2Н6 - 7 м3 О2
0,11 м3 С2Н6 - 0,385 м3 О2 ;
2 м3 С2Н6 - 4 м3 СО2 и 6 м3 Н2О
0,11 м3 С2Н6 - 0,22 м3 СО2 и 0,33 м3 Н2О.
е) С3Н8 + 5О2 = 3СО2 + 4Н2О
1 м3 С3Н8 - 5 м3 О2
0,16 м3 С3Н8 - 0,80 м3 О2 ;
1 м3 С3Н8 - 3 м3 СО2 и 4 м3 Н2О
0,16 м3 С3Н8 – 0,48 м3 СО2 и 0,64 м3 Н2О.
ж) 2С4Н10 + 13О2 = 8СО2 + 10Н2О
2 м3 С2Н4 - 13 м3 О2
0,16 м3 С2Н4 - 1,20 м3 О2 ;
2 м3 С2Н4 - 8 м3 СО2 и 10 м3 Н2О
0,16 м3 С2Н4 - 0,64 м3 СО2 и 0,80 м3 Н2О.
Полученные данные заносим в таблицу 5.
Для определения количества воздуха с учетом коэффициента избытка воздуха, необходимо воспользоваться выражением (19).
Таблица 5 – Результаты расчета расхода воздуха, состава и количества продуктов сгорания
| Участвуют в горении | Образуется продуктов сгорания, м3 | ||||||||
| Топливо, м3 | Воздух, м3 | ||||||||
| Составля-ющая | Содержание, м3 | О2 | N2 | всего | СО2 | Н2О | О2 | N2 | всего |
| СО2 СО Н2 СН4 С2Н4 С2Н6 С3Н8 С4Н10 N2 Н2О | 10,54 11,25 27,42 41,89 2,19 0,11 0,16 0,16 3,43 2,85 | - 5,625 13,71 83,78 6,57 0,385 0,80 1,20 - - | 112,07.3,762=421,61 | 112,07+421,61=533,68 | 10,54 11,25 - 41,89 4,38 0,22 0,48 0,64 - - | - - 27.42 83,78 4,38 0,33 0,64 0,80 - 2,85 | 3,43+421,61=425,04 | ||
| n = 1 (%) | 100 | 112,07 (21) | 421,61 (79) | 533,68 (100) | 69,40 (11,3) | 120,20 (19,6) | - | 425,04 (69,1) | 614,64 (100) |
| n = 1,12 (%) | 100 | 125,52 (21) | 472,20 (79) | 597,72 (100) | 69,40 (10,2) | 120,20 (17,7) | 13,45 (2,0) | 475,63 (70,1) | 678,68 (100) |
Для определения состава продуктов сгорания, воспользуемся формулой
 ,
,
где 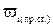 – содержание i-того компонента в продуктах сгорания, %
– содержание i-того компонента в продуктах сгорания, %
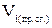 – объем i-того компонента в продуктах сгорания, м3;
– объем i-того компонента в продуктах сгорания, м3;
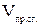 – общий объем продуктов сгорания, м3.
– общий объем продуктов сгорания, м3.
Таким образом, состав продуктов сгорания составит
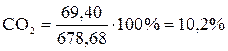 ;
;
 ;
;
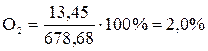 ;
;
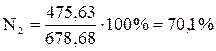 .
.
Для проверки правильности расчета составляется материальный баланс. Материальный баланс представлен в таблице 6.
Таблица 6 – Материальный баланс горения смеси двух топлив
| Поступило, кг | Получено, кг |
| Топливо: СО2 = 10,54·44/22,4 = 20,70 СО = 11,25·28/22,4 = 14,06 Н2О = 2,85.18/22,4 = 2,29 Н2 = 27,42·2/22,4 = 2,45 СН4 = 41,89·16/22,4 = 29,92 С2Н4 = 2,19·28/22,4 = 2,74 N2 = 3,43·28/22,4 = 4,29 С3Н8 = 0,16.44/22,4 = 0,31 C2Н6 = 0,11·30/22,4 = 0,15 С4Н10 = 0,16.58/22,4 = 0,41 Воздух: О2 = 125,52.32/22,4 = 179,31 N2 = 472,20.28/22,4 = 590,25 Итого: 846,88 кг. | Продукты сгорания: СО2 = 69,40·44/22,4 =136,32 Н2О = 120,20.18/22,4 = 96,59 N2 = 475,63·28/22,4 = 594,54 О2 = 13,45.32/22,4 = 19,21 Итого: 846,66 кг. |
Рассчитываем погрешность вычислений 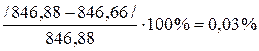 .
.
Т.к. погрешность менее 0,5 %, следовательно, расчет проведен правильно.
Из таблицы 1 следует, что для сжигания 100 м3 смеси топлив необходимо затратить 597,72 м3 воздуха при указанной величине коэффициента избытка воздуха, равной 1,12. При этом образуется продуктов сгорания 678,68 м3. Т.е. для
сжигания 1 м3 смеси топлив необходимо затратить 5,98 м3 воздуха и образуется
продуктов сгорания 6,79 м3.
Определяем калориметрическую температуру горения. Для этого необхо-
димо найти начальную энтальпию (теплосодержание) 1м3 продуктов сгорания по формуле (24).
Количество тепла, получаемое от сжигания топлива в расчете на единицу объема продуктов сгорания, определим из выражения (21)
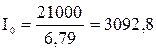 кДж/м3.
кДж/м3.
Количество тепла, вносимое подогретым воздухом, может быть определено по выражению (23).
Теплоемкость воздуха при температуре 380 оС определяем методом интерполяции
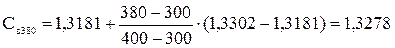 кДж/(м3.оС).
кДж/(м3.оС).
Тогда количество тепла, вносимое подогретым воздухом
 кДж/м3.
кДж/м3.
Количество тепла, вносимое подогретым топливом, определяем по формуле(22).
Теплоемкость топлива, состоящего из многих компонентов, определяется из выражения
 ,
,
где сi – теплоемкость i-того компонента топлива при указанной температуре, кДж/(м3.оС);
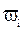 – доля i-того компонента топлива в смеси.
– доля i-того компонента топлива в смеси.
Теплоемкость компонентов смеси топлив при температуре 200 оС (согласно приложению Б):
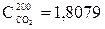 кДж/(м3.оС);
кДж/(м3.оС);
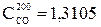 кДж/(м3.оС);
кДж/(м3.оС);
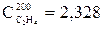 кДж/(м3.оС);
кДж/(м3.оС);
 кДж/(м3.оС);
кДж/(м3.оС);
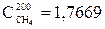 кДж/(м3.оС);
кДж/(м3.оС);
 кДж/(м3.оС);
кДж/(м3.оС);
 кДж/(м3.оС);
кДж/(м3.оС);
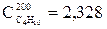 кДж/(м3.оС);
кДж/(м3.оС);
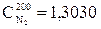 кДж/(м3.оС);
кДж/(м3.оС);
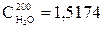 кДж/(м3.оС).
кДж/(м3.оС).
Теплоемкость топлива
Ст= 1,8079.0,1054+1,3105.0,1125+1,2979.0,2742+1,7669.0,4189+1,3030.0,0343+
+1,5174.0,0285+2,328.(0,0219+0,0011+0,0016+0,0016) =1,4115 кДж/(м3.оС).
Количество тепла, вносимое подогретым топливом
 кДж/м3.
кДж/м3.
Таким образом, энтальпия продуктов сгорания составит
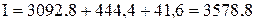 кДж/м3.
кДж/м3.
Далее искомую температуру находим методом подбора. Для этого задаемся возможной температурой горения, например, равной 2200 оС, и определяем при этой температуре энтальпию продуктов сгорания с учетом табличных данных и состава продуктов сгорания
СО2 . . . . . . . . . . . . . . . . . . . . . . . 0,102 ∙ 5464,20 = 557,3
Н2О . . . . . . . . . . . . . . . . . . . . . . . 0,177∙ 4358,83 = 771,5
О2 . . . . . . . . . . . . . . . . . . . . . . . . .0,020 ∙ 3487,44 = 69,7
N2 . . . . . . . . . . . . . . . . . . . . . . . . .0,701 ∙ 3295,84 = 2310,4
––––––––––––––––––––––––––––––––––––––––––––––––
Итого . . . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3708,9 кДж/м3.
Сравниваем полученную энтальпию с действительной энтальпией продуктов сгорания. Поскольку I<I2200 , следовательно, искомая температура горения меньше, чем 2200 оС.
Задаемся температурой горения, равной 2100 оС. Энтальпия продуктов сгорания при этой температуре
СО2 . . . . . . . . . . . . . . . . . . . . . . . 0,102 ∙ 5186,81 = 529,1
Н2О . . . . . . . . . . . . . . . . . . . . . . . 0,177∙ 4121,79 = 729,6
О2 . . . . . . . . . . . . . . . . . . . . . . . . .0,020 ∙ 3314,85 = 66,3
N2 . . . . . . . . . . . . . . . . . . . . . . . . .0,701 ∙ 3131,96 = 2195,5
––––––––––––––––––––––––––––––––––––––––––––––––
Итого . . . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3520,5 кДж/м3.
Т.к. I2100<I, то действительная калориметрическая температура горения лежит в пределах 2100 – 2200 оС.
Калориметрическая температура горения
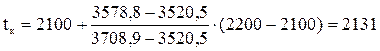 оС.
оС.
Выполнение домашнего задания/контрольной работы аналогично рассмотренному примеру 2. Варианты задания приведены в приложении А.
Дата добавления: 2019-01-14; просмотров: 3167; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
