Ограничения и допущения, принимаемые в технических расчетах
Все расчеты ведутся на единицу топлива (1 кг для твердого и жидкого и 1 м3 для газообразного топлива). Газовые объемы рассчитываются при нормальных условиях, т. е. при температуре 20 °С и давлении 760 мм. рт. ст. Объем одного моля газов в этих условиях принимают равным 22,4 м3. В качестве окислителя используют атмосферный воздух, состав которого принимают неизменным: 21 % кислорода и 79 % азота по объему. Соотношение азота и кислорода воздуха представляют в виде константы
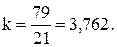
Рассмотрим точные расчеты горения топлива, основанные на стехиометрических соотношениях горючих составляющих и окислителя. Такие расчеты принято называть аналитическими.
Определение расхода воздуха
В качестве первого примера рассмотрим горение газообразного топлива, состоящего из 98 % СН4 и 2 % N2. Горючей составляющей данного топлива является
метан, который будет окисляться по реакции: СН4 + 2О2 = СО2 + 2Н2О.
Из реакции следует, что для сжигания 1 моль СН4 требуется 2 моль О2. Объем 1 моль любого газа одинаков для всех газов и при нормальных условиях равен 22,4 м3, следовательно для сжигания 1 м3 СН4 требуется 2 м3 О2. В рассматриваемом примере в 1 м3 газа содержится 0,98 м3 СН4, для сжигания которого потребуется 0,98 ∙ 2 = 1,96 м3 О2. Количество азота в воздухе определяется с учетом константы и равно 1,96 . 3,762 = 7,37 м3. Расход воздуха для сжигания 1 м3 газа указанного состава будет равен 1,96 + 7,37 = 9,33 м3.
|
|
|
Вторым примером рассмотрим горение 1 кг углерода, который окисляется по реакции: С + О2 = СО2. Из реакции следует, что для оксиления 1 моль С требуется 1 моль О2. По условию примера в реакции окисления будет участвовать 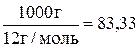 моль С. Поэтому для его окисления также потребуется 83,33 моль О2. Следовательно, объем требуемого кислорода составит 83,33 . 22,4 = = 1,87 м3. Количество азота в воздухе составит 1,87 . 3,762 = 7,02 м3. Расход воздуха для сжигания 1 кг углерода будет равен 1,87 + 7,02 = 8,89 м3.
моль С. Поэтому для его окисления также потребуется 83,33 моль О2. Следовательно, объем требуемого кислорода составит 83,33 . 22,4 = = 1,87 м3. Количество азота в воздухе составит 1,87 . 3,762 = 7,02 м3. Расход воздуха для сжигания 1 кг углерода будет равен 1,87 + 7,02 = 8,89 м3.
Если в состав топлива входит некоторое количество кислорода, то при горении топлива он может участвовать в реакциях окисления, поэтому из суммарного объема кислорода, необходимого для сгорания топлива, следует вычесть объем кислорода топлива.
Определение количества и состава продуктов сгорания
Рассмотрим пример горения газа (98 % СН4 и 2 % N2) сначала при коэффициенте расхода воздуха, равным 1. Определим последовательно количества каждой составляющей продуктов сгорания. При сжигании 1 м3 СН4 образуется 1 м3 СО2 и 2 м3 Н2О, а при сжигании 0,98 м3 СН4 образуется 0,98 м3 СО2 и 1,96 м3 Н2О.
Кроме того, вносится азота:
с воздухом . . . . . 1,96 ∙ 3,762 = 7,37 м3 (см. выше)
с газом . . . . . . . . . . . . . . . . . . . . 0,02 м3
|
|
|
––––––––––––––––––––––
Итого . . . . . . 7,39 м3.
Полное количество продуктов сгорания: 0,98 + 1,96 + 7,39 = 10,33 м3.
Состав продуктов сгорания будет следующий, %:
СО2. . . . . . . . 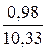 ∙ 100 = 9,49
∙ 100 = 9,49
Н2О. . . . . . . . 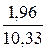 ∙ 100 = 18,97
∙ 100 = 18,97
N2. . . . . . . . . 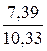 ∙ 100 = 71,54
∙ 100 = 71,54
–––––––––––––––––––––––––––––––
Итого. . . . . . . . . . . . . 100 %.
При сжигании газа с коэффициентом расхода воздуха, большим единицы, количество и состав продуктов сгорания изменяются. Например, при n = 1,2 в продуктах сгорания газа рассматриваемого состава будет 0,98 м3 СО2; 1,96 м3 Н2О; 1,96 ∙ 1,2 – 1,96 = 0,39 м3 О2 и 1,96 ∙ 1,2 ∙ 3,762 + 0,02 = 8,86 м3 N2.
Полное количество продуктов сгорания: 0,98 + 1,96 + 0,39 + 8,86 = 12,19 м3.
Состав продуктов сгорания будет следующий, %:
СО2. . . . . . . . 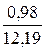 ∙ 100 = 8,04
∙ 100 = 8,04
Н2О. . . . . . . .  ∙ 100 = 16,08
∙ 100 = 16,08
О2. . . . . . . . . . 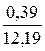 ∙ 100 = 3,20
∙ 100 = 3,20
N2. . . . . . . . . 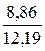 ∙ 100 = 72,68
∙ 100 = 72,68
–––––––––––––––––––––––––––––––
Итого. . . . . . . . . . . . . 100 %.
Правильность выполненного расчета горения топлива проверяют методом составления материального баланса этого процесса. Для рассмотренного выше примера горения в воздухе газа (98 % СН4 и 2 % N2) при n = 1 материальный баланс будет выглядеть следующим образом:
Поступило, кг: Получено, кг:
|
|
|
СН4. . . . . . . 0,98 ∙ 16 / 22,4 = 0,7 СО2. . . . . . 0,98 ∙ 44 / 22,4 = 1,93
О2. . . . . . . . . 1,96 ∙ 32 / 22,4 = 2,8 Н2О. . . . . . 1,96 ∙ 18 / 22,4 = 1,57
N2. . (7,37 + 0,02) ∙ 28 / 22,4 = 9,24 N2. . . . . . . 7,39 ∙ 28 / 22,4 = 9,24
–––––––––––––––––––––––––––––– ––––––––––––––––––––––––––––––
Итого. . . . . . . . . . 12,74 Итого . . . . . . . . . . . . 12,74
При составлении материального баланса погрешность не должна превышать 0,5 %.
Дата добавления: 2019-01-14; просмотров: 506; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
