Общая характеристика процессов горения топлива
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное автономное образовательное учреждение
высшего образования
«Национальный исследовательский технологический университет
«МИСиС»
НОВОТРОИЦКИЙ ФИЛИАЛ
Кафедра металлургических технологий и оборудования
Расчет горения топлива
Методические указания
для выполнения домашнего задания/контрольной работы
по дисциплине «Теплотехника»
для студентов направлений подготовки
18.03.01 «Химическая технология», 22.03.02 «Металлургия»,
15.03.02 «Технологические машины и оборудование»
всех форм обучения
Новотроицк, 2018
УДК 669.041
ББК 31.391
К 91
Рецензенты:
Доцент кафедры теплотехнических и энергетических систем
ФГБОУ ВО МГТУ им. Г.И. Носова, к.т.н., В.Н. Антонов
Доцент кафедры металлургических технологий и оборудования
Новотроицкого филиала ФГАОУ ВО НИТУ «МИСиС», к.т.н., Е.А. Шевченко
Куницина Н.Г. Расчет горения топлива: Методические указания для выполнения домашнего задания/контрольной работы по дисциплине «Теплотехника» для студентов направлений подготовки 18.03.01 «Химическкая технология», 22.03.02 «Металлургия», 15.03.02 «Технологические машины и оборудование» всех форм обучения. - Новотроицк: НФ НИТУ «МИСиС», 2018 - 45 с.
Методические указания составлены на основании рабочих программ дисциплины «Теплотехника» для указанных направлений подготовки и предназначены для закрепления знаний по основам процессов горения различных видов топлива в металлургических агрегатах.
|
|
|
Рассмотрены краткая характеристика различных видов топлива, общие принципы расчета горения топлива, приведены примеры расчетов твердого, жидкого и газообразного топлив. Представлены варианты задания для последующего расчета горения топлива и условия его сжигания. В приложении помещены справочные данные, необходимые для расчетов.
Рекомендовано Методическим советом НФ НИТУ «МИСиС»
© Новотроицкий филиал
ФГАОУ ВО «Национальный
исследовательский
технологический университет
«МИСиС», 2018.
Содержание
|
|
|
| Введение……………………………………………………………………….. | 4 |
| 1 Общая характеристика топлива…………………………………............... | 5 |
| 1.1 Требования к топливу……………………………………………………. | 5 |
| 1.2 Классификация топлива………………………………………………….. | 5 |
| 1.3 Химический состав топлива……………………………………………... | 6 |
| 1.4 Основные свойства топлива……………………………………………… | 10 |
| 1.5 Основные виды топлива………………………………………………….. | 14 |
| 2 Основы теории горения…………………………………………………….. | 18 |
| 2.1 Общая характеристика процессов горения…………………………….. | 18 |
| 2.2 Возникновение пламени………………………………………………….. | 19 |
| 2.3 Особенности горения газообразного топлива…………………………. | 21 |
| 2.4 Особенности горения жидкого топлива………………………………… | 22 |
| 2.5 Особенности горения твердого топлива………………………………… | 23 |
| 3 Методика расчета горения топлива……………………………………….. | 24 |
| 3.1 Ограничения и допущения, принимаемые в технических расчетах….. | 26 |
| 3.2 Определение расхода воздуха…………………………………………… | 26 |
| 3.3 Определение количества и состава продуктов сгорания……………… | 27 |
| 3.4 Определение температуры горения……………………………………… | 28 |
| 3.5 Основные формулы для расчета горения топлива…………………….. | 30 |
| 4 Примеры расчетов горения топлива……………………………………… | 31 |
| Приложение А. Варианты заданий………………………………………….. | 41 |
| Прилоджение Б. Средние теплоемкости для воздуха и газов, кДж/м3.˚С… | 44 |
| Приложение В. Этальпия 1 м3 воздуха и газов при различных температурах и постоянном давлении ……………………………………… | 45 |
|
|
|
Введение
При проектировании любой печной установки, источником тепла которой является какое-либо топливо, необходимо рассчитать характеристики горения этого топлива, к которым относятся: теплота сгорания топлива; количество воздуха, необходимое для сжигания данного топлива; количество и состав продуктов горения; температура продуктов горения топлива.
Расчеты горения топлива всегда выполняются в начале полного расчета печи, так как позволяют определить одну из наиболее важных величин – температуру горения топлива, которая в значительной мере определяет температурный режим работы печи. Однако значение расчетов горения топлива этим не ограничивается. Расчет горения топлива совместно с расчетом теплового баланса печи позволяет определить полное количество отходящих из печи продуктов сгорания, без чего невозможно выполнить расчет таких важных элементов печи как рекуператоры, борова, дымовые трубы.
|
|
|
Цель настоящих методических указаний – закрепить знания по разделу «Горение топлива», полученные студентами при изучении теоретической части указанной дисциплины, ознакомить студентов с методиками расчетов горения топлива, а также выработать практические навыки самостоятельного проведения расчетов, т.к. важной задачей при проектировании печей металлургической промышленности является правильное решение вопросов, связанных с сжиганием топлива.
Общая характеристика топлива
Органическое ископаемое топливо (твердое, жидкое, газообразное) является в настоящее время и по прогнозам до 2030 г. основным источником энергии (теплоты) для металлургической промышленного. Топливо – это вещества органического происхождения, которые при нагревании в присутствии кислорода интенсивно окисляются с выделением значительного количества тепла.
Требования к топливу
К топливу предъявляются следующие требования:
1. Добыча топлива, находящегося в виде природных запасов, должна быть сопряжена с наименьшими экономическими затратами. Это, в частности, предполагает, что оно сосредоточено в месторождениях в большом количестве. Все более актуальным становится также требование минимального нарушения экологической обстановки при добыче полезных ископаемых.
2. Продукты сгорания должны быть как можно более безвредными для людей и окружающей природы.
3. Продукты сгорания топлива должны легко удаляться по мере его сжигания. Наилучшим в этом отношении является газообразное топливо, которое в отличие от твердого и жидкого не дает после сгорания твердого остатка.
4. Продукты сгорания не должны загрязнять технологический продукт (или это загрязнение не должно существенно влиять на его качество), а также взаимодействовать с материалом футеровки рабочей камеры печи. В этом отношении преимущество имеет газообразное и в меньшей степени жидкое топливо.
5. Процесс горения должен быть легко контролируемым и регулируемым, что также характерно для газообразного и жидкого топлива.
Топливный баланс со временем изменяется по структуре. Открытие крупных месторождений газообразного топлива, которое легко транспортируется по трубопроводам, позволило намного уменьшить использование твердого топлива. Преимуществами природного газообразного и жидкого топлив являются также более высокая калорийность и меньшая стоимость, поэтому их доля в топливном балансе, постоянно возрастает.
Классификация топлива
По принципу выделения энергии различают две группы топлив: хи-мическое, выделяющее энергию в результате окисления горючих элементов, и ядерное, выделяющее энергию при делении ядер.
В настоящее время в мире преимущественно используется химическое или органическое топливо, являющееся источником около 70 % всей вырабатываемой энергии.
При использовании топлив находят применение как выделяемая энергия – теплота, так и их химические свойства. Поэтому топлива могут быть разделены на энергетические и технологические.
Энергетическое топливо предназначено для сжигания с целью непосредственного получения тепловой энергии или ее преобразования в механическую и (или) электрическую энергии.
Технологическое топливо используется для ведения высокотемпературных технологических процессов (нагрев, обжиг, плавление и др.) и химической переработки для получения искусственного топлива (кокса) и технических продуктов (например, при сжигании кокса в доменных печах используются восстановительные свойства углерода).
По агрегатному состоянию все топлива делятся на твердые, жидкие и газообразные, а по способу получения или добычи – на природные и производные (искусственные). Кроме древесины, все виды природных топлив представляют собой горючие ископаемые. Искусственное топливо получают путем переработки природного. Методы переработки весьма разнообразны и зависят от характеристики и назначения конечного продукта, в их основе лежат физико-механические воздействия на исходный продукт: дробление, помол, нагрев, перегонка и т.д. Основные виды химических топлив представлены в таблице 1.
Таблица 1 - Классификация основных видов химических топлив
| Агрегатное состояние топлива | Виды топлива | |
| Естественное (природное) | Искусственное | |
| Твердое | Древесина, торф, бурый уголь, каменный уголь, антрацит, горючие сланцы | Древесный уголь, кокс, торфяные и угольные брикеты |
| Жидкое | Нефть | Бензин, керосин, мазут, смола каменноугольная, лигроин |
| Газообразное | Природный газ | Коксовый, доменный, генераторный, конвертерный |
Химический состав топлива
При проведении химического анализа топлива определяются доли различных химических элементов и составляющих его веществ, т.е. элементарный состав. Органическое топливо состоит из сложных соединений различных элементов: углерода (С), водорода (Н), кислорода (О), серы (S), азота (N) и других, а также балласта в виде влаги (W) и минеральных компонентов, не участвующих в процессе горения и способствующих образованию золы (А).
Топливо состоит из горючейи негорючейчастей. В горючую часть твердого и жидкого топлива входят углерод, водород и сера, а также условно кислород и азот; в негорючую часть – зола, представляющая смесь минеральных веществ, и влага, составляющие его балласт (Б). Они попадают в топливо из недр земли, а также при транспортировке и хранении топлива на складах: Б = А + W.
Углеродявляется главной горючей составляющей всех топлив.
При полном сгорании углерода тепловыделение составляет 33,5х103 кДж/кг. Тепловая ценность топлива определяется содержанием в нем углерода. Так, в древесине и торфе его доля достигает 58 %, в угле и мазуте – 90 %. При термохимической переработке топлив углерод служит основой для образования вторичных органических веществ и составляет основную часть важного искусственного технологического топлива – кокса.
Водород – вторая важнейшая горючая составляющая любого топлива. Тепловыделение при его сгорании зависит от агрегатного состояния (жидкое или парообразное) конечного продукта горения водорода – воды и может достигать 142х103 кДж/кг. С увеличением возраста твердого топлива содержание в нем водорода падает.
Кислород является балластной примесью в топливе, снижает его тепловую ценность. Кроме того, он связывает в топливе водород, обесценивая и его. В твердых топливах с небольшим химическим возрастом содержание кислорода может достигать 30 % и выше, а в большинстве жидких моторных топлив оно не превышает 1,5 %.
Азот также балластирует топливо, снижая содержание в нем горючих веществ. В составе твердого топлива его содержится до 1,5 %, в жидких – менее 1 %.
Сера входит в топливо в трех видах: сера органическая Sорг, входящая в состав его органических соединений; сера колчеданная Sк, входящая в состав сульфидов, главным образом пирита и марказита FeS2, и сера сульфатная Sc, входящая в состав различного вида сульфатов, например CaSO4, MgSO4, FeSO4 и др.
Первые две составляющие серы горят – это так называемая летучая (горючая) сера: Sл = Sopг + Sк. Сульфатная сера в горении топлива не участвует, так как уже находится в соединении с кислородом. В связи с этим она включается во внешний негорючий остаток – золу.
Суммарное содержание серы во всех трех соединениях носит название серы общей – Sобщ = Sорг+Sк+Sc=Sл+Sс. Сера является вредной составляющей топлива, так как при ее сгорании образуются оксиды: сернистый ангидрид SO2 и серный ангидрид SO3. Особенно вреден SO3, который, соединяясь с влагой, дает в качестве конечного продукта серную кислоту: SO3 + Н2О = H2SO4. Oнa вызывает интенсивную коррозию металла котельных агрегатов и т.д. Выбросы SО2 и SO3 в атмосферу оказывают вредное влияние на окружающую среду.
Минеральные компонентыявляются главной балластной составляющей топлива, входящей в состав остаточного продукта полного сгорания топлива – золы. В состав золы входят как вещества, образующие минеральную часть топлива, так и продукты их разложения и окисления. Содержание минеральных компонентов в твердых топливах колеблется в очень широких пределах: от 1-2 % в древесине до 70 % в сланцах, в жидких топливах – до 1 %. Количество минеральных компонентов в топливе определяет его зольность,т.е. способность образовывать в процессе сгорания золу. Основной характеристикой золы является температура плавления, зависящая от ее состава. Топлива с большим содержанием минеральных компонентов нецелесообразно перевозить на большие расстояния.
Влага так же, как и минеральные компоненты, – балласт, снижающий тепловую ценность топлива и определяющий целесообразность его транспортировки на большие расстояния. На испарение влаги тратится часть теплоты, выделяющейся при сгорании топлива, что уменьшает температурный уровень процесса горения. Кроме того, снижается значение температуры точки росы водяных паров, содержащихся в продуктах сгорания и увеличивается опасность низкотемпературной коррозии. Доля влаги в составе топлива колеблется очень широко: от 0,3-1,5 % в мазуте, 5 % в каменных углях, до 20-57 % в торфах и бурых углях.
Элементарный состав горючих газовможно представить так же, как и твердых и жидких топлив. Однако для удобства анализа и расчетов процесса горения газов их состав обычно представляют в виде суммы объемных долей горючих компонентов и балластных примесей в процентах, определяемых при нормальных условиях без учета водяных паров, т.е. на сухую массу топлива.
В состав природных газов в качестве горючих элементов входят: метан СН4 – до 98,9 %, углеводороды метанового ряда (0,3-10 %) – этан С2Н6, пропан С3Н8, бутан С4Н10 и другие, а также в виде следов сероводород H2S. Балластом являются азот N2, углекислый газ СО2 и водяные пары.
В попутных газах нефтяных месторождений содержание метана ниже (до 45 %), однако возрастает доля тяжелых углеводородов (до 40 %).
Искусственные газы в качестве горючих компонентов содержат водород, метан, оксид углерода СО и небольшие количества тяжелых углеводородов (в коксовом газе). Балластными примесями в искусственных газах являются СО2, N2, водяные пары и пыль.
Влагосодержание газообразных топлив d, кг/м3, колеблется в зависимости от состояния топлива.
Содержание химических элементов и других составляющих топлива исчис-
ляется в процентах от единицы массы или объема, исходя из определенной части (массы) топлива. В зависимости от состава и вида топлива различают рабочую, сухую, горючую и органическую массы топлива. Каждой массе присваивается соответствующий индекс: рабочей – р, сухой – с, горючей – г, органической – о.
Для твердых топлив применимы все пять масс. О составе топлива на соответствующую массу судят по индексу элементов. Топливо в том виде, в котором оно приходит к потребителю, называется рабочим.Его состав наиболее полно отражает состояние топлива. Элементарный состав рабочей массы записывается в следующем виде
CР + HР + OР + NР + SлР + AР + WР = 100%. (1)
При полном высушивании топлива (при t ≥ 105 °С) получают сухуюмассу. Уравнение элементарного состава сухой массы топлива имеет вид
СС + НС + ОС + NC + SлC + АC = 100%. (2)
Под горючей массой топлива понимают топливо, не содержащее механических компонентов и влаги (балласта). Уравнение элементарного состава горючей массы топлива
СГ + НГ + ОГ + NГ + SлГ = 100%. (3)
Органическая масса топлива в отличие от горючей не содержит колчеданную серу. Элементарный состав этой массы может быть выражен равенством
СО + НО + ОО + NО = 100%. (4)
При переходе от рабочей к органической массе доля химических элементов в составе топлива увеличивается, т.е. СО > СГ > СС > СР.
Пересчет состава из одной массы на другую выполняется по следующим выражениям, %:
ХО=ХГ 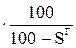 ; (5)
; (5)
ХО=ХС 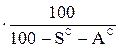 ; (6)
; (6)
ХО=ХР 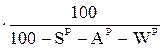 ; (7)
; (7)
ХГ=ХС 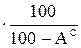 ; (8)
; (8)
ХГ=ХР 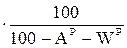 ; (9)
; (9)
ХС=ХР 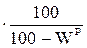 , (10)
, (10)
где ХР, ХС, ХГ, ХО – содержание какого-либо элемента соответственно в рабочей, сухой, горючей и органической массе.
Для жидких топлив характерны рабочая и сухая (безводная) массы. Рабочая масса жидких топлив характеризуется отсутствием в ее составе золы.
Состав природных и искусственных газов исчисляется только на сухой объем (1 м3 при нормальных условиях). Содержание влаги определяет масса воды в единице объема сухого газа (W, г/м3). При анализе газообразного топлива влага не учитывается, поэтому сухое топливо пересчитывают на влажное, используя следующие зависимости
Хвл=Хсух 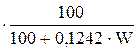 ; (11)
; (11)
Н2О=0,1242.W 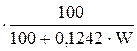 . (12)
. (12)
Основные свойства топлива
Теплота сгорания. Наиболее важной характеристикой топлива является теплота сгорания – количество тепла, получаемого при сжигании 1 кг твердого или жидкого топлива или 1 м3 газообразного топлива в кДж/кг (ккал/кг) или кДж/м3 (ккал/м3): 1 ккал = 4,1868, или 4,19, кДж.
Ее можно определять экспериментально и теоретически, если известен элементарный состав топлива.
Экспериментально теплоту сгорания топлива находят в калориметрической установке. Точно взвешенную навеску испытуемого топлива сжигают в среде сжатого кислорода в калориметрической бомбе и определяют количество выделившейся теплоты. Однако условия сжигания топлива в калориметрической бомбе в значительной степени отличаются от реальных условий их использования в двигателях внутреннего сгорания, парогенераторах, печах и пр.
При сгорании топлив в калориметрической бомбе образуются газообразные
продукты, в состав которых входят водяные пары, образующиеся в результате окисления водорода топлива и испарения содержащейся в нем влаги. Температура продуктов сгорания в бомбе близка к температуре окружающей среды, т.е. значительно ниже значения температуры точки росы, поэтому происходит конденсация водяных паров и, следовательно, выделяется соответствующее количество теплоты, при учете которой из опыта находят высшую теплоту сгорания Q в р.
На практике обычно температура продуктов сгорания, покидающих теплоэнергетическую установку, выше температуры точки росы, и вода, содержащаяся в них, выходит в виде пара, с которым бесполезно теряется и теплота конденсации. Поэтому для оценки реальной теплотворной способности топлив используется понятие низшей теплоты сгорания Q н р, которая представляет собой количество теплоты, выделившейся при полном сгорании 1 кг топлива, без учета теплоты, выделившейся при конденсации водяных паров, содержащихся в продуктах сгорания. Она меньше высшей на величину неиспользованной теплоты, выделяющейся при конденсации водяных паров, содержащихся в продуктах сгорания
QнР=QвР – 25.(9.НР+WР), (13)
где QнР – низшая теплота сгорания рабочей массы топлива, кДж/кг;
QвР – высшая теплота сгорания рабочей массы топлива, кДж/кг;
25 – теплота парообразования при температуре 0 °С и атмосферном давлении, кДж/кг;
9 – коэффициент, показывающий, что при сгорании 1 кг водорода в соединении с кислородом образуется 9 кг воды.
Теплота сгорания горючих газов определяется в такой же калориметрической установке или в калориметре, в котором теплота сгорающего топлива полностью поглощается водой, проходящей через калориметр. Полученные значения высшей теплоты пересчитывают в QнРпо формуле (13).
Высшая теплота сгорания используется для сравнения тепловой ценности отдельных топлив, низшая – во всех технических расчетах.
Теплоту сгорания твердого и жидкого топлив, кДж/кг, при известном их элементарном составе приближенно можно вычислить по эмпирическим формулам, из которых наиболее распространена формула Д.И. Менделеева
QвР = 339 · СР + 1256 · HР – 109 · (OР – SлР); (14)
QнР = 339 · СР + 1256 · HР – 109 · (OР – SлР) – 25 · (9·НР + WР), (15)
где CР, HР, OР, SР, WР – содержание в рабочей массе топлива отдельных химических элементов в процентах.
При определении низшей удельной теплоты сгорания последний член суммы учитывает теплоту, поглощенную при испарении влаги топлива и при переходе в пар воды, образовавшейся при горении водорода. Более точно теплоту сгорания определяют экспериментально.
Низшую объемную теплоту сгорания (кДж/м3) газообразного топлива определяют сложением тепловых эффектов реакций горения горючих газов, содержащихся в сухом топливе, по формуле
QнР =127.СО+108.Н2+358.СН4++590.С2Н4+555.С2Н2+635.С2Н6+913.С3Н8+
+1185.С4Н10+1465.С5Н12+234.Н2S. (16)
Но не все составляющие, входящие в состав рабочей массы топлива, выделяют теплоту при горении. Влага топлива при переходе в пар поглощает теплоту; сера, входящая в состав сульфатов, при их диссоциации также поглощает теплоту.
Сама по себе теплота сгорания топлива не влияет на экономичность процесса горения, однако величина теплоты сгорания в значительной степени зависит от содержания в топливе балласта (влаги, золы), влияние которого было рассмотрено выше. По этим причинам теплота сгорания топлива и рассматривается как один из факторов, определяющих экономичность горения.
Путем смешивания топлив разных марок можно значительно повысить экономичность процесса горения.
Расход топлива зависит от его теплоты сгорания, которая для различных топлив изменяется в больших пределах. Так, теплота сгорания твердых топлив колеблется от 8х103 – 12х103 кДж/кг у торфа, до 25х103 – 26х103 кДж/кг у каменных углей; жидких топлив – от 40х103 кДж/кг у мазутов и до 47х103 кДж/кг у бензинов. Еще больший разброс в теплотах сгорания у газов: если у доменного газа 33,3х103 кДж/м3, то у попутных газов нефтяных месторождений она поднимается до 47х103 кДж/м3.
В силу этого обстоятельства – учет и планирование расхода топлива, контроль за его экономным потреблением сильно затруднены не только в общегосударственных масштабах, но и в пределах любого предприятия. Поэтому для сравнения тепловой ценности различных топлив, вариантов замен одного топлива другим, составления норм расхода топлива и планирования его потребности введены такие технико-экономические понятия, как условное топливо и топливные эквиваленты.
Условное топливо. Условнымназывается топливо, имеющее теплоту сгорания 29302 кДж/кг. Эта величина принята как отправная для планирования расхода и отчета об использовании топлива.
Относительная ценность различных топлив рассматривается в сравнении с условным с помощью топливных эквивалентов.
Топливным эквивалентомназывается отношение низшей теплоты сгорания рабочей массы реального топлива к теплоте сгорания условного топлива
Эт = 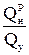 , (17)
, (17)
где Эт – топливный эквивалент;
Qу – теплота сгорания условного топлива, кДж/кг.
Зольность и влажность. Зола и влага снижают качество топлива, являются нежелательными примесями. Влага снижает теплоту сгорания, затрудняет воспламенение топлива; влажное топливо труднее транспортировать. Зола представляет собой минеральную массу. Она может содержаться в веществе, послужившем образованию топлива, или попасть в него при залегании в недрах земли как случайная примесь. Зола препятствует полному сгоранию топлива, образуя на поверхности кусков горящего топлива воздухонепроницаемый слой. Если зола плавится, то спекшиеся ее куски образуют шлак, еще более препятствующий выгоранию кокса, чем рассыпчатый зольный остаток.
Сернистость. Сера является нежелательной примесью в топливе, несмотря на то, что она в виде серного колчедана повышает ее теплоту сгорания. При горении серы образуются ядовитые сернистый SO2 и серный SO3 газы, присутствие которых в рабочем помещении даже в незначительных количествах ухудшает условия труда. Присутствие в среде при тепловой обработке этих газов ухудшает качество готовой продукции. Во влажной среде при низких температурах эти газы образуют пары сернистой Н2SO3 и серной Н2SO4 кислот, вызывающие коррозию металлических частей тепловых установок.
Летучие горючие вещества и коксовый остаток. Твердое топливо при нагревании без доступа воздуха начинает разлагаться. Сначала из него испаряется влага, затем выделяются газообразные продукты, называемые летучими горючими веществами. В смеси с воздухом они горят длинным пламенем. Чем больше в топливе летучих веществ, тем оно быстрее загорается и дольше горит пламенем. После выделения летучих веществ остается твердый остаток, называемый коксом. По составу кокс близок к углероду с примесью золы. Он горит без пламени, тлея в кусках.
Технические свойства жидкого топлива. Жидкое топливо имеет свои специфические свойства, определяющие условия его транспортирования, хранения и сжигания.
Вязкостьположена в основу маркировки мазута. В зависимости от вязкости топлива выбирают условия его транспортирования по трубопроводам в цистернах, перекачки его в хранилища, распыливания форсунками при сжигании.
Плотность – особенно важное свойство для мазутов. С повышением плотности обычно увеличивается их вязкость, при повышении температуры плотность мазутов уменьшается.
Температура застывания – такая температура, при которой топливо теряет свою текучесть. От температуры застывания зависит необходимость подогрева его при транспортировании и распыливании.
Температура вспышки– такая температура, при которой отделившиеся от поверхности жидкого топлива пары образуют с окружающим воздухом смесь, вспыхивающую при поднесении к ней пламени, однако скорость образования паров недостаточна для продолжения горения. При хранении жидкого топлива возникает опасность пожаров на складах.
Температура воспламенения – это такая, при которой нагреваемое в стандартных условиях топливо загорается при поднесении к нему пламени и горит не менее пяти секунд.
Основные виды топлива
Древесина – это твердое топливо, используемое преимущественно в мелких котельных установках. Широкое применение имеют отходы деревообделочного производства: щепа, стружки, опилки, кора и др. Влажность воздушно-сухих дров не превышает 25 %, полусухих – 35 %, свежесрубленных – 50 %. Опилки обычно имеют влажность 45-60 %. Дрова как топливо характеризуются высоким выходом летучих горючих веществ – до 85 % и незначительным содержанием золы – в среднем до 1 %, лишь в сплавных дровах зольность повышается до 5 %. Следовательно, балласт дров определяется в основном их влажностью, от которой и зависит теплота сгорания.
Древесина является веществом, из которого образовались другие виды естественного твердого топлива при ее разложении в недрах земли без доступа воздуха в условиях высокой влажности. Разлагаясь, древесина постепенно беднела кислородом и обогащалась углеродом.
Торф относится к местным видам топлива. Он является продуктом разложения растительности во влажных условиях без доступа воздуха. По своему составу и многим техническим свойствам торф мало отличается от древесины: так в его горючей массе содержится немного больше углерода и меньше кислорода, что объясняется большей степенью его разложения – обуглероживания. Торф также почти не содержит серы, имеет высокую влажность и небольшую теплоту сгорания. как топливо по своим свойствам близок к дровам. Влажность торфа колеблется в зависимости от способа добычи, условий сушки и хранения от 30-40 до 50-55 %. Зольность торфа колеблется от 7 до 15 %.
Следующей за торфом стадией разложения растительного вещества является образование ископаемых углей. Так как процесс обуглероживания растительного вещества протекал не скачкообразно, а постепенно, то ископаемые угли характеризуются разной степенью разложения и в зависимости от этого бывают бурые угли, каменные угли и антрациты.
Бурый угольотносят к самым молодым углям. Его цвет меняется от бурого до черного, он лишен блеска, имеет пористую структуру, небольшую механическую прочность, содержит много влаги, соединяется легко с кислородом воздуха и при длительном хранении на воздухе сильно выветривается и рассыпается в порошок. Кроме того, он обладает большой склонностью к самовозгоранию. По своей структуре отличается повышенным содержанием балласта и необычно высокой гигроскопичностью, вследствие чего влажность бурых углей 17-55 %. Бурые угли не спекаются, отличаются большим выходом летучих (33,5-58,5 %) на горючую массу и зольностью на сухую массу (10,5-34 %), высоким содержанием серы (0,6- 5,9 %).
Каменный уголь применяют непосредственно как топливо или перерабатывают на кокс. По виду кокса различают угли неспекающиеся (порошкообразный кокс) и спекающиеся (сплавленный кокс, иногда вспученный). Каменные угли довольно плотны и малопористы и содержание внешней влаги в них значительно ниже, чем в бурых углях. Многие каменные угли обладают повышенной механической прочностью. В хранении они более устойчивы, меньше подвержены самовозгоранию, а некоторые их виды совсем не самовозгораются.
Антрацитотносится к старейшим по происхождению каменным углям, отличается большой твердостью, трудно загорается, горит коротким пламенем, хорошо выдерживает перегрузки и перевозки. Переходным между каменными углями и антрацитом является полуантрацит. Антрацит и полуантрацит не самовозгораются.
Горючие сланцы являются продуктами разложения растительных остатков, оседавших на дне больших водоемов; смешиваясь с минеральными осадками, образовывалось илистое вещество – сапропель, которое обогащалось водородом, уплотнялось и превращалось в горючие сланцы.
Из-за низких тепловых качеств горючие сланцы в большом количестве идут на переработку для получения из них более ценного газообразного (сланцевого газа) и жидкого топлива, а также газоообразных химических продуктов. При сжигании сланцев образуется очень большое количество золы (64,5 %). Выход летучих у сланцев очень высок – до 90 %, влажность 13 %.
Естественное жидкое топливо – нефть, состоящая из смеси различных углеводородов, идет главным образом на переработку – фракционную перегонку. Из нефти получают топливо для тепловых двигателей и много ценных химических продуктов. Топливный мазут, являющийся остатком после отгонки из нефти бензина и керосина, бывает различных марок в зависимости от вязкости.
Жидкое топливо практически почти не содержит балласта, загорается легко
и горит длинным пламенем, так как состоит из одних летучих горючих веществ. Нефть благодаря малой вязкости легко транспортировать по нефтепроводам. При перевозке мазута с высокой температурой застывания в цистернах требуется его разогрев перед перекачкой в хранилище, а также перед подачей к форсункам. С этой целью в мазут, находящийся в цистернах, опускают змеевики с паровым обогревом.
Газообразное топливо по сравнению с жидким и твердым топливом обладает преимуществами: возможностью лучшего смешения газа с воздухом и, следовательно, сжиганием с меньшим избытком воздуха; легкостью подогрева перед сжиганием; отсутствием золы в топливе; транспортабельностью и удобством учета расхода газа; простотой обслуживания горелочных устройств и т. д.
Одновременно с указанными преимуществами газообразное топлива имеет и ряд недостатков: взрывоопасность; малая объемная масса, что создает дополнительные затруднения при хранении газа.
В этом отношении газ уступает и твердому, и жидкому топливу.
Однако перечисленные преимущества и сравнительно низкая стоимость добычи способствуют широкому внедрению газа и постепенному вытеснению твердого и жидкого топлива в различных отраслях промышленности.
Природный газ состоит главным образом из метана и некоторого количества тяжелых углеводородов. Балластом в газе являются азот, двуокись углерода и влага. Виды газа бывают различные как по месторождению, так и по составу.
Одним из преимуществ природного газа является отсутствие в его составе сернистых соединений, что для металлургической промышленности имеет особое значение.
К искусственным газам, применяемым в качестве топлива, относят коксовый, доменный и генераторные газы.
Коксовый газ является продуктом коксования углей и представляет собой те летучие продукты, которые получаются при термическом разложении угля (сырой или прямой газ). Сырой коксовый газ содержит ряд ценных примесей и балласт: смолу, аммиак, воду, сероводород и т.д., которые конденсируют и улавливают при первичной очистке газа. Газ, прошедший первичную очистку, называется обратным. Обратный газ подвергают дополнительной очистке для извлечения из него циана, окислов азота и серы. Удаление серы необходимо, так как ее присутствие в газе значительно снижает качество газа и сужает область его применения. Полученный газ называют очищенным коксовым газом. Состав и выход коксового газа зависит от вида коксуемых углей и режима коксования.
Коксовый газ применяется в чистом виде или в смеси с доменным газом.
Доменный газ получается как побочный продукт доменного производства. Состав доменного газа зависит от температуры дутья, обогащения его кислородом, состава и расхода кокса, состава шихты, давления на колошнике, применения природного газа.
Доменный газ содержит значительное количество пыли (60-70 г/м3), поэтому его необходимо подвергать очистке. Доменный газ применяется в воздухонагревателях доменных печей, в котельных установках, в печах с более высокой температурой (мартеновских и прокатных) доменный газ применяется в смеси с коксовым газом.
Генераторный газ – это продукт полного превращения твердого топлива в горючий газ под воздействием кислорода. Остатком при процессе газификации является только зола или шлак.
Генераторные газы могут быть получены в любом месте, где добывается или куда может быть завезено топливо. Процесс газификации проводится в специальных устройствах-газогенераторах.
Основы теории горения
Общая характеристика процессов горения топлива
Горением называется процесс взаимодействия топлива с окислителем, сопровождающийся выделением тепла. Роль окислителя в большинстве случаев выполняет кислород воздуха.
Для того, чтобы происходило горение, необходимо обеспечить тесный контакт между молекулами топлива и окислителя, т.е. необходимо смешать топливо с воздухом.
Следовательно, процесс горения складывается из двух стадий:
- смешение топлива с воздухом;
- горение топлива.
Во время протекания второй стадии происходят сначала воспламенение, а затем уже и горение топлива.
В процессе горения образуется пламя, в котором протекают реакции горения составляющих топлива, и происходит выделение тепла. В технике при сжигании газообразного, жидкого и твердого пылевидного топлива применяют так называемый факельный метод сжигания. Факел – это частный вид пламени, образующего при подаче топлива и воздуха в рабочее пространство печи в виде струй, постепенно перемешивающихся друг с другом.
При факельном сжигании топлива аэродинамическую основу процесса составляют струйные течения. Поскольку при факельном сжигании характер движения струй может быть ламинарным и турбулентным, в процессах смешения большая роль принадлежит молекулярной и турбулентной диффузии.
Ламинарным называют такое движение, когда струйки газа протекают параллельно одна другой, не пересекаясь. При турбулентном режиме в потоке возникает множество вихрей, что приводит к интенсивному перемешиванию газа.
На практике при создании устройств для сжигания топлива (горелок, форсунок) применяют различные конструктивные средства (устройства, направляющие струи под углом друг к другу, устройства для закручивания струй и др.) с тем, чтобы организовать смешение топлива с воздухом так, как это необходимо для каждого конкретного случая.
Различают гомогенное и гетерогенное горение. При гомогенном горении тепло- и массообмен происходят между телами, находящимися в одинаковом агрегатном состоянии. Гомогенное горение свойственно газообразному топливу и происходит в объеме. При гетерогенном горении тепло- и массообмен происходят между телами, находящимися в разных агрегатных состояниях (обмен происходит
между газом и поверхностью частиц топлива). Такое горение свойственно жид-
кому и твердому топливам.
Гомогенное горение может протекать в кинетической и диффузионной областях. При кинетическом горении полное перемешивание топлива с воздухом осуществляют предварительно, и в зону горения подают заранее подготовленную топливо – воздушную смесь. При диффузионном гомогенном горении поцессы горения и смешения не разделены и совершаются практически одновременно.
Возникновение пламени
Возникновение пламени (воспламенение топлива) может произойти только после того, как будет достигнут необходимый контакт молекул топлива и окислителя. Любая реакция окисления протекает с выделением тепла. Вначале реакция окисления идет медленно с выделением малого количества тепла. Однако выделяющееся тепло способствует повышению температуры и ускорению реакции, что, в свою очередь, приводит к более энергичному выделению тепла, которое оказывает благоприятное влияние на развитие реакции. Таким образом, происходит постепенное нарастание скорости реакции до момента воспламенения, после чего реакция идет с очень большой скоростью и носит лавинный характер. В реакциях окисления неразрывно связаны друг с другом механизм химической реакции и тепловые характеристики процесса окисления. Первичным фактором является химическая реакция и вторичным – выделение тепла. Оба эти явления тесно связаны между собой и влияют друг на друга.
В практических условиях обычно прибегают к искусственному поджиганию топлива, вводя в зону горения определенное количество тепла, что приводит к резкому ускорению момента достижения воспламенения.
В большинстве случаев выделение тепла при горении сопровождается потерями тепла в окружающую среду. Соотношения между выделяемым количеством тепла и теплом, передаваемым в окружающую среду, имеет большое значение для развития процесса воспламенения топлива. При стационарном состоянии процесса количество выделяющегося в единицу времени тепла должно быть равно количеству теряемого тепла. По мере окисления топлива значение температуры будет возрастать. И температура достигнет своего наибольшего значения, когда тепловыделение еще равно теплоотдаче. При дальнейшем увеличении тепловыделения начинается переход к резкому нестационарному выгоранию смеси, проходящему с бурным нарастанием температуры и скорости реакции, т. е. происходит тепловой взрыв.
Температура, при которой начинается нестационарный процесс выгорания смеси, называется температурой воспламенения. Таким образом, температура воспламенения не является физико-химической константой, определяемой только свойствами смеси, она определяется условиями протекания процесса, т. е. характером теплообмена с окружающей средой (температурой, формой сосуда и др.). Температуры воспламенения различных топлив приведены в таблице 2.
Таблица 2 – Температуры воспламенения в воздухе при атмосферном давлении
| Вещество | Температура воспламенения, К | Вещество | Температура воспламенения, К | ||
| минимальная | максимальная | минимальная | максимальная | ||
| Водород | 803 | 863 | Ацетилен | 608 | 773 |
| Окись углерода | 883 | 931 | Бензин | 683 | 833 |
| Метан | 918 | 1123 | Керосин | - | 593 |
| Этан | 803 | 867 | Нефть | - | 498 |
| Пропан | 803 | 861 | Бурый уголь | - | 723 |
| Бутан | 763 | 842 | Кокс | 873 | 973 |
Кроме температуры, большое влияние на процесс зажигания топлива оказывает концентрация горючей составляющей в смеси. Существуют такие минимальная и максимальная концентрации горючей составляющей, ниже и выше которых вынужденное воспламенение произойти не может. Такие предельные концентрации называются концентрационными пределами воспламенения, значения их для некоторых газов приведены в таблице 3. Чтобы установить пределы воспламенения промышленных газов, которые являются смесью различных горючих компонентов, пользуются правилом Ле-Шателье, по которому
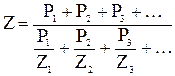 , (18)
, (18)
где Z - искомый нижний или верхний предел воспламенения,
Z1, Z2, Z3 - соответствующие пределы воспламенения для горючих компонентов топлива,
P1, P2, P3 – процентное содержание отдельных горючих компонентов в топливе.
Таблица 3 – Концентрационные пределы воспламенения, %
| Вещество | Газо-воздушная смесь | Газо-кислородная смесь | ||
| нижний предел | верхний предел | нижний предел | верхний предел | |
| Водород | 9,5 | 65,2 | 9,2 | 91,6 |
| Окись углерода | 15,6 | 70,9 | 16,7 | 93,5 |
| Метан | 6,3 | 11,9 | 6,5 | 51,9 |
Негорючие составляющие газообразного топлива влияют на границы воспламенения, они повышают нижний и понижают верхний пределы воспламенения.
Дата добавления: 2019-01-14; просмотров: 2096; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
