Реакции металлов со сложными окислителями
В табл. 3 представлены обобщенные данные по химическим свойствам металлов. Основное внимание в ней уделяется зависимости свойств металлов от величины стандартного электродного потенциала.
Изучите табл. 3 и запомните следующее:
1) по мере возрастания величины стандартного электродного потенциала восстановительная активность металлов в водных растворах ослабевает. Так, Mn окисляется легче, чем Zn, Bi и все другие металлы, стоящие в ряду стандартных электродных потенциалов правее марганца;
2) одновременно окислительная активность катионов металлов Men+ возрастает (Fe2+ более сильный окислитель, чем Zn2+, Mg2+ и другие катионы металлов с меньшей величиной j0);
3) величиной стандартного электродного потенциала можно объяснить различие в отношении металлов к разбавленным и концентрированным кислотам, и щелочам, можно обосновать способы получения металлов и нахождение их в природе.
Таблица 3. Общие свойства металлов
| № | Свойства металла | Li K Rb Ba Ca Na Mg Be Al Mn Zn Cr Ga Fe Cd Ti Tl Co Sn Pb | H | Sb Bi As Cu Hg Ag Pd Pt Au | |||||||||
| j0, В | –3,04 –2,71 –1,70 –0,76 –0,44 –0,13 | 0 | +0,24 +0,34 +0,80 +1,50 | ||||||||||
| 1 | Нахождение в природе | Только в виде соединений | В виде соединений | Самород-ное состояние | |||||||||
| 2 | Получение | Электролиз расплава | Восстановление оксидов, электролиз водных растворов
| Нагрев соеди-нений | Отмыв от пустой породы | ||||||||
| 3 | Восстановитель-ная активность металла |
® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® Ослабевает ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® | |||||||||||
| 4 | Окислительная активность катиона Меn+ |
® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® Возрастает ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® | |||||||||||
| 5 | Окисляемость кислородом | Быстро окисляются | Окисляются на воздухе при комнатной температуре | Окисляются | Не окисляются | ||||||||
| 6 | Взаимодействие с водой | Вытесняют Н2 при комнатной темп-ре | Вытесняют Н2 при нагревании | С водой не взаимодействуют | |||||||||
| 7 | Взаимодействие с HCl(конц), (разб), H2SO4(pазб) |
| Не взаимодействуют | ||||||||||
| 8 | Взаимодействие с H2SO4(конц) |
|
| Не реаги-руют | |||||||||
| 9 | Взаимодействие с HNO3(разб) |
|
| Не реаги-руют | |||||||||
| 10 | Взаимодействие с HNO3(конц) |
| Не реаги-руют | ||||||||||
Рассмотрим более подробно уравнения реакций металлов с водой и различными разбавленными и концентрированными кислотами:
а) реакция металла с водой происходит с образованием гидроксида металла и выделением водорода Н2 для всех металлов, стандартный электродный потенциал которых меньше –0,41 В. Причем некоторые металлы пассивируются водой вследствие образования защитной пленки нерастворимого гидроксида (Al(OH)3, Zn(OH)2), например, j0Ca/Ca2+ = –2,86 В.
|
|
|
Ca + 2H2O ® Ca(OH)2 + H2
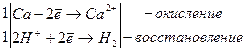
б) реакция металлов с соляной кислотой HCl как концентрированной, так и разбавленной происходит с образованием хлорида металла и выделением водорода Н2 для всех металлов, расположенных в ряду стандартных электродных потенциалов левее водорода, то есть стандартный электродный потенциал которых меньше нуля, например, j0Zn/Zn2+ = –0,76 В.
Zn + 2HCl ® ZnCl2 + H2
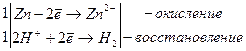
в) реакция металла с разбавленной серной кислотой H2SO4 происходит с образованием сульфата металла и выделением водорода Н2 для всех металлов, расположенных в ряду стандартных электродных потенциалов левее водорода, то есть стандартный электродный потенциал которых меньше нуля. Следует отметить, что некоторые металлы, например, свинец, пассивируются в растворах соляной и серной кислот нерастворимыми хлоридами или сульфатами соответственно, например, j0Fe/Fe2+ = –0,44 В.
Fe + H2SO4 ® Fe SO4 + H2
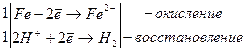
г) при составлении уравнений реакций металлов с концентрированной серной кислотой необходимо помнить следующее: в зависимости от величины стандартного электродного потенциала металла и температуры продукты восстановления серной кислоты могут быть различными (водород не выделяется).
|
|
|
Н2SO4 → SO2 → S → H2S
Все металлы, включая Ag, при комнатной температуре реагируют с концентрированной серной кислотой. Реакция, как правило, сопровождается выделением оксида серы (IV), например, j0Mn/Mn2+ = –1,185 В.
Mn + Н2SO4 → MnSO4 + SO2 + H2O
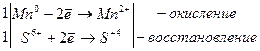
Если стандартный электродный потенциал металла значительно меньше нуля (например, металлы Са, Mg, Al, Zn), то продуктами реакции является се-
ра S или сероводород H2S и сульфат металла, например, j0Al/Al3+ = –1,70 В.
8Al + 15Н2SO4 → 4Al2(SO4)3 + 12H2O
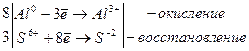
Следует отметить, что некоторые металлы, например железо, концентрированная серная кислота пассивирует в результате образования оксидной пленки;
д) при составлении уравнений реакций металлов с концентрированной азотной кислотой пользуются схемой восстановления азотной кислоты:
HNO3 → NO2 → N2O3 → NO → N2O → N2 → NH3 (NH4NO3)
Практически все металлы, кроме Au, Pt, Ta, Rh, Ir, окисляются концентрированной азотной кислотой с образованием нитрата и выделением газа NO2, например, j0Ag/Ag3+ = +0,799 В.
|
|
|
Ag +2HNO3 → AgNO3 + NO2 +H2O
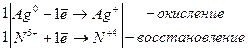
Многие конструкционные металлы (например, Fe, Cr, Al) концентрированная азотная кислота на холоде пассивирует (происходит образование оксидной пленки, не растворимой в кислоте);
е) в зависимости от величины стандартного электродного потенциала металла и степени разбавления азотной кислоты, в качестве продуктов восстановления разбавленной азотной кислоты выделяются любые продукты, кроме NO2 (смотрите схему восстановления азотной кислоты), например: j0Cu/Cu2+ = +0,338 В,
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
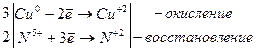
j0Mg/Mg2+ = –2,372 В,
4Mg + 10HNO3 → 4Mg(NO3)2 + N2O + 5H2O
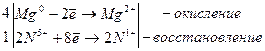
j0Al/Al3+ = –1,70 В;
8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
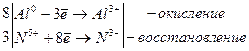
ж) благородные металлы (Au, Pt) растворяются в «царской водке» (1 объем концентрированной HNO3 и 3–4 объема концентрированной HCl), например, j0Au/Au3+ = + 1,498 В.
Au + HNO3 + 3HCl → AuCl3 + NO + H2O
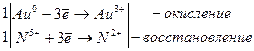
В горячей (более 230 0С) концентрированной селеновой кислоте H2SeO4 растворяется металлическое золото, образуется селенат золота (III) Au2(SeO4)3, например, j0Au/Au3+ = +1,498 В.
2Au + 6H2SeO4 → Au2(SeO4)3 + 3SeO2 + 6H2O
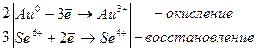
В избытке HCl образуется комплексная золотохлористоводородная кислота:
AuCl3 + HCl → H[AuCl4]
з) существуют особые случаи взаимодействия металлов с кислотами. К ним относят реакции поливалентных металлов (Sn, Sb, V, Mo, Ti, W), которые в высших степенях окисления проявляют неметаллические свойства. В реакциях с концентрированной HNO3, либо в смесях HNO3 и HCl, HNO3 и HF, они, как правило, окисляются до высшей степени окисления с образованием соответствующих кислот, например, j0Sn/Sn4+ = +0,01 В.
Sn + 4HNO3 → H2SnO3 + 4NO2 + H2O
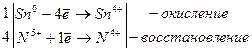
В реакциях с Sb, V, Ti образуются соответственно сурьмяная H3SbO4, ванадиевая HVO3 и титановая H2TiO3 кислоты.
Металлы W, Mo, Pt взаимодействуют со смесью кислот HNO3 и HF с образованием комплексных кислот H2[WF8], H2[MoF6] и H2[PtF6] соответственно, например, j0W/W6+ = + 0,68 В.
W + 2HNO3 + 8HF → H2[WF8] + 2NO + 4H2O
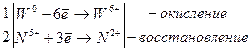
Металлы р- и d-семейства, являющиеся, как правило, амфотерными элементами (Al, Ga, Zn, Sn, Pb и др.) окисляются в водных растворах щелочей с образованием солей (алюминат, галлат, цинкат, станнит, плюмбит и др.) и выделением продуктов восстановления.
Если стандартный электродный потенциал металла меньше нуля, то восстанавливается водород.
Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Если стандартный электродный потенциал больше нуля, то для окисления необходим более сильный окислитель, чем вода, например перекись водорода Н2О2.
2Sb + 6NaOH + 3H2O2 → 2Na3[Sb(OH)6]
Приложение
Стандартные электродные потенциалы φ0 в водных растворах при 25оС
| Элемент | Электродный процесс | φ0, В |
| 1 | 2 | 3 |
| Ag | Ag+ + 1e = Ag | 0,80 |
| Al | AlO2- + 2H2O + 3e = Al + 4OH- Al3+ + 3e = Al | –2,35 –1,66 |
| Au | Au3+ + 3e = Au Au+ + 1e = Au | 1,50 1,69 |
| Ba | Ba2+ + 2e = Ba | –2,90 |
| Bi | Bi3+ + 3e = Bi | 0,21 |
| Br | Br2(ж) + 2e = 2Br- | 1,07 |
| Ca | Ca2+ + 2e = Ca | –2,87 |
| Cd | Cd2+ + 2e = Cd | –0,40 |
| Cl | Cl2 + 2e = 2Cl- | 1,36 |
| Co | Co2+ + 2e = Co Co3+ + 1e = Co2+ | –0,28 1,81 |
| Cr | Cr3+ + 3e = Cr Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O | –0,74 1,33 |
| Cu | Cu2+ + 2e = Cu Cu+ + 1e = Cu | 0,34 0,52 |
| F | F2 + 2e = 2F- | 2,87 |
| Fe | Fe2+ + 2e = Fe Fe3+ + 3e = Fe [Fe(CN)6]3- + 1e = [Fe(CN)6]4- Fe3+ + 1e = Fe2+ | –0,44 –0,04 0,36 0,77 |
| H | H2 + 2e = 2H- 2H+ + 2e = H2 2H2O + 2e = H2 + 2OH- (pH = 7) | –2,25 0,00 –0,41 |
| Hg | Hg22+ + 2e = 2Hg Hg2+ + 2e = Hg | 0,79 0,85 |
| I | I2(кр) + 2e = 2I- 2IO3- + 12H+ + 10e = I2(кр) + 6H2O | 0,54 1,19 |
| K | K+ + 1e = K | –2,92 |
| Li | Li+ + 1e = Li | –3,04 |
| Mg | Mg2+ + 2e = Mg | –2,36 |
| Mn | Mn2+ + 2e = Mn MnO42- + 2H2O + 3e = MnO2 + 4OH- MnO2 + 4H+ + 2e = Mn2+ + 2H2O MnO4- + 8H+ + 5e = Mn2+ + 4H2O | –1,05 0,60 1,23 1,51 |
| Na | Na+ + 1e = Na | –2,71 |
| Ni | Ni2+ + 2e = Ni | –0,25 |
| Продолжение таблицы | ||
| 1 | 2 | 3 |
| N | NO3- + 4H+ + 3e = NO + 2H2O | 0,96 |
| O | O2 + 2H2O + 4e = 4OH- O2 + 2H+ + 2e = H2O2 O2 + 4H+ + 4e = 2H2O H2O2 + 2H+ + 2e = 2H2O | 0,40 0,68 1,23 1,78 |
| Pb | Pb2+ + 2e = Pb PbSO4 + 2e = Pb + SO42- PbO2 + 4H+ + SO42- +2e = PbSO4 + 2H2O | –0,13 –0,36 1,69 |
| Pt | Pt2+ + 2e = Pt | 1,19 |
| S | S2O82- + 2e = 2SO42- S0 + 2H+ + 2e = H2S | 2,01 0,17 |
| Sn | Sn2+ + 2e = Sn Sn4+ + 2e = Sn2+ | –0,14 0,15 |
| Zn | ZnO22- + 2H2O + 2e = Zn + 4OH- Zn2+ + 2e = Zn | –1,22 –0,76 |
Дата добавления: 2018-11-24; просмотров: 271; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

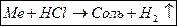
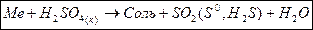 (пассивируются Al и Fe)
(пассивируются Al и Fe)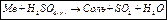
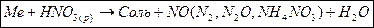 (пассивируется Ti)
(пассивируется Ti)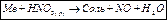
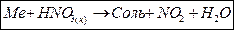 (пассивируются Al, Ni, Cr, Ti и Fe)
(пассивируются Al, Ni, Cr, Ti и Fe)