Примеры тестов для контроля исходных знаний
МИНОБРНАУКИ РОССИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Тверской государственный технический университет» (ТвГТУ) Кафедра биотехнологии и химии Г.Н. Демиденко, М.Е. Григорьев Общие свойства металлов Методические указания к самостоятельной работе для студентов нехимических специальностей по курсу «Химия» очной формы обучения Тверь 2014 УДК 546.3(075.8) ББК 24.я7 Рецензент доцент кафедры химии к. х. н. Соболев А.Е. Демиденко, Г.Н. Общие свойства металлов: метод. указания / Г.Н. Демиденко, М.Е. Григорьев. Тверь: ТвГТУ, 2014. 24 с. Предназначены для самостоятельной подготовки студентов нехимических специальностей при изучении раздела химии «Свойства металлов». Содержат контрольные вопросы, основные аспекты химии металлов и примеры уравнений химических реакций. Являются составной частью курса «Химия» для студентов нехимических специальностей, обучающихся по направлению подготовки бакалавров Электроэнергетика и электротехника, Конструкторско-технологическое обеспечение машиностроительных производств, Теплоэнергетика и теплотехника, Наземные транспортно-технологические комплексы, Природообустройство и водопользование, Технология транспортных процессов, Биотехнические системы и технологии, Стандартизация и метрология и направлению подготовки специалистов Наземные транспортно-технологические средства очной формы обучения. Рассмотрены и рекомендованы к изданию на заседании кафедры биотехнологии и химии (протокол № 13 от 7 июля 2014 г.). © Тверской государственный технический университет, 2014 © Демиденко Г.Н., Григорьев М.Е. 2014 Введение Все простые вещества можно разделить на металлы и неметаллы, поскольку их свойства существенно различаются (табл. 1). Таблица 1. Общие характерные свойства металлов и неметаллов Характерные свойства Металлы Неметаллы Металлическая связь в кристаллах Ковалентная связь в большинстве простых веществ Металлический блеск Различная окраска Хорошие теплопроводность и электрическая проводимость Плохие теплопроводность и электрическая проводимость Ковкость и пластичность Как правило, хрупкость твердых тел Восстановители Многие из них окислители Оксиды имеют ионный характер и при растворении в воде образуют основные растворы Большинство оксидов – ковалентные соединения, при растворении в воде образуют кислотные растворы Граница между металлами и неметаллами размыта, между ними находятся полуметаллы. Полуметаллы обладают свойствами как металлов, так и неметаллов. Например, серый мышьяк имеет металлический блеск и электрическую проводимость, однако он хрупок, а желтый мышьяк – имеет чисто неметаллические свойства. Большинство элементов являются металлами. К металлам относятся s-, p-, d- и f-металлы, а к неметаллам относятся р-элементы и 2 s-элемента. Из всех известных нам химических элементов более 80 являются металлами. В машино- и приборостроении они относятся к основным конструкционным материалам. В технике (но не в химии) к металлам часто причисляют также и некоторые металлоподобные соединения металлов (карбиды, нитриды и др.), обладающие комплексом физико-химических свойств, характерных для металлов.
|
|
|
|
|
|
Перечень учебных элементов
1. Металл.
2. s-металлы.
3. p-металлы.
4. d-металлы.
5. f-металлы.
6. Металличность.
|
|
|
7. Энергия ионизации.
8. Сродство к электрону.
9. Электроотрицательность.
10. Металлическая связь.
11. Кристаллическое строение металла.
12. Физические свойства металлов.
13. Химические свойства металлов.
14. Окисление металлов простыми окислителями.
15. Номенклатура бинарных соединений металлов с неметаллами.
16. Электродный потенциал как мера активности металлов
в водных растворах.
17. Окисление металлов сложными окислителями.
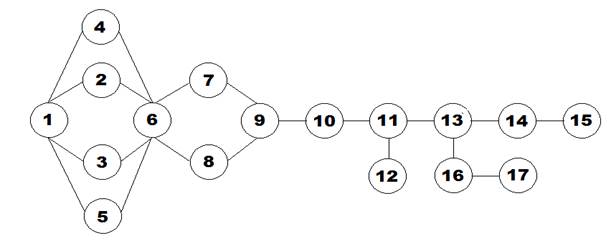
Граф логической структуры темы
Контрольные вопросы
1. Электронное строение атома.
2. Классификация элементов по электронному строению.
3. Валентность элемента.
4. Степень окисления атома.
5. Окислительно-восстановительные реакции.
6. Металл. Металличность.
7. Энергия ионизации. Сродство к электрону. Электроотрицательность атома.
8. Металлическая связь.
9. Кристаллическое строение металлов.
10. Общие физические свойства металлов.
11. Электродный потенциал. Ряд стандартных электродных потенциалов металлов.
Примеры тестов для контроля исходных знаний
Вопрос 1. Какие элементы называются металлами?
Ответ. Металлы – это элементы, проявляющие металличность, то есть способность окисляться с образованием простого катиона Men+. При этом металл теряет 1–2, реже 3 электрона с наружного электронного слоя.
|
|
|
Вопрос 2. Запишите краткие электронные формулы для s-металлов, p-металлов, d-металлов, f-металлов.
Ответ. Краткие электронные формулы, отражающие строение валентного слоя, будут следующими:
s-металлы 1 и 2 групп периодической системы элементов: ns1; ns2.
p-металлы 3, 4, 5, 6 групп периодической системы элементов: ns2np1 (Al–Tl); ns2np2 (Sn–Pb); ns2np3 (Sb–Bi); ns2np4 – Po.
d-металлы побочных подгрупп 1–8 групп периодической системы элементов: ns2(n-1)d1-10.
f-металлы (лантаноиды и актиноиды): ns1(n-1)d0-2(n-2)f2-14.
Вопрос 3. Как изменяется металличность в периоде, главной и побочной подгруппах периодической системы элементов?
Ответ. В периоде величина электроотрицательности атома, мера металличности атома, возрастает, следовательно от начала к концу периода металлические свойства ослабевают, а неметаллические – усиливаются. В главных подгруппах периодической системы элементов металличность усиливается, в побочных подгруппах с увеличением номера периода металличность ослабевает.
Вопрос 4. На основании электронного строения рассмотрите возможные степени окисления атома элемента № 25.
Ответ. Электронная формула элемента № 25 (Mn) выражается следующей схемой 1s22s22p63s23p64 s 2 3 d 5. Количество валентных электронов 7 (подчеркнуты). Элемент проявляет только положительную степень окисления, так как на внешнем электронном слое находятся только 2 электрона (4s2). Наименьшая степень окисления (кроме нулевой) равна +2. Высшая степень окисления равна +7 (соответствует, как правило, числу электронов валентного слоя). Промежуточные степени окисления +3, +4, +5, +6, (не все в равной мере устойчивы).
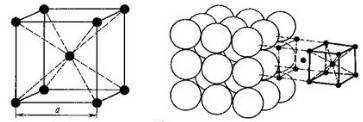
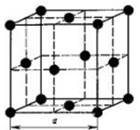
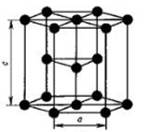
Вопрос 5. Охарактеризуйте кристаллическое строение металлов.
Ответ. Металлы образуют три типа кристаллических решеток:
кубическая объемноцентрированная решетка, кубическая гранецентрированная решетка, гексагональная плотная упаковка (рис. 1).
|
а | |
 б
б
|  в
в
|
| Рис. 1. Кристаллические решетки металлов: а – объемноцентрированная кубическая (ОЦК); б – гранецентрированная кубическая (ГЦК); в – гексагональная плотноупакованная (ГПУ) | |
В кристаллических решетках атомы металлов связаны металлической связью: атомные остовы (атомы, частично утратившие наружные электроны) связаны обобществленными электронами, находящимися в межузловом пространстве кристалла.
Вопрос 6. Каковы основные физические свойства металлов?
Ответ. К важнейшим физическим свойствам металлов, которые обусловлены металлической связью, относятся проводимость электрического тока, тепла, звука, электронная эмиссия, твердость, ударная вязкость.
Вопрос 7. Возможны ли следующие окислительно-восстановительные реакции? Напишите молекулярные уравнения реакций. Выразите электронными уравнениями процессы окисления и восстановления. Укажите окислитель и восстановитель.
1) Al + FeSO4 →
2) Ni + Pb(NO3)2 →
3) Cu + HCl →
Ответ. Запишем значения стандартных электродных потенциалов металлов: φоAl = –1,66 В; φоPb = –0,13 В; φоFe = –0,44 В; φоNi = –0,25 В;
φоCu = +0,34 В; φоH2|2H+ = 0 В.
Каждый металл способен окисляться катионами любых других металлов, для которых величина φо больше (наиболее положительна). Таким образом, возможны реакции 1 и 2.
1) 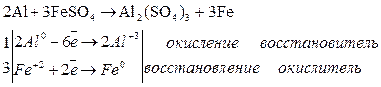
2) 
Дата добавления: 2018-11-24; просмотров: 199; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!