Методические указания для самостоятельной подготовки
Распространенность и состояние металлов в природе
К наиболее распространенным в природе металлам относятся алюминий, железо, кальций, натрий, калий, магний и титан. Распространенность их в литосфере (на глубину до 16 км) представлена
в табл. 2.
Таблица 2. Распространенность основных металлов в литосфере
| Элемент | Al | Fe | Ca | Na | K | Mg | Ti |
| Массовые доли, % | 8,8 | 4,65 | 3,6 | 2,64 | 2,5 | 2,1 | 0,57 |
| Молярные доли, % | 6,6 | 1,8 | 2,0 | 2,4 | 1,4 | 2,0 | 0,2 |
Распределение металлов в земной коре может быть равномерным (рассеянные металлы) или неравномерным (в виде месторождений). Наибольшая часть металлов может находиться в земной коре в свободном виде (в виде простых веществ): платиновые металлы, золото, серебро, ртуть. Остальные элементы находятся в виде химических соединений с другими элементами (в виде минералов). К наиболее распространенным соединениям относятся силикаты (K3AlSi3O8, KAl2(Si3O10)(OH)2, Mg3Si4O10H2 и др.), оксиды (Al2O3, Fe2O3, TiO2, CaO, CaTiO3 и др.), сульфиды (PbS, HgS, ZnS, CuS и др.), карбонаты (CaCO3, MgCO3, FeCO3 и др.), галогениды (CaF2, NaCl, MgCl2 и др.), сульфаты (CaSO4, BaSO4, MgSO4 и др.), фосфаты (CaAl6(PO4)4(OH)2·4H2O, Ca3(PO4)2 и др.).
Основные способы получения металлов
Металлы получают из руд, то есть исходного сырья, в котором содержится экономически приемлемое количество металла. По мере истощения руд уменьшается экономически приемлемое содержание в них металла и происходит повышение его стоимости.
|
|
|
Предварительно руда обрабатывается для увеличения концентрации металла путем отделения пустой породы и разделения остатка на различные фракции. Последующие операции заключаются в получении соединения металла, из которого удобно выделить металл тем или иным способом. Так как большинство металлов в природе находится в окисленном состоянии, то извлечение их основано на восстановлении из тех или иных соединений в растворах (при невысокой температуре) или расплавах (при повышенной температуре).
Восстановление проводят химическими и электрохимическими способами. Химическое восстановление заключается во взаимодействии соединений металлов с углем, водородом или металлами-восстановителями. Например, при взаимодействии оксидов железа со специально обработанным углем (коксом) образуется чугун. С помощью водорода получают вольфрам, молибден, кобальт и другие металлы, например по реакции:
WO3 +3H2 = W +3H2O.
Многие металлы производят путем взаимодействия соединений металлов с другими металлами, например:
BeF2 + Mg = Be + MgF2.
Таким способом получают кадмий, олово, хром, серебро, титан и другие металлы. Кроме магния восстановителями обычно служат цинк и алюминий. Электролизом из растворов осаждают медь, никель, серебро, хром, кадмий, индий, олово и другие металлы. Электролизом из расплавов осаждаются сильные восстановители, такие как щелочные металлы, магний и алюминий.
|
|
|
Получение чистых металлов
Свойства металлов зависят от содержания в них примесей. Например, титан долгое время не находил применения из-за хрупкости, обусловленной наличием примесей. После освоения методов очистки области применения титана резко расширились. Содержание лишь 0,03 % (масс. доли) мышьяка приводит к снижению электрической проводимости меди на 14 %. Особенно большое значение имеет чистота материалов в электронной и вычислительной технике и ядерной энергетике.
В зависимости от суммарной атомной доли примесей (от 10–1 до 10–10 %) различают 10 классов чистоты веществ. Если те или иные примеси особенно нежелательны для данной области применения материала, то оговаривают допустимое содержание этих примесей. Например, атомная доля бора, гафния и кадмия в материалах атомной энергетики не должна превышать 10–4 – 10–6 %. Следует отметить, что стоимость материалов возрастает по мере повышения их степени очистки.
|
|
|
Все методы очистки металлов можно разделить на химические и физико-химические.
Химические методы очистки заключаются во взаимодействии с теми или иными реагентами, образующими с основными металлами или примесями осадки или газообразные продукты. Из-за контакта металла с реагентами и материалами аппаратуры не удается достичь высокой степени чистоты металла.
Более высокую степень очистки дают транспортные химические реакции, в которых металл с реагентом образует газообразные продукты, передаваемые
в другую зону, где они разлагаются на чистый металл и исходный реагент, например:
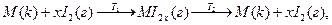
Физико-химические методы включают в себя электрохимические, дистилляционные, кристаллизационные и др.
При электрохимическом способе (рафинировании) очищаемый металл служит анодом, чистый металл осаждается на катоде электролизера, примеси переходят либо в раствор электролита, либо в виде осадка накапливаются
в шламе.
Дистилляционные методы заключаются в испарении жидкого (например, ртути) или расплавленного металла с последующей конденсацией паров. Отделение примесей обусловлено разной температурой испарения основного металла и примеси.
Кристаллизационные методы основаны на различном содержании примесей в твердом и расплавленном металле. Они включают зонную плавку, кристаллизационное вытягивание из расплава и др. Особенно широко применяют зонную плавку, заключающуюся в том, что вдоль слитка (стержня) медленно перемещается зона нагрева и, соответственно, зона расплавленного металла. Некоторые примеси концентрируются в расплаве и собираются в конце слитка, другие – в начале слитка. После многократных прогонок отрезают начальную и концевую части слитка, остается очищенная средняя часть металла.
|
|
|
Дата добавления: 2018-11-24; просмотров: 170; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
