Термодинамические процессы, при которых теплоемкость остается постоянной называются политропными.
Можно доказать, что уравнение политропы имеет вид:
p·Vn = const, (13.21)
где n = (C - Cp)/(C - Cv) - показатель политропы,
C - теплоемкость процесса.

| Изохорический процесс C = Cv, n = "бесконечность"; |

| Изохобарический процесс C = Cp, n = 0; |

| Изохотермический процесс C = "бесконечность", n = 1; |

| Адиабатический процесс C = 0, n = . |
Б 28
Идеальная тепловая машина и цикл Карно. К.П.Д. идеальной тепловой машины. Содержание второго закона К.П.Д. реальной тепловой машины.
Цикл Карно является идеальным термодинамическим циклом. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно[8][29].
Максимальное КПД достигается при обратимом цикле[8]. Для того, чтобы цикл был обратимым, из него должна быть исключена передача тепла при наличии разности температур. Чтобы доказать этот факт, предположим, что передача тепла при разности температур имеет место. Данная передача происходит от более горячего тела к более холодному. Если предположить процесс обратимым, то это означало бы возможность передачи тепла обратно от более холодного тела к более нагретому, что невозможно, следовательно процесс необратим[25]. Соответственно, преобразование тепла в работу может происходить только изотермически[Комм 4]. При этом обратный переход двигателя в начальную точку только путём изотермического процесса невозможен, так как в этом случае вся полученная работа будет затрачена на восстановление исходного положения. Так как выше было показано, что адиабатический процесс может быть обратимым — то этот вид адиабатического процесса подходит для использования в цикле Карно.
|
|
|
Всего при цикле Карно происходят два адиабатических процесса[29]:
1. Адиабатическое (изоэнтропическое) расширение (на рисунке — процесс 2→3). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
2. Адиабатическое (изоэнтропическое) сжатие (на рисунке — процесс 4→1). Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
Б 29
Теорема Клаузиуса, неравенство Клаузиуса. Энтропия, её физический смысл. Изменение энтропии при необратимых процессов. Основное уравнение термодинамики.
сумма приведенных теплот при переходе из одного состояния в другое не зависит от формы (пути) перехода в случае обратимых процессов. Последнее утверждение носит название теоремы Клаузиуса.
|
|
|
Рассматривая процессы превращения тепла в работу, Р. Клаузиус сформулировал термодинамическое неравенство, носящее его имя.
«Приведенное количество тепла, полученное системой в ходе произвольного кругового процесса, не может быть больше нуля»
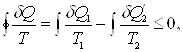
где dQ – количество тепла, полученного системой при температуре Т, dQ1 - количество тепла, получаемое системой от участков окружающей среды с температурой Т1, dQ¢2 – количество тепла, отдаваемое системой участкам окружающей среды при температуре Т2. Неравенство Клаузиуса позволяет установить верхний предел термического К.П.Д. при переменных температурах нагревателя и холодильника.
Из выражения для обратимого цикла Карно следует, что  или
или  , т.е. для обратимого цикла неравенство Клаузиуса переходит в равенство. Это означает, что приведенное количество тепла, полученного системой в ходе обратимого процесса, не зависит от вида процесса, а определяется только начальным и конечным состояниями системы. Поэтому приведенное количество тепла, полученное системой в ходе обратимого процесса, служит мерой изменения функции состояния системы, называемой энтропией.
, т.е. для обратимого цикла неравенство Клаузиуса переходит в равенство. Это означает, что приведенное количество тепла, полученного системой в ходе обратимого процесса, не зависит от вида процесса, а определяется только начальным и конечным состояниями системы. Поэтому приведенное количество тепла, полученное системой в ходе обратимого процесса, служит мерой изменения функции состояния системы, называемой энтропией.
|
|
|
Энтропия системы – функция ее состояния, определенная с точностью до произвольной постоянной. Приращение энтропии равно приведенному количеству тепла, которое нужно сообщить системе, чтобы перевести ее из начального состояния в конечное по любому обратимому процессу.
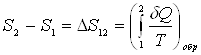 ,
, 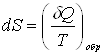 .
.
Важной особенностью энтропии является ее возрастание в изолированных системах (закон возрастания энтропии).
«Энтропия теплоизолированной (адиабатической) системы не может убывать; она возрастает, если в системе идет необратимый процесс, и остается постоянной при обратимом процессе в системе».
Необратимые процессы в системе приводят к установлению равновесного состояния. В этом состоянии энтропия изолированной системы достигает максимума и в дальнейшем никакие макроскопические процессы в системе невозможны.
Изменение энтропии при наличии теплообмена с окружающей средой, может быть каким угодно, как больше нуля, так и меньше нуля.
Получим выражение для приращения энтропии идеального газа, при переходе из состояния с параметрами T1, V1, в состояние с параметрами T2, V2 .
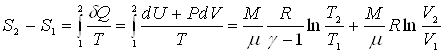 .
.
Из выражения для приращения энтропии газа следует, что энтропия является функцией двух параметров - температуры и объема S=S(T,V).
|
|
|
Введение энтропии позволяет объединить первое и второе начала термодинамики в виде термодинамического неравенства
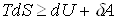 ,
,
где знак = относится к обратимым процессам, знак > - к необратимым.
Энтропия, как и внутренняя энергия, связана с микроскопическим строением системы и статистическим характером теплового движения частиц системы. Это уравнение объединяет формулы первого и второго начала термодинамики:
dQ = dU + р dV, (3.42)
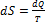 (3.43)
(3.43)
^ Вместо d Q в уравнение, выражающее второе начало термодинамики, подставим его выражение (3.42):
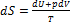 (3.44) Это и есть основное уравнение термодинамики.
(3.44) Это и есть основное уравнение термодинамики.
Б 30
Свободная энергия. Энтальпия. Энтропия и вероятность. Статистический характер второго закона термодинамики. Тепловая смерть Вселенной.
Свобо́дная эне́ргия Гельмго́льца (или просто свобо́дная эне́ргия) — термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами.
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Определение энтропии и ее свойства. Величина, являющаяся функцией состояния, должна обладать свойством аддитивности. Действительно, макросистему всегда можно разбить на части и при этом функция состояния всей системы должна равняться сумме функций состояния ее частей.
Термодинамическая вероятность таким свойством не обладает. Покажем это на примере. Разобьем некую макросистему на две подсистемы, обладающие термодинамическими вероятностями W1 и W2. Число способов реализации данного состояния системы как единого целого для независимых событий равно произведению W = W1·W2.
Из курса математики известно, что логарифм произведения равен произведению логарифмов. Следовательно, логарифм термодинамической вероятности таким свойством обладает свойством аддитивности, т.е.
lnW = lnW1 + lnW2.
Величина, равная произведению постоянной Больцмана на логарифм термодинамической вероятности, называется энтропией S.
S = k·lnW. (15.3)
Свойства энтропии:

| энтропия является аддитивной величиной; |

| энтропия - есть функция состояния макросистемы; |

| энтропия изолированной системы при протекании необратимых процессов возрастает; |

| энтропия макросистемы, находящейся в равновесном состоянии, максимальна. |
Второе начало термодинамики. Второе начало термодинамики задает направленность процессов, протекающих в изолированной термодинамической системе. Оно гласит: изменение энтропии изолированной системы всегда положительно dS > 0 или равно нулю в случае достижения энтропией своего максимального значения.
Другими словами энтропия изолированной системы не может убывать.
Состояние с максимальным значением энтропии является равновесным. Еще раз отметим, что данная формулировка имеет статистический смысл, т.е. возможны некоторые отрицательные флуктуации изменения энтропии в отдельные моменты времени.
Тепловая смерть Вселенной» – гипотетическое состояние мира, к которому якобы должно привести его развитие в результате превращения всех видов энергии в тепловую и равномерного распределения последней в пространстве; в таком случае Вселенная должна прийти в состояние однородного изотермического равновесия, характеризуемого максимальной энтропией. Допущение тепловой смерти Вселенной формулируется на основе абсолютизации второго начала термодинамики, согласно которому энтропия замкнутой системы может только возрастать
Б 31
Третье начало термодинамики. Отклонение реальных газов от закона Бойля- Мариотта. Межмолекулярные силы. Зависимость полной энергии взаимодействия молекул от расстояния.
Дата добавления: 2018-11-24; просмотров: 413; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
