Вывод основных газовых законов. Уравнение состояния идеальных газов. Универсальная газовая постоянная.
Закон Бо́йля — Марио́тта — один из основных газовых законов, открытый в 1662 году Робертом Бойлем и независимо переоткрытый Эдмом Мариоттом в 1676 году. Описывает поведение газа в изотермическом процессе. Закон является следствием уравнения Клапейрона[1].
Закон Бойля — Мариотта гласит:
При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно.
В математической форме это утверждение записывается следующим образом
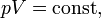
где 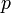 — давление газа;
— давление газа; 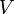 — объём газа.
— объём газа.
Важно уточнить, что в данном законе газ рассматривается, как идеальный. На самом деле, все газы в той или иной мере отличаются от идеального. Чем выше молярная масса газа, тем больше это отличие.
Закон Бойля — Мариотта, закон Шарля и закон Гей-Люссака, дополненные законом Авогадро, образуют уравнение состояния идеального газа
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
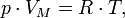
где
· 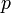 — давление,
— давление,
· 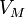 — молярный объём,
— молярный объём,
· 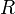 — универсальная газовая постоянная
— универсальная газовая постоянная
· 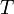 — абсолютная температура,К.
— абсолютная температура,К.
Универса́льная га́зовая постоя́нная — термин, впервые введённый в употребление Д. Менделеевым в 1874 г. Численно равна работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К.
|
|
|
Б 21
Средняя квадратичная скорость молекул. Постоянная Больцмана и кинетическая энергия одной молекулы. Число соударений между молекулами. Средняя длина свободного пробега молекул.
Средняя квадратичная скорость молекул
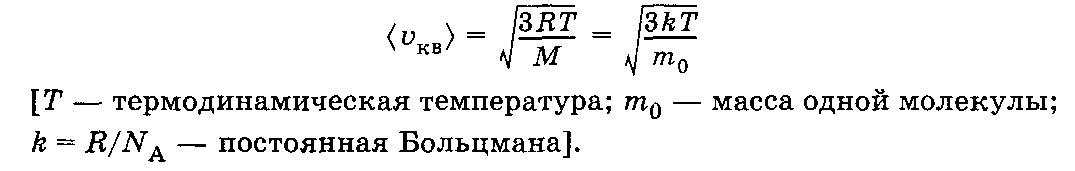
Постоянная Больцмана (k или kB) — физическая постоянная, определяющая связь между температурой вещества и энергией теплового движения частиц этого вещества. Названа в честь австрийского физика Людвига Больцмана, сделавшего большой вклад в статистическую физику, в которой эта постоянная играет ключевую роль. Её экспериментальное значение в системе СИ равно
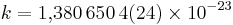 Дж/К.
Дж/К.
В таблице последние цифры в круглых скобках указывают стандартную погрешность значения постоянной. В принципе, постоянная Больцмана может быть получена из определения абсолютной температуры и других физических постоянных. Однако точное вычисление постоянной Больцмана с помощью основных принципов слишком сложно и невыполнимо при современном уровне знаний.
Экспериментально постоянную Больцмана можно определить с помощью закона теплового излучения Планка, описывающего распределение энергии в спектре равновесного излучения при определённой температуре излучающего тела, а также другими методами.
|
|
|
Существует связь между универсальной газовой постоянной 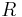 и числом Авогадро
и числом Авогадро 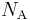 , из которой следует значение постоянной Больцмана:
, из которой следует значение постоянной Больцмана:
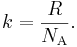
Размерность постоянной Больцмана такая же, как и у энтропии.Молекулы газа, находясь в состоянии хао тического движения, непрерывно сталки ваются друг с другом. Между двумя по следовательными столкновениями молеку лы проходят некоторый путь l, который называется длиной свободного пробега. В общем случае длина пути между по следовательными столкновениями различ на, но так как мы имеем дело с огромным числом молекул и они находятся в бес порядочном движении, то можно говорить о средней длине свободного пробега молекул
Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d (рис.68). Он за висит от скорости сталкивающихся моле кул, т. е. от температуры газа (несколько уменьшается с ростом температуры
Б 22
Дата добавления: 2018-11-24; просмотров: 874; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
