Раздел 4. Окислительно-восстановительные процессы.
Тема 7. Гальванический элемент.
Самостоятельное изучение теоретического материала: Электрохимический ряд напряжений металлов, активность металлов в зависимости от положения в ряду напряжений металлов.
Подготовка к практическому занятию:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению практического занятия «Электрохимические процессы».
Подготовка к лабораторной работе:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению лабораторной работы «Окислительно-восстановительные реакции».
Выполнение индивидуального задания.
Пример типового индивидуального задания:
Методами электронного баланса и ионно-электронного баланса расставьте коэффициенты в уравнении реакции:
K2Cr2O7 + H2S + H2SO4 = Cr2(SO4)3 + S + K2SO4 + H2O
Вопросы для самоконтроля:
1. Приведите примеры соединений, проявляющих только окислительные, только восстановительные и окислительно-восстановительные свойства одновременно.
2. Почему водород находится в ряду напряжений металлов?
3. Составить схемы двух гальванических элементов, в одном из которых медь служила бы катодом, а в другом анодом. Написать уравнения реакций, происходящих при работе этих элементов, вычислить значения стандартных ЭДС.
4. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) сульфата магния, б) сульфата меди (II), в) нитрата свинца (II). Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
|
|
|
5. Использование гальванических элементов. Ответ поясните на конкретных примерах.
Тема 8. Электролиз.
Самостоятельное изучение теоретического материала: Химическая и концентрационная поляризация. Перенапряжение водорода.
Подготовка к практическому занятию:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению практического занятия «Электрохимические процессы».
Выполнение индивидуального задания.
Пример типового индивидуального задания:
Написать схему электролиза растворов: сульфата натрия, сульфата алюминия и сульфата меди (II).
Вопросы для самоконтроля:
1. Каковы закономерности электролиза катионов металлов в водных растворах в зависимости от их положения в ряду напряжений?
2. Каковы закономерности электролиза анионов бескислородных и кислородосодержащих кислотных остатков в водных растворах?
3. Какие окислительно-восстановительные процессы протекают при электролизе водных растворов в случае активного анода.
4. Что служит материалом для инертных анодов?
|
|
|
5. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора и расплава гидроксида натрия.
6. Написать уравнения электродных процессов, протекающих при электролизе водных растворов хлорида железа (III) и нитрата кальция c инертным анодом.
7. Применение электролиза. Ответ поясните на конкретных примерах.
Модуль 2. Металлические и неметаллические материалы
Раздел 5. Металлические материалы.
Тема 9. Металлы.
Самостоятельное изучение теоретического материала: Кристаллическое строение металлов.
Подготовка к лабораторной работе:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению лабораторной работы «Взаимодействие металлов с кислотами».
Вопросы для самоконтроля:
1. Почему при опускании стальных образцов в раствор, содержащий ионы меди, на образцах осаждается медь?
2. Объясните причину нахождения некоторых металлов в природе в свободном состоянии.
3. Если в руде массовая доля халькопирита ( 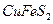 ) составляет 20%, то сколько теоретически можно получить меди и железа из тонны руды?
) составляет 20%, то сколько теоретически можно получить меди и железа из тонны руды?
4. Какие примеси перейдут в раствор, а какие в анодный шлам при электрохимическом рафинировании меди, содержащей марганец, цинк и золото?
|
|
|
5. Напишите реакции восстановления оксида хрома (III) алюминием и хлорида титана (IY) магнием.
Тема 10. Коррозия металлов.
Самостоятельное изучение теоретического материала: Способы защиты металлов от коррозии.
Подготовка к практическому занятию:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению практического занятия «Термодинамика электрохимической коррозии».
Подготовка к лабораторной работе:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению лабораторной работы «Коррозия металлов».
Выполнение индивидуального задания.
Пример типового индивидуального задания:
С целью защиты от коррозии цинковое изделие покрыли оловом. Какое это покрытие: анодное или катодное? Напишите уравнение атмосферной коррозии данного изделия при нарушении целостности покрытия.
Вопросы для самоконтроля:
1. Способы получения металлов из руд.
2. Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Объясните это явление, составив уравнения анодного и катодного процессов.
|
|
|
3. Объясните, почему в атмосферных условиях цинк корродирует, а золото нет? Ответ подтвердите расчетами.
4. Почему в железной бочке можно хранить концентрированную и нельзя хранить разбавленную серную кислоту?
5. Виды коррозии металлов. Способы защиты металлов от коррозии.
Тема 11. Неметаллы.
Самостоятельное изучение теоретического материала: Материалы, используемые в отрасли.
Вопросы для самоконтроля:
1. Нахождение неметаллов в природе.
2. Какую низшую и высшую степень окисления проявляют углерод, хлор, азот, фосфор, сера и йод? Почему? Укажите возможные степени окисления. Приведите примеры соединений этих элементов в различных степенях окисления.
3. Какая из галогеноводородных кислот - наиболее сильный восстановитель? По-
чему?
4. Приведите электронные структуры атомов азота, серы, мышьяка, кремния, хлора, криптона. К какому электронному семейству относятся эти элементы?
Тема 12. Полимеры.
Самостоятельное изучение теоретического материала: Структура макромолекул: линейные, разветвленные, сетчатые.
Вопросы для самоконтроля:
1. Реакции полимеризации. Приведите примеры полимеров, получаемых реакциями полимеризации.
2. Реакции поликонденсации. Приведите примеры полимеров, получаемых реакциями поликонденсации.
3. Состав и применение лакокрасочных материалов.
4. Состав и применение пластмасс.
5. Состав и применение материалов на основе синтетических каучуков. Вулканизация каучука. Резины.
6. Состав и применение полимерного стекла.
Дата добавления: 2018-11-24; просмотров: 233; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
