Седиментационная устойчивость
За счет седиментации (оседании) численная концентрация высокодисперсных частиц в вышележащем слое vчН (см. рис. 10.2, в) превышает концентрацию в тех слоях, которые расположены ниже vч0. Создается разность концентраций Δvч, которая является движущей силой диффузии частиц, направленной обратно седиментации. При равенстве диффузионного и седиментационного потоков создается седиментационно-диффузионное равновесие, которое и обусловливает седиментационную устойчивость высокодисперсных систем (см. рис. 10.2, б).
В условиях равновесия высокодисперсная система характеризуется постоянством суммы химического μi и гравитационного Еi потенциалов, т.е.
μi + Ei = const. (10.1)
Эти потенциалы определяются по формулам
μi = μi0 + RTlnvч; Ei = MgH, (10.2)
где μi0 — стандартный химическии потенциал: vч — численная концентрация дисперсной фазы; М — масса дисперсной фазы; Н — высота, характеризующая положение дисперсной системы.
С учетом уравнений (10.2) условие (10.1) для коллоидной системы, характеризующейся численными концентрациями vч0 и vчН (см. рис. 10.2, б), можно представить в следующем виде:
RTlnvч0 + MgH0 = RTlnvчH + MgH.
или
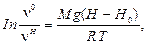 (10.3)
(10.3)
где H0, H — соответственно исходная, принятая за начальную, и текущая высота, относительно которых определяется численная концентрация vч0 и vчН.
|
|
|
Учитывая, что M = (4/3)πr3ρNA, a ΔH = H – H0 (где r — радиус частиц дисперсной фазы; ρ— плотность материала частиц), вместо уравнения (10.3) получим
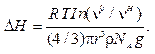 (10.4)
(10.4)
Уравнение (10.4) определяет так называемый гипсометрический закон распределения численной концентрации по высоте. С учетом плотности дисперсионной среды ρ0 вводится поправка:
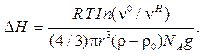 (10.5)
(10.5)
Используя формулы (10.4) и (10.5), можно определить высоту, на которой численная концентрация дисперсной фазы снизится наполовину, т.е. vчН = 0,5vч0 или vч0/vчН = 2, a In 2 = 0,693. С учетом этих условий гипсометрический закон можно представить в следующем виде:
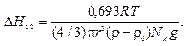 (10.6)
(10.6)
По формуле (10.6) можно определить, на какой высоте численная концентрация дисперсной фазы снизится в два раза.
Седиментационно-диффузионное равновесие — одно из проявлений молекулярно-кинетических свойств высокодисперсных систем. Поэтому формулы (10.4)—(10.6) применимы только в том случае, когда размеры частиц дисперсной фазы лежат в пределах 1—100 нм.
В отсутствие гравитации, когда Еi при соблюдении условий (10.1) и (10.2) равен нулю, седиментационное равновесие определяется химическим потенциалом, значение которого не зависит от высоты H. Подобная ситуация создается в кабине космического корабля. В воздушной среде в условиях невесомости все дисперсные системы независимо от размеров частиц становятся седиментационно-устойчивыми.
|
|
|
Седиментационное равновесие нарушается, и частицы начинают оседать (седиментировать), когда их размер превышает 100 нм (0,1 мкм). В условиях постоянной скорости оседания устанавливается равновесие между гравитационной силой Р и силой трения Fтр (см. рис. 10.2, а):
P = Fтр (10.7)
или
4πr3(ρ – ρ0)g / 3 = 6πηvr, (10.8)
где η — вязкость дисперсионной среды: v — скорость оседания.
Из формулы (10.8) несложно определить радиус частиц:
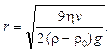 (10.9)
(10.9)
Формулы (10.7)—(10.9) справедливы для дисперсных систем, когда при оседании исключается столкновение частиц, а плотность частиц превышает плотность дисперсионной среды. В противном случае, когда ρ0 > ρ, возникает выталкивающая сила, и вместо оседания частицы всплывают, т.е. идет процесс, обратный седиментации; вместо осадка образуется слой частиц в верхней части дисперсной системы. Подобный процесс наблюдается для газовых и реже для жидких и твердых частиц дисперсной фазы, т.е. для дисперсных систем типа Г/Ж, Ж/Ж и Т/Ж.
|
|
|
Скорость и время оседания частиц различного размера неодинаковы; более крупные частицы оседают быстрее. Это обстоятельство лежит в основе дисперсионного анализа методом седиментации (подробнее см. параграф 13.5).
Оседание характерно для частиц, нижний предел размеров которых ограничен 0,1 мкм, т.е. для средне- и грубодисперсных систем. Верхний предел размеров частиц обусловлен свойствами дисперсионной среды. Для эмульсий и суспензий он не превышает 100 мкм. Увеличение скорости оседания для частиц большего размера до равновесного значения происходит быстро (в течение долей секунды), что может отрицательно сказаться на точности определения размеров частиц.
Скорость оседания в воздухе шарообразных частиц плотностью 1,3∙103 кг/м3 диаметром 90 мкм составляет 63,5 см/с, диаметром 10 мкм — 0,9 см/с. Вязкость и плотность газа значительно меньше, чем жидкости. Поэтому скорость оседания частиц аэрозолей, т.е. для систем с газовой дисперсионной средой, значительно выше. Учитывая, что для воздуха ρ >> ρ0, при использовании формул (10.8) и (10.9) можно пренебречь плотностью воздуха и считать ρ0 ≈ 0.
|
|
|
Мелкие частицы оседают медленно, а время оседания исчисляется десятками часов и даже суток. На помощь приходит центрифугирование. Вместо гравитационного поля и ускорения g на частицы действует центробежное поле и ускорение j. Размер частиц в этом случае по аналогии с уравнением (10.9) будет определяться по формуле
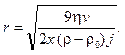 (10.10)
(10.10)
Центробежное ускорение на четыре и более порядков может превышать ускорение силы тяжести. Одновременно на столько же порядков сокращается время оседания частиц одного и того же размера по сравнению со временем их оседания под действием гравитации. Ускорение процесса оседания частиц ценрифугированием применяется на практике, в частности, при анализе крови, сепарировании молока в молочной и масложировой промышленности.
Кинетика коагуляции
Агрегативная устойчивость и неустойчивость определяются способностью частиц вступать в контакт, т.е. сблизиться до определенного расстояния. Контакт между частицами — это необходимое условие коагуляции.
Польский ученый М.Смолуховский разработал теорию коагуляции частиц при условии, что контакт между частицами — не только необходимая предпосылка, но и достаточное условие коагуляции. Коагуляция происходит во времени и характеризуется определенной скоростью vк. Скорость коагуляции — это изменение по времени τ численной концентрации vч дисперсной фазы, т.е.
vк = –dvч/dτ.
Скорость коагуляции всегда положительна, а величина dvч/dτ — отрицательна, поэтому перед правой части этого уравнения ставится знак минус.
Если до коагуляции численная концентрация дисперсной фазы равна vч0, то после коагуляции она снизится до величины vчτ.
Заметим, что численная концентрация может быть значительной: в 1 см3 прозрачного на вид сока может содержаться до 10000 (1011 в 1 м3) частиц диаметром менее 1 мкм; в 1 см3 воздуха около промышленных предприятий находится до 20000 мелких частиц.
Концентрация частиц в данное время vчt зависит от начальной концентрации vчо и времени коагуляции t, т.е.
vчτ = f(vч0, τ). (10.11)
Смолуховскому удалось найти вид функции (10.11) при следующих допущениях: частицы монодисперсны и имеют сферическую форму; сила взаимодействия между частицами не учитывается; предполагается, как уже отмечалось, что для коагуляции частицам достаточно сблизиться до определенного расстояния; частицы дисперсной фазы имеют коллоидные размеры и перемещаются за счет броуновского движения; учитывается только взаимодействие двух частиц; одновременное взаимодействие трех и более частиц считается маловероятным. Несмотря на такие существенные допущения, теория Смолуховского дает возможность с достаточной для практики точностью рассчитать численную концентрацию.
Слипание частиц и кинетика коагуляции рассматриваются с точки зрения химической кинетики как реакции второго порядка, т.е.
dvчdτ = – kvч2. (10.12)
где к — константа скорости коагуляции.
Проведем интегрирование уравнения (10.12):
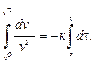
Результаты интегрирования сводятся к следующему:
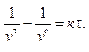 или
или 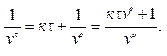 (10.13)
(10.13)
Из условия (10.13) нетрудно определить численную концентрацию:
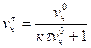 (10.14)
(10.14)
где vч0, vчτ — численная концентрация до коагуляции (начальная) и после коагуляции (конечная) соответственно.
Для упрощения формулы (10.14) величину к vч0 выражают через время половинной коагуляции θ. Это время, за которое начальная численная концентрация снизится в два раза. Оно определяется опытным путем. Если vчτ = vч0/2, а τ = θ, то получим
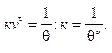 (10.15)
(10.15)
С учетом преобразования (10.15) уравнение (10.14) можно представить в виде
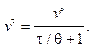 (10.16)
(10.16)
Формула (10.16) определяет кинетику так называемой быстрой коагуляции. Условия быстрой коагуляции заложены в тех допущениях, о которых говорилось выше; главное из них — каждое сближение частиц приводит к их слипанию. Фактически это не так. Часть частиц после сближения до определенного расстояния не слипается. Если обозначить вероятность слипания через e, которая характеризует долю слипшихся частиц по отношению к сблизившимся, то вместо формулы (10.16) скорость коагуляции может быть выражена следующим образом:
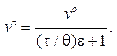 (10.17)
(10.17)
Если ε = 1, то формула (10.17) превращается в формулу (10.16), характеризующую кинетику быстрой коагуляции. Если ε = 0, то vчτ = vч0, т.е. коагуляция отсутствует. Фактически вероятность слипания лежит в пределах 1 ≤ ε < 0.
При помощи формулы (10.17) можно количественно определить кинетику медленной коагуляции. Особенности быстрой и медленной коагуляции и кинетику процесса характеризует константа скорости коагуляции, которая определяется при помощи уравнения (10.13).
Согласно теории Смолуховского, константа скорости коагуляции зависит от коэффициента диффузии D и расстояния между частицами h:
к = 4πhD. (10.18)
На расстоянии h осуществляется взаимодействие между частицами. Это расстояние, согласно теории, равно сумме радиусов частиц: h = 2r. Коэффициент диффузии рассчитывается по уравнению (9.7). Подставив уравнение (9.7) в формулу (10.18) и заменив h, получим
к = 4RT/(3ηNA), (10.19)
где η — вязкость дисперсионной среды.
Константа скорости коагуляции, как это следует из формулы (10.19), не зависит от начальной концентрации частиц дисперсной фазы и размеров частиц. Она остается неизменной в течение всего процесса коагуляции.
Найденная расчетным путем из уравнения (10.19) константа ктеор характеризует быструю коагуляцию. Экспериментальные значения константы кэкс могут не совпадать с теоретическими. Если соблюдается условие
кэкс < ктеор, (10.20)
то имеет место медленная коагуляция.
Теория Смолуховского получила дальнейшее развитие: сняты некоторые ее ограничения и допущения, в частности в отношении монодисперсности частиц; более четко определен смысл вероятности слипания. Однако, теория Смолуховского абстрагируется от свойств самих дисперсных систем. Между тем эти свойства в определенных условиях оказывают решающее влияние на коагуляцию.
Дата добавления: 2018-11-24; просмотров: 509; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
