МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЕ СВОЙСТВА ВЫСОКОДИСПЕРСНЫХ СИСТЕМ
В 1914 г. немецкий физико-химик Вольфганг Оствальд* обратил внимание широкой научной общественности на мир, как он назвал его, «обойденных величин», т.е. таких дисперсных систем, частицы которых больше размеров молекул, но невидимы в микроскоп. Для подобных систем характерны особые молекулярно-кинетические свойства.
Разработка молекулярно-кинетической теории связана с именем А. Эйнштейна и в начале XX века имела принципиальное значение как прямое доказательство молекулярной природы вещества.
Молекулярно-кинетические свойства обусловлены самопроизвольным движением молекул и проявляются в броуновском движении, диффузии, осмосе и седиментационном равновесии.
Причина молекулярно-кинетических свойств
Все молекулярно-кинетические свойства вызваны хаотическим тепловым движением молекул дисперсионной среды, которое складывается из поступательного, вращательного и колебательного движений молекул.
Молекулы жидкой и газообразной дисперсионной среды находятся в постоянном движении и сталкиваются друг с другом. Среднее расстояние, которое проходит молекула до столкновения с соседней, называют средней длиной свободного пробега. Для молекул воздуха при 298 К она составляет 71 нм, а при 293 К — 20 нм. Из приведенных данных следует, что длина свободного пробега значительно превышает размеры самих молекул.
Молекулы обладают различной кинетической энергией. Тем не менее при данной температуре среднее значение кинетической энергии молекул остается всегда постоянным для одной молекулы и одного моля оно составляет
|
|
|
 (9.1)
(9.1)
где m, М — масса одной молекулы и одного моля; v — скорость движения молекул; k — константа Больцмана; R — универсальная газовая постоянная.
Флуктуация значений кинетической энергии молекул дисперсионной среды (т.е. отклонение от среднего) и является причиной молекулярно-кинетических свойств.
Установление и изучение молекулярно-кинетических свойств стало возможным в результате применения статистических методов исследования. Эти методы предполагают применение к системам, состоящим из множества элементов (в данном случае молекул), теории вероятности. Исходя из допущений о беспорядочности движения отдельных молекул, теория определяет наиболее вероятное сочетание для систем, состоящих из множества молекул.
Статистические методы, разработанные для изучения молекулярно-кинетических свойств, послужили основой для исследований некоторых важных физических и физико-химических явлений.
Молекулярно-кинетические свойства проявляются в жидкой и газообразной дисперсионной среде, молекулы которых обладают определенной подвижностью.
|
|
|
Броуновское движение
Броуновским называют непрерывное, хаотическое, равновероятное для всех направлений движение мелких частиц, взвешенных в жидкости или газах, за счет воздействия молекул дисперсионной среды.
Аэрозольную частицу диаметром 100 нм окружают примерно 105 газовых молекул, частота колебаний которых (применительно к двухатомным молекулам) составляет 1014 с-1. Следовательно, одна аэрозольная частица за счет газовых молекул может испытать 1019 ударов за 1 с. Если бы сила ударов, которые получает частица со всех сторон, была одинакова, то частица «топталась» бы на месте.
Мельчайшие частицы незначительной массы испытывают неодинаковые удары со стороны молекул дисперсионной среды; результирующая сила F, которая заставляет частицы двигаться, показана на рис. 9.1 жирной стрелкой. Направление и импульс этой силы непрерывно меняются, поэтому частицы совершают хаотическое движение.
Молекулы дисперсионной среды таким же образом действуют на частицы средне- и грубодисперсных систем. В связи со значительным размером частиц этих систем число ударов молекул резко увеличивается. По законам статистики подобное обстоятельство означает, что импульс действия сил со стороны молекул среды взаимно компенсируется, а значительная масса и инерция относительно крупных частиц способствует тому, что воздействие молекул остается без последствий. Поэтому броуновское движение наиболее интенсивно проявляется в отношении высокодисперсных систем.
|
|
|
Направление результирующей силы F (см. рис. 9.1), вызванной ударами молекул, и движение самих молекул все время изменяются. Определить эти изменения и связать их с молекулярно-кинетическими свойствами среды удалось в 1907 г. независимо друг от друга А. Эйнштейну и М. Смолуховскому.

Рис. 9.1. Воздействие молекул дисперсионной среды на частицу 1 дисперсной фазы.

Рис. 9.2. Сдвиг частиц.
В основу их расчетов был взят не истинный путь частиц дисперсной фазы, а сдвиг частиц (рис. 9.2). Если путь частицы определяется ломаной линией, то сдвиг х характеризует изменение координат частицы за определенный отрезок времени. Средний сдвиг будет определять среднеквадратическое смещение частицы, которое определяется по уравнению
 , (9.2)
, (9.2)
где х 1 , х 2 , x i — сдвиг частиц за определенное время.
|
|
|
Теория броуновского движения исходит из представления о взаимодействии случайной силы f(τ), которая характеризует удары молекул, силы Fτ, зависящей от времени, и силы трения при движении частиц дисперсной фазы в дисперсионной среде со скоростью n. Уравнение случайного броуновского движения (уравнение Ланжевена) имеет следующий вид:
m(dν/dt) + ην = Fτ + f(τ), (9.2, а)
где m — масса частицы; η — коэффициент вязкости дисперсионной среды.
Для больших промежутков времени (τ >> m/η) инерцией частиц, т.е. членом m(dν/dτ), можно пренебречь. После интегрирования уравнения (9.2, а) при условии, что среднее произведение импульсов случайной силы равно нулю, находят среднее значение флуктуации (средний сдвиг):
 (9.3)
(9.3)
где τ — время; r — радиус частиц дисперсной фазы; NA — число Авогадро.
В формуле (9.3) отражены параметры дисперсной фазы и дисперсионной среды: величина RT/NA характеризует молекулярно-кинетические свойства дисперсионной среды, а η — ее вязкость; радиус частиц r — это параметр, относящийся к дисперсной фазе, а время t определяет взаимодействие дисперсионной среды с дисперсной фазой. Формула (9.3) подтверждена экспериментально.
Кроме поступательного возможно вращательное броуновское движение, характерное для двухмерных частиц и частиц неправильной формы (нитей, волокон, хлопьев и др.).
Средний сдвиг частиц различного размера за одну секунду в воздушной среде характеризуется значениями:
Радиус частиц, мкм 10-3 0,1 10
Максимальные значения
среднего сдвига, мкм 1,28 ∙ 103 0,168 0,0123
Средний сдвиг для частиц высокодисперсных систем размером 10–3 — 10–1 мкм (или 1—100 нм) может достигать нескольких миллиметров.
Броуновское движение наиболее ярко выражено у высокодисперсных систем, а его интенсивность зависит от дисперсности (см. рис. 1.2). Для среднедисперсных систем средний сдвиг составляет единицы или доли микрометров. Если размер частиц превышает 10 мкм, то броуновским движением можно пренебречь. Это обстоятельство является одним из факторов, ограничивающим верхний размер среднедисперсных систем значением 10 мкм.
Диффузия
Диффузией называют самопроизвольное распространение вещества из области с большей концентрацией в область с меньшей концентрацией. Различают следующие виды диффузии: молекулярную, ионную и коллоидных частиц.
Диффузия высокодисперсных коллоидных частиц схематически показана на рис. 9.3. В нижней части концентрация частиц больше, чем в верхней, т.е. v1 > v2*. Диффузия идет из области с большей концентрации в область с меньшей, т.е. снизу вверх; направление диффузии на рис. 9.3 показано стрелкой. Диффузия характеризуется определенной скоростью перемещения вещества через поперечное сечение В, которая равна dm/dτ.
На расстоянии Δх разность концентраций составит v2 – v1, так как v2 < v1, то эта величина отрицательна. Изменение концентрации, отнесенное к единице расстояния, называют градиентом концентрации. Градиент концентрации равен (v2 – v1)/Δx, или в  дифференциальной форме, dv/dx.
дифференциальной форме, dv/dx.
Скорость перемещения вещества пропорциональна градиенту концентрации и площади В, через которую происходит движение диффузионного потока, т.е.
 (9.4)
(9.4)
Скорость диффузии (dm/dt) величина положительная, а градиент концентрации (dv/dx) — отрицателен; по этой причине перед правой частью уравнения (9.4) ставится знак минус.
 Коэффициент пропорциональности D называют коэффициентом диффузии. Уравнение (9.4) является основным уравнением диффузии в дифференциальной форме. Оно справедливо для всех видов диффузии, в том числе и для диффузии коллоидных частиц. Основное уравнение диффузии в интегральной форме применимо для двух процессов — стационарного и нестационарного.
Коэффициент пропорциональности D называют коэффициентом диффузии. Уравнение (9.4) является основным уравнением диффузии в дифференциальной форме. Оно справедливо для всех видов диффузии, в том числе и для диффузии коллоидных частиц. Основное уравнение диффузии в интегральной форме применимо для двух процессов — стационарного и нестационарного.
Для стационарного процесса градиент концентрации постоянен, т.е. dv/dx = const. Значительное число диффузионных процессов близко к стационарным. Интегрируя уравнение (9.4), получим
 (9.5)
(9.5)
Формула (9.5) характеризует первый закон диффузии Фика. Из этой формулы нетрудно определить физический смысл коэффициента диффузии. Если –dv/dх = 1, В = 1 и τ = 1, то m = D, т.е. коэффициент диффузии численно равен массе диффундирующего вещества, когда градиент концентрации, площадь сечения диффузионного потока и время равны единице. Следует говорить лишь о численном равенстве, так как размерность коэффициента диффузии [м2/с] не соответствует размерности массы.
В случае нестационарного процесса градиент концентрации не является постоянной величиной, т.е. dv/dx ≠ const. Интегрирование уравнения (9.4) усложняется, а форма расчетного уравнения учитывает изменение градиента концентрации.
Значения коэффициента диффузии для различных ее видов приведены ниже:
| Вид диффузии | Ионная | Молекулярная | Коллоидных частиц |
| Коэффициент диффузии, м2/с | 10–8 | 10-9 | 10–10 |
Коллоидные частицы характеризуются минимальным коэффициентом диффузии. Это означает, что диффузия коллоидных частиц более затруднена по сравнению с молекулярной и ионной. Так, например, скорость диффузии частиц карамели, дисперсной фазой которой является коллоидный раствор, в 100—1000 раз меньше скорости диффузии молекул сахара, формирующих молекулярный раствор. В газах коэффициент диффузии увеличивается до 10–4, а в твердых телах снижается до 10–12 м2/с.
Количественно диффузия определяется коэффициентом диффузии, который связан со средним сдвигом, следующим соотношением:
 (9.6)
(9.6)
Диффузия высокодисперсных частиц совершается беспорядочно с большей вероятностью в сторону меньшей концентрации. Время, определяемое соотношением (9.6), характеризует продолжительность диффузии. Чем меньше коэффициент диффузии, тем продолжительнее процесс диффузии.
При выводе уравнения (9.6) были приняты следующие допущения: частицы дисперсных систем движутся независимо друг от друга и между ними отсутствует взаимодействие; средняя энергия поступательных движений частиц равна 0,5 kT.
Используя формулу (9.3) для определения среднего сдвига, коэффициент диффузии можно представить в виде
 (9.7)
(9.7)
где k — константа Больцмана, равная R/NA.
Если коэффициент диффузии известен, то по формуле (9.7) можно определить размер частиц:
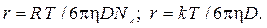 (9.8)
(9.8)
Как следует из формулы (9.7), чем больше размер частиц, тем меньше коэффициент диффузии и менее интенсивна сама диффузия.
Формулы (9.6)—(9.8) позволили экспериментальным путем определить константу Больцмана и число Авогадро.
В воздухе коэффициент диффузии частиц радиусом 1 нм составляет 1,28 ∙ 10–6 м2/с. Для частиц радиусом 100 нм коэффициент диффузии снижается до 2,21 ∙ 10–10 м2/с, для частиц радиусом 10 мкм — до 1,38 ∙10–10 м2/с. Для частиц, размер которых превышает 10 мкм, т.е. для грубодисперсных систем, коэффициент диффузии и сама диффузия ничтожны.
Диффузия в полной мере проявляется у высокодисперсных систем, ослаблена у среднедисперсных и практически отсутствует у грубодисперсных систем.
Коэффициент диффузии зависит и от формы частиц, что не учитывается в уравнении (9.7). Поэтому при помощи формулы (9.8) можно определить размер только коллоидных шарообразных частиц или приведенный к шарообразному размеру частиц неправильной формы.
Таким образом, диффузия непосредственно связана с броуновским движением; эта связь количественно выражается при помощи уравнений (9.6)—(9.8).
Осмос
При разделении двух растворов различной концентрации или раствора и чистого растворителя полупроницаемой перегородкой (мембраной) возникает поток растворителя от меньшей концентрации к большей, выравнивающий концентрацию. Этот процесс называется осмосом.
 Осмос характерен не только для истинных, но и для коллоидных растворов. Схема осмоса приведена на рис. 9.4. В сосуд, имеющий полупроницаемую перегородку 3, помещен истинный или коллоидный раствор 1. Полупроницаемая перегородка способна пропускать дисперсионную среду или растворитель, но является препятствием для коллоидных частиц или растворенных веществ. С наружной стороны перегородки находится чистая жидкость (растворитель) 2. Концентрация раствора по обе стороны полупроницаемой перегородки будет различной. Внутри сосуда 1 часть раствора занимают молекулы растворенного вещества или частицы дисперсной фазы, поэтому концентрация жидкости (растворителя или дисперсионная среда) там будет меньше, чем в емкости 2 с чистой жидкостью.
Осмос характерен не только для истинных, но и для коллоидных растворов. Схема осмоса приведена на рис. 9.4. В сосуд, имеющий полупроницаемую перегородку 3, помещен истинный или коллоидный раствор 1. Полупроницаемая перегородка способна пропускать дисперсионную среду или растворитель, но является препятствием для коллоидных частиц или растворенных веществ. С наружной стороны перегородки находится чистая жидкость (растворитель) 2. Концентрация раствора по обе стороны полупроницаемой перегородки будет различной. Внутри сосуда 1 часть раствора занимают молекулы растворенного вещества или частицы дисперсной фазы, поэтому концентрация жидкости (растворителя или дисперсионная среда) там будет меньше, чем в емкости 2 с чистой жидкостью.
 За счет диффузии жидкость из области более высокой концентрации будет самопроизвольно перемещаться в область меньшей концентрации, т.е. из емкости 2 в емкость 1. Это перемещение на рис. 9.4 показано стрелками. Оно обусловлено тем, что число ударов молекул на мембрану растворителя со стороны чистого или более разбавленного раствора больше, чем со стороны раствора. Это избыточное число ударов и является причиной перемещения растворителя через поры мембраны туда, где его меньше, т.е. в область истинного или коллоидного раствора. Подобное объяснение переноса жидкости является кинетической трактовкой причины осмоса.
За счет диффузии жидкость из области более высокой концентрации будет самопроизвольно перемещаться в область меньшей концентрации, т.е. из емкости 2 в емкость 1. Это перемещение на рис. 9.4 показано стрелками. Оно обусловлено тем, что число ударов молекул на мембрану растворителя со стороны чистого или более разбавленного раствора больше, чем со стороны раствора. Это избыточное число ударов и является причиной перемещения растворителя через поры мембраны туда, где его меньше, т.е. в область истинного или коллоидного раствора. Подобное объяснение переноса жидкости является кинетической трактовкой причины осмоса.
Существует еще и термодинамическое объяснение осмотического переноса. Химический потенциал чистой жидкости m2 превышает химический потенциал этой же жидкости в растворе μ1. Процесс идет самопроизвольно в сторону меньшего химического потенциала до тех пор, пока не произойдет выравнивание химических потенциалов, т.е. до достижения условия μ2 = μ2.
В результате перемещения жидкости в емкости 1 создается избыточное давление p, называемое осмотическим. Растворитель, проникающий в область раствора 1, поднимает уровень жидкости на высоту Н, что компенсирует давление чистого растворителя в сторону раствора. Наступает момент, когда вес столба жидкости в области раствора уравнивается давлением растворителя. Дальнейшего изменения уровня уже не произойдет, а вес столба жидкости над уровнем растворителя будет служить мерой осмотического давления.
Осмотическое давление возникает при движении чистого растворителя в сторону раствора или от более разбавленного раствора в сторону более концентрированного, а следовательно, связано с разностью концентраций растворенного вещества и растворителя. Осмотическое давление — это такое избыточное давление над раствором, которое необходимо для исключения переноса растворителя через мембрану.
Осмотическое давление равно тому давлению, которое производила бы дисперсная фаза (растворенное вещество), если бы она в виде газа при той же температуре занимала тот же объем, что и коллоидная система (раствор). Осмотическое давление не есть проявление какого-либо внешнего воздействия. Оно возникает самопроизвольно, как следствие молекулярно-кинетических свойств дисперсионной среды.
Высота подъема жидкости Н над первоначальным положением раствора количественно определяет осмотическое давление, которое обычно обозначают через π.
Для чистого растворителя и идеального раствора неэлектролитов осмотическое давление выразится формулой
πV = RT In(1–x), (9.8, а)
где V — молярный объем растворителя; х — молярная доля растворенного вещества.
В случае разбавленных растворов неэлектролитов, когда x << 1, можно записать следующее уравнение:
πV = nRT. (9.9)
Согласно определению осмотическое давление можно найти из уравнения состояния (9.9), где n — число молей растворенного вещества.
Если масса растворенного вещества равна q, а молекулярная его масса М, то n = q/М; тогда согласно уравнению (9.9) осмотическое давление равно
 (9.10)
(9.10)
Величина q/V есть массовая концентрация растворенного вещества, поэтому осмотическое давление можно определить при помощи следующей формулы
π = (vм / M)RT. (9.11)
Формула (9.11) является основной для определения осмотического давления. Она позволяет найти зависимость осмотического давления от размеров частиц растворенного вещества. Для этой цели массу дисперсной фазы можно представить в виде
M = mNA, m = (4 / 3)πr3ρ, (9.12)
где m, r — молекулярная масса и радиус частиц дисперсной фазы; ρ — плотность материала частиц.
Подставив в уравнение (9.11) значение М из формулы (9.12), получим
 (9.13)
(9.13)
Формулу (9.13) используют для определения осмотического давления коллоидных растворов.
Осмотическое давление коллоидных растворов (высокодисперсных систем с жидкой дисперсионной средой) незначительно и составляет всего 1 мм водяного столба или даже меньше (1 мм водяного столба равен примерно 10 Па). Размеры и концентрация частиц в результате агрегации и других процессов могут изменяться. В связи с этим осмотическое давление для высокодисперсных систем непостоянно.
Из формулы (9.13) следует, что осмотическое давление прямо пропорционально концентрации дисперсной фазы и обратно пропорционально размеру частиц этой фазы в третьей степени. Чем меньше размер частиц, тем значительнее осмотическое давление. Если, например, для коллоидных растворов диаметр частиц составляет 100 нм, а размер молекул растворенного вещества — 1 нм, то осмотическое давление молекулярных растворов по сравнению с коллоидными будет в 106 раз больше. Осмотическое давление истинных растворов значительно превышает осмотическое давление коллоидных растворов и составляет для сока сахарной свеклы 35∙105 Па, экстракта кофе — 25∙105 Па, фруктовых соков — 1,5∙105 Па, 6%-го раствора сахара — 60∙105 Па.
Таким образом, осмос, как и все молекулярно-кинетические свойства, характерен для высокодисперсных систем, размеры частиц дисперсной фазы которых не превышают 0,1 мкм.
Упражнения
1. Определить средний сдвиг капель эмульсии радиусом 10 нм за время τ = 4 с при 293 К и вязкости η = 10 –3 Па∙с.
Воспользуемся формулой (9.3):

2. Мыло образует в воде мицеллы, радиус которых равен 12,5 нм. Определите коэффициент диффузии мицелл при 313 К, если вязкость раствора равна 6,5 ∙ 10 –4 Па ∙с.
По формуле (9.7) находим

3. Определить размеры частиц яичного альбумина, находящихся в воде при 293 К, если коэффициент диффузии D = 7,8∙10 –11 м 2 /с, а вязкость воды равна 10 –3 Па∙ с.
По формуле (9.8) находим
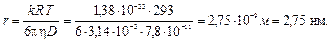
4. Во сколько раз осмотическое давление раствора сока сахарной свеклы π 1 молекулы которого имеют диаметр d 1 = 0,8 нм, превышает осмотическое давление коллоидного раствора свекловичного сока π 2 , с диаметром частиц d 2 = 80 нм? Концентрацию коллоидного и молекулярного растворов и их плотности считать одними и теми же.
Согласно формуле (9.13)
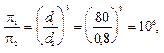
т.е. осмотическое давление молекулярного раствора в 10 6 раз больше осмотического давления коллоидного раствора.
5. Определить осмотическое давление пыли при 293 К, если ее концентрация 1,5∙10 –2 кг/м 2 , средний радиус частиц 40 мкм, плотность 1,3∙ 10 3 кг/м 3 .
На основании формулы (9.13) находим

т.е. осмотическое давление незначительно.
Г л а в а 10
Дата добавления: 2018-11-24; просмотров: 1610; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
