АДСОРБЦИЯ НА ТВЕРДЫХ ПОВЕРХНОСТЯХ
Характерной особенностью твердых поверхностей является их пористость. Природа поверхности адсорбента, размеры и форма его пор влияют на адсорбцию, изменяют ее количественные и качественные характеристики, т.е. механизм адсорбции.
Несмотря на разнообразие адсорбционных процессов, они всегда связаны с особой структурой твердой поверхности, и, в частности, с пористостью адсорбента.
Особенности адсорбции на поверхности твердых тел
Твердые поверхности и качестве адсорбентов используются для адсорбции газов или жидкостей, а адсорбционные процессы при этом протекают на границе раздела твердое тело – газ (Т–Г) и твердое тело – жидкость (Т–Ж).
В отличие от поверхности жидкости поверхность твердых тел геометрически и энергетически неоднородна (см. параграф 2.2) — твердые адсорбенты могут иметь поры. Одной из основных характеристик подобных адсорбентов является пористость П, она равна отношению суммарного объема пор Vп к общему объему адсорбента Vоб, т.е. П = Vп/Vоб. В зависимости от пористости твердые адсорбенты делятся на две группы: непористые и пористые.
Поверхность раздела фаз у непористых адсорбентов соответствует контуру твердого тела. У пористых адсорбентов эта поверхность значительно больше за счет наличия пор. Часто пористые адсорбенты применяют в виде порошков. Адсорбция на порошкообразных адсорбентах определяется их удельной поверхностью, которая рассчитывается по формуле (1.1). Удельная поверхность пористых порошкообразных адсорбентов значительно превышает удельную поверхность непористых адсорбентов в большей степени зависит от поверхности пор, чем от поверхности, определяющей контур частиц. Например, адсорбируемая на твердой поверхности молекула азота занимает площадь 0,162 нм2. Для адсорбции 55 мл азота при нормальных условиях в виде мономолекулярного слоя площадь поверхности твердого непористого тела должна составлять 239 м2. Для адсорбции этого же количества азота потребуется всего 0,5 г активированного угля, являющегося пористым порошкообразным адсорбентом. Характеристика непористых и пористых порошкообразных адсорбентов приведена в табл. 6.1.
|
|
|
Т а б л и ц а 6.1
Характеристика адсорбентов
| Адсорбенты | Диаметр пор *, нм | Удельная поверхность, м2/кг |
| Непористые Макропористые Мезопористые Микропористые | - > 4,0 1,2 – 4,0 <1,2 | 1 – 500 (0,5 – 2,0)103 < 4 105 > 4 105** |
Пористые адсорбенты могут иметь поры различного размера (рис 6.1). В зависимости от размера пор адсорбенты делятся на микропористые, мезопористые или переходнопористые, а также на макропористые. Диаметр микропор соизмерим с размерами молекул.
|
|
|
Пористость не только резко повышает удельную поверхность адсорбента, но и влияет на механизм адсорбции.
Адсорбция на микропористых адсорбентах заключается в объемном заполнении пространства пор, а адсорбция на мезопористых адсорбентах – в капиллярной конденсации паров адсорбата. Адсорбционная емкость микропор определяется не только их удельной поверхностью, но и объемом самих микропор.

 Значительная часть дисперсных систем и их продуктов можно отнести к непористым адсорбентам. К ним, в частности, относятся цемент и бетон и изделия из них. Удельная поверхность сахара-песка и сахарной пудры не превышает 500 м2/кг; согласно классификации, приведенной в табл. 6.1, их можно отнести к непористым адсорбентам. Крупы, например рис, пшено, гречка, некоторые сорта растворимого кофе и другие сыпучие пищевые массы относятся к непористым адсорбентам.
Значительная часть дисперсных систем и их продуктов можно отнести к непористым адсорбентам. К ним, в частности, относятся цемент и бетон и изделия из них. Удельная поверхность сахара-песка и сахарной пудры не превышает 500 м2/кг; согласно классификации, приведенной в табл. 6.1, их можно отнести к непористым адсорбентам. Крупы, например рис, пшено, гречка, некоторые сорта растворимого кофе и другие сыпучие пищевые массы относятся к непористым адсорбентам.
Часть непорошкообразных и порошкообразных дисперсных систем является макропористыми адсорбентами. К ним относятся ткани, асбест, древесина и некоторые пищевые массы: хлеб, сухари, макароны, пастила, зефир и др. Мука является макропористым порошкообразным адсорбентом. Так, удельная поверхность различных сортов пшеничной муки лежит в пределах (0,06 – 0,27)103 м2/кг.
|
|
|
В промышленности применяют микро- и мезопористые адсорбенты на основе минеральных веществ и угольных материалов.
Минеральные мезопористые адсорбенты используют для осветления и стабилизации полупродуктов фруктово-ягодных соков, растительных масел, питьевой и технической воды, в качестве осушителей продуктов и для других целей. К минеральным относятся глинистые адсорбенты – бентониты различного класса с разбухающими кристаллическими решетками: монтмориллонит, каолин, палыгорскит, гидрослюда и др. Если бентонитовые глины подвергнуть активации, то их адсорбционная способность увеличивается. Удельная поверхность и размеры пор глин соответствуют поверхности мезопор. Так, например, некоторые глинистые адсорбенты, применяемые в промышленности, имеют удельную поверхность (1,5 – 4,0)105 м2/кг.
Кремнеземистые породы природных глин (диатомиты, опоки и трепелы), которые принадлежат к группе алюмосиликатов (Al2O3+ SiО2) щелочных и щелочноземельных металлов, также относятся к мезопористым адсорбентам, их используют в виде суспензий, нанесенных на фильтрующую основу, обычно ткань. Фильтрующие адсорбенты подобного типа применяют для очистки растворов и сиропов от взвесей, коллоидных и желеобразных веществ в сахарной, пивоваренной промышленности и при производстве соков, для обесцвечивания сахарных и глюкозных сиропов. При помощи глин в процессе рафинации жиров осуществляется их очистка от свободных жирных кислот и красящих веществ.
|
|
|
К микропористым минеральным порошкообразным адсорбентам относятся цеолиты, которые представляют собой щелочные (Na, К) и щелочноземельные (Са, Mg) алюмосиликаты и характеризуются общей формулой MenAlxSiy(Н2О)z, где Me – ион металла. Цеолиты могут быть природные и синтетические. Наибольшее значение цеолиты приобретают в процессе осушки газов и воздуха, а также при очистке различных жидких продуктов.
Угольные микропористые адсорбенты получают высокотемпературной обработкой без доступа воздуха различных ископаемых углей, древесины, торфа и других веществ, богатых углеродом. После дополнительной обработки паром или инертными газами для очистки пор и введения добавок, способствующих адсорбции, получают активированные угли. За счет пористости активированного угля его удельная поверхность увеличивается на три порядка и превышает 4∙105 м2/кг, а объем его пор – 0,5∙10–2 м3/кг (0,5 см3/г). Активированный уголь, который используется в медицинских целях, выпускается в виде таблеток массой 0,25 г, в одной такой таблетке реализуется поверхность около 100 м2. Угольные адсорбенты широко используются в различных отраслях промышленности. Существуют более 1000 различных марок адсорбентов на основе активированных углей, свыше 200 из них применяются в пищевой промышленности.
Адсорбция газов
Адсорбция газов на микро- и мезопористых адсорбентах существенным образом отличается от их адсорбции на непористых и макропористых адсорбентах.
Для непористых и макропористых адсорбентов наблюдается мономолекулярная и полимолекулярная адсорбция (см. рис. 4.3). В случае порошкообразных адсорбентов различие между ними обусловлено лишь величиной удельной поверхности.
Причины и различные теории адсорбции, которые были рассмотрены в гл. 4, характерны для адсорбции газов на непористых и макропористых адсорбентах.
В случае адсорбции газов уравнение Гиббса (4.18) приобретает следующий вид:
Г = –(р/RТ)(dσ/dр), (6.1)
где р – равновесное парциальное давление адсорбтива в газовой среде.
Уравнение (6.1) характеризует мономолекулярную и полимолекулярную адсорбцию газов на твердых поверхностях, которая происходит в результате физической адсорбции и хемосорбции.
Для мономолекулярной адсорбции при соблюдении условия (4.3) справедливо уравнение Ленгмюра (4.34), которое можно представить в виде
 (6.2)
(6.2)
где Г(А), Г∞(А∞) – гиббсовская текущая и предельная адсорбция газов.
Физический смысл предельной адсорбции тот же, что и в случае адсорбции на границе жидкость – газ.
Для адсорбции газов также справедливо полуэмпирическое уравнение Фрейндлиха [см. уравнения (4.25) и (4.26)]:
Г(А) = кр1/n ; lg Г(А) = lg к + (1/n)lg p. (6.3)
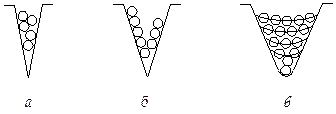 |
В случае адсорбции азота слюдой при 90 К, когда адсорбция равна 10–3 м3/кг, коэффициенты уравнения (6.3) к = 8,4, n = 0,414.
 |
Для небольших концентраций или парциальных давлений газа существует линейная зависимость между адсорбцией и давлением и удовлетворительно соблюдаются закон Генри и уравнение (4.24):
Г = кГ р. (6.4)
Подчеркнем еще раз, что уравнение Гиббса (4.18) характерно для избыточной адсорбции, а уравнения (6.2)–(6.4) – для абсолютной и избыточной адсорбции в том случае, когда концентрация адсорбтива в объеме пренебрежимо мала по сравнению с концентрацией адсорбата в адсорбционном слое, т.е. выполняется условие (4.3).
Уравнения (6.1)–(6.4) справедливы для адсорбции на непористых и пористых адсорбентах. Фундаментальное уравнение адсорбции Гиббса в форме (6.1), однако, не может быть использовано практически в связи со сложностью определения как величины dσ/dp, так и самого поверхностного натяжения твердых тел (см. параграф 2.2).
В микро- и мезопорах процесс адсорбции существенным образом отличается от адсорбции на непористых и макропористых адсорбентах. Для микропористых адсорбентов это отличие заключается в объемном заполнении микропор (рис. 6.2, а). Размеры микропор небольшие, но их очень много, поэтому микропоры обладают относительно большим объемом и удельной поверхностью (см. табл. 6.1).
Во всем объеме микропор действует поле адсорбционных сил, которое и определяет особенности адсорбции. Теорию объемного заполнения микропор, являющуюся дальнейшим развитием потенциальной теории Поляни (см. параграф 4.3), разработал М. М. Дубинин. Согласно развиваемым им представлениям, адсорбция в этом случае определяется уже не поверхностью микропор, а их объемом V. Предельная адсорбция Г∞(А∞) будет определяться предельным объемом адсорбционного пространства V∞, а адсорбция прямо пропорциональна объему пор.
Поры полидисперсны, поэтому их адсорбционный объем неодинаков. Заполнение адсорбатом объема микропор и адсорбция в них подчиняются одной и той же закономерности, а именно
V = V∞exp[–(ε/E)n]; (6.5)
Г = Г∞exp[–(ε/E)n], (6.6)
где V,V∞– заполненный адсорбатом и предельный объем адсорбционного пространства, n – параметр, не зависящий от температуры и характеризующий энергию адсорбции Е; ε – адсорбционный потенциал.
Микропоры заполняются не целиком. Отношение между объемом, занимаемым адсорбатом V, и объемом микропор V∞ характеризует степень заполнения микропор, а именно
a = V/V∞. (6.7)
Уравнение (6.6) можно представить в логарифмическом виде:
 (6.8)
(6.8)
Таким образом, адсорбция в условиях объемного заполнения микропор отличается от адсорбции на плоских поверхностях, а условия адсорбции характеризуются уравнениями (6.6) и (6.8).
Адсорбционный потенциал ε, или дифференциальная работа адсорбции в соответствии с теорией Поляни, аппроксимируется при помощи уравнения (4.20). Используя это уравнение, преобразуем формулу (6.8):
lg Г = lg Г∞ – Пlg(pн /p)n, (6.9)
где П = 2,3n+1(RT/E)n –постоянная величина для данного адсорбтива и температуры, р, рн – парциальное давление адсорбтива и его насыщенного пара.
Для активированных углей коэффициент n равен 1 или 2. Если n = 1, уравнение (6.9) упрощается:
lg Г = lg Г∞ – Пlg(pн /p). (6.10)
В этом уравнении, как и в уравнении Фрейндлиха (6.3), адсорбция зависит от парциального давления адсорбтива и давления его насыщенных паров. Уравнения (6.9) и (6.10) по форме аналогичны уравнению Фрейндлиха, которое в этом случае следует рассматривать как выражение адсорбции при объемном заполнении пор.
Адсорбция на мезопористых поверхностях протекает в основном по механизму капиллярной конденсации. Сначала (см. рис. 6.2, б) в этих порах, называемых капиллярными, образуются монослой или полислой адсорбата. Затем происходит конденсация паров (см. рис. 6.2, в), в результате чего в порах образуется жидкость, которая и заполняет капилляры.
Соотношение между давлением насыщенного пара над вогнутой поверхностью p по сравнению с плоской рs (см. рис. 2.7) определяется уравнением (2.26), которое можно представить в следующем виде:
 . (6.11)
. (6.11)
Из уравнения (6.11) следует, что капиллярная конденсация происходит при условии, когда р/рs <1, т.е. р < рs , и r < 0.
Если жидкость смачивает поры, то в них образуется вогнутый мениск. Давление насыщенного пара над вогнутой поверхностью меньше, чем над плоской (см. рис. 2.7, в). В результате капиллярная конденсация в порах протекает при давлениях, меньших давления насыщенного пара, и более интенсивно, чем над плоской поверхностью.
Капиллярная конденсация тем значительнее, чем меньше размеры пор и больше кривизна мениска жидкости, и характерна для всего диапазона размеров мезопор.

 Изотерма адсорбции на пористых адсорбентах в случае капиллярной конденсации имеет своеобразную петлю (рис. 6.3), характеризующую гистерезис. Нижняя ветвь 1 петли определяет адсорбцию, а верхняя 2 — десорбцию. Сконденсированная жидкость, заполняя сначала часть объема пор, уменьшает их размеры и ускоряет тем самым капиллярную конденсацию и заполнение всего объема пор. В верхней части на краях пор в случае смачивающей жидкости образуется вогнутый мениск. Давление, при котором происходит испарение жидкости из пор, будет определяться не радиусом пор, а радиусом мениска жидкости. Уменьшение радиуса мениска по сравнению с радиусом пор в соответствии с уравнением (6.11) означает, что десорбция может начаться при меньшем давлении, чем адсорбция, т.е. для извлечения жидкости из капилляра необходимо меньшее давление, чем для заполнения капилляра. Это обстоятельство является одним из важнейших, определяющих гистерезисные явления.
Изотерма адсорбции на пористых адсорбентах в случае капиллярной конденсации имеет своеобразную петлю (рис. 6.3), характеризующую гистерезис. Нижняя ветвь 1 петли определяет адсорбцию, а верхняя 2 — десорбцию. Сконденсированная жидкость, заполняя сначала часть объема пор, уменьшает их размеры и ускоряет тем самым капиллярную конденсацию и заполнение всего объема пор. В верхней части на краях пор в случае смачивающей жидкости образуется вогнутый мениск. Давление, при котором происходит испарение жидкости из пор, будет определяться не радиусом пор, а радиусом мениска жидкости. Уменьшение радиуса мениска по сравнению с радиусом пор в соответствии с уравнением (6.11) означает, что десорбция может начаться при меньшем давлении, чем адсорбция, т.е. для извлечения жидкости из капилляра необходимо меньшее давление, чем для заполнения капилляра. Это обстоятельство является одним из важнейших, определяющих гистерезисные явления.
Адсорбция жидкости
Адсорбция на поверхности твердого тела, граничащего с жидкостью, в зависимости от природы адсорбтива и адсорбента и механизма процесса может быть молекулярной, ионной и ионообменной. Молекулярная адсорбция осуществляется из растворов, а адсорбтивом являются молекулы растворенного вещества. К разновидностям молекулярной адсорбции относится адсорбция ПАВ.
В случае адсорбции на границе раздела Т–Ж уравнение (4.10) можно представить в следующем виде:
 , (6.12)
, (6.12)
где σТЖ – межфазовое поверхностное натяжение на границе раздела твердое тело – жидкость.
При формировании адсорбционного слоя из молекул одного вещества изменение поверхностного натяжения в соответствии с фундаментальным уравнением адсорбции Гиббса (4.14) можно представить таким образом:
ΔσТЖ = – ГΔμ ТЖ. (6.13)
В результате адсорбции ПАВ происходит снижение поверхностного натяжения.
Адсорбция ПАВ на границе раздела твердое тело – жидкость имеет много общего с адсорбцией ПАВ на границе жидкости с газом (см. рис. 5.2), но характеризуется некоторыми особенностями. Общность заключается в том, что уравнения Генри, Фрейндлиха, Ленгмюра [см. уравнения (4.24), (4.25) и (4.34)], а также правило Траубе—Дюкло [см. условие (5.13)] справедливы для всех случаев адсорбции ПАВ (в том числе и на границе твердого тела с жидкостью). Например, значения коэффициентов уравнения Фрейндлиха в случае адсорбции уксусной кислоты (которая обладает поверхностно-активными свойствами) на активированном угле составляют k = 2,99 и 1/n = 0,52.
Адсорбцию на порошкообразном адсорбенте можно выразить количественно с учетом концентрации растворенного вещества. Если в раствор объемом V с первоначальной концентрацией ПАВ или какого-либо другого вещества с0 поместить пористый порошкообразный адсорбент, например активированный уголь массой m, то часть ПАВ из раствора будет адсорбироваться на твердой поверхности. В результате концентрация вещества в растворе снизится и станет равной с. Снижение концентрации на величину с0–с произошло в результате адсорбции ПАВ на поверхности адсорбента, величину избыточной (гиббсовской) адсорбции можно определить по формуле
 (6.14)
(6.14)
Адсорбция будет выражаться в моль/кг, если с имеет размерность моль/м3, V – м3, а m – кг.
Уравнение (6.14) используют для определения количества ПАВ, адсорбируемого на поверхности твердого тела.
В отличие от адсорбции ПАВ на границе Ж–Г ориентация адсорбционного слоя молекул ПАВ зависит от свойств адсорбата и адсорбента. На границе вода — воздух (см. рис. 5.2, б) молекулы ПАВ ориентированы всегда одинаково: гидрофильной полярной частью к воде, а гидрофобным углеводородным неполярным радикалом – к воздуху
Ориентация молекул ПАВ на границе раздела твердое тело — жидкость происходит в соответствии с правилом уравнивания полярности Ребиндера. Рассмотрим пример, который показан на рис. 6.4, а. На границе раздела неполярного твердого тела, каковым является уголь, с водой — полярной жидкостью — адсорбционный слой молекул ПАВ ориентирован гидрофильной частью в сторону жидкости. Гидрофильную часть молекул ПАВ составляет полярный радикал (см. рис. 5.1), имеющий дипольный момент. Адсорбционный слой молекул ПАВ экранирует твердую поверхность и сообщает этой поверхности полярные свойства.
Таким образом, граница раздела неполярное твердое тело – полярная жидкость в результате адсорбции заменяется на границу раздела полярная часть адсорбционного слоя на твердой поверхности — полярная жидкость. Происходит уравнивание полярности фаз: из неполярно-полярной граница раздела становится полярно-полярной.
Уравнивание полярности фаз имеет место и во втором случае (см. рис. 6.4, б), когда гидрофильная полярная поверхность твердого тела, например диоксида кремния, контактирует с неполярной жидкостью — бензолом. Слой молекул ПАВ в данном случае ориентирован противоположным образом — гидрофобная, неполярная углеводородная часть его обращена в сторону неполярного бензола, а гидрофильная — в сторону полярной твердой поверхности диоксида кремния. Первоначальная граница полярное твердое тело — неполярная жидкость в результате адсорбции заменяется на неполярный адсорбционный слой твердой поверхности — неполярная жидкость. Ориентация адсорбционного слоя зависит не только от полярности гидрофильной части молекул ПАВ, но и от полярности твердого тела и жидкости, в которой растворены ПАВ. Мерой полярности гидрофильной части молекул ПАВ, твердого тела и жидкости является дипольный момент, а полярность молекулы в целом определяет диэлектрическая проницаемость.

Рис. 6.4. Строение адсорбционного слоя молекул ПАВ:
а — неполярное тело (уголь) — полярная жидкость (вода);
б — полярное тело (диоксид кремния) — неполярная жидкость (бензол)
Согласно правилу Ребиндера для ориентации адсорбционного слоя, которая соответствует рис. 6.4, а, необходимо, чтобы соблюдалось следующее соотношение между диэлектрической проницаемостью жидкости εЖ, ПАВ εПАВ и адсорбента (твердого тела) εТ:
εЖ > εПАВ > εТ. (6.15)
Для примера, приведенного на рис. 6.4, a условие (6.15) означает, что диэлектрическая проницаемость воды должна быть больше диэлектрической проницаемости гидрофильной части молекул ПАВ, которая, в свою очередь, должна превышать диэлектрическую проницаемость твердого адсорбента, т.е. угля. При 293 К диэлектрическая проницаемость воды εЖ равна 81,8, а угля εТ. — 5,7. Из условия (6.15) следует, что адсорбция и формирование адсорбционного слоя возможны в случае, когда диэлектрическая проницаемость гидрофильной части молекул ПАВ будет меньше 81,8 и больше 5,7.
Активированный уголь – это типичный гидрофобный адсорбент. Цеолиты и фильтрующие дисперсные материалы представляют собой гидрофильные адсорбенты, механизм адсорбции на поверхности которых соответствует рис. 6.4, б.
Адсорбция ПАВ на твердой поверхности происходит самопроизвольно, приводит к снижению свободной поверхностной энергии и одновременно вызывает снижение прочности твердого тела. Адсорбционное понижение прочности твердых тел было открыто нашим соотечественником, академиком П.А.Ребиндером и по его имени называется эффектом Ребиндера. Этот эффект не связан с коррозией, растворением твердого тела и другими побочными явлениями, а вызван исключительно адсорбцией ПАВ. Еще в 1928 г. автор эффекта обнаружил снижение прочности некоторых неорганических кристаллов (гипса, графита, ВаСО3, монокристаллов кальцита и др.) в растворах олеиновой и масляной кислот, пропилового и других спиртов, являющихся ПАВ.
В основе адсорбционного понижения прочности лежит соотношение (6.13). Снижение поверхностного натяжения по Ребиндеру можно выразить следующим образом:
 (6.16)
(6.16)
где σ0ТЖ, σТЖ — межфазовое поверхностное натяжение жидкости и раствора ПАВ; n – число молекул адсорбата, определяемое по уравнению (4.33); с – концентрация адсорбтива ПАВ.
Снижение поверхностного натяжения обусловливает уменьшение работы, необходимой для образования поверхности раздела фаз и прочности материала, способствует его разрушению. Разрушение можно рассматривать как процесс образования новой поверхности в трещинах и разломах. Адсорбционное понижение прочности происходит тогда, когда ПАВ адсорбируются на внутренней поверхности твердого тела – трещинах, выемах, дефектах структуры и др. Таким образом, необходимым условием проявления эффекта Ребиндера являются наличие трещин и растворов ПАВ в них, а также миграция растворов к вершине развивающейся трещины.
В результате эффекта Ребиндера существенно облегчается процесс деформации и разрушения твердых тел. В промышленности эффект Ребиндера наблюдается при получении дисперсных систем диспергированием (см. параграф 12.2) в цементной, мукомольной, комбикормовой и других отраслях. Он является одним из факторов, позволяющих регулировать структурно-механические свойства дисперсных систем (см. гл. 11).
Адсорбция ионов
Адсорбция ионов на твердой поверхности протекает в том случае, когда эта поверхность соприкасается с растворами электролитов. Ионы одного знака удерживаются на твердой поверхности сильнее, чем ионы другого знака, которые остаются в растворе. Удержание ионов твердым телом определяется электростатическими и химическими силами, которые зависят от свойств твердого тела и самих ионов. Адсорбция ионов происходит в соответствии с некоторыми эмпирическими правилами.
При адсорбции ионов на кристаллических поверхностях прослеживается определенная закономерность: адсорбируются те ионы, которые способны достраивать кристаллическую решетку твердого тела, находятся в избытке и дают труднорастворимые соединения. Эту особенность адсорбции ионов по имени авторов, установивших ее, называют правилом Фаянса – Панета.
Справедливость этого правила можно проиллюстрировать на примере кристалла AgI (рис. 6.5): ионы Ag+ в кристалле обозначены «+», а ионы I– — «–». Когда твердая кристаллическая поверхность соприкасается с раствором AgNO3 (рис. 6.5, а), то адсорбируются ионы, способные достраивать кристаллическую решетку, т.е. ионы Ag+. Поверхность твердого тела приобретает положительный заряд. В растворе KI (рис. 6.5, б) адсорбируются анионы I–, и поверхность заряжается отрицательно.

Рис. 6.5. Механизм адсорбции ионов на кристалле Agl
Существуют еще и другие эмпирические правила, характеризующие особенности адсорбции ионов разного размера и заряда. Для ионов одинакового знака, чем больше порядковый номер элемента, тем выше его способность к адсорбции. Максимальной адсорбцией обладают ионы наибольшего размера.
Это эмпирическое правило можно пояснить на примере адсорбции одновалентных катионов первой группы периодической системы элементов (рис. 6.6). Все одновалентные ионы в водном растворе несут одинаковый заряд. Ион лития Li+ по сравнению с другими имеет меньший размер и вследствие этого большую плотность заряда на единицу поверхности самого иона. Заряд иона способствует ориентации полярных молекул воды. В результате вокруг иона образуется гидратная оболочка из молекул воды, которая экранирует сам ион. По мере увеличения порядкового номера иона, что соответствует росту его размеров, плотность заряда снижается. Подобное обстоятельство приводит к уменьшению размеров и снижению экранирующего действия гидратной оболочки. Это снижение, которое связано с увеличением размеров ионов, показано на рис. 6.6.

Рис. 6.6. Лиотропный ряд одновалентных катионов:
1 — полярные молекулы воды, образующие гидратную оболочку;
2, 3 — внутренняя и наружная границы гидратной оболочки
Таким образом, адсорбционная способность ионов находится в прямой зависимости от размеров гидратной оболочки и ее экранирующего действия. Для иона Li+ гидратная оболочка будет иметь максимальный размер, а адсорбционная способность становится минимальной. Для иона Cs+ наоборот: гидратная оболочка – наименьших размеров, а адсорбционная способность наивысшая.
Ряд ионов одинаковой валентности, расположенных в порядке их способности к адсорбции, называют лиотропным рядом. Для одновалентных катионов (см. рис. 6.6) лиотропный ряд выглядит следующим образом:
Li+ < Na+ < K+ < Rb+ < Cs+. (6.17)
Для двухвалентных катионов второй группы элементов периодической системы этот ряд можно представить так:
Mg2+ < Са2+ < Sr2+ < Ва2+. (6.18)
Существуют лиотропные ряды и для анионов, r частности одновалентных:
Cl– < Br– < NO3– < I– < NCS–. (6.19)
В лиотропном ряду, в том числе и в приведенных выше (6.17)–(6.19), крайний левый ион обладает наименьшей адсорбционной способностью, а крайний справа – наибольшей.
Адсорбция ионов зависит и от величины его заряда – чем выше заряд ионов, тем значительнее адсорбционная способность этих ионов.
Ионообменная адсорбция
Помимо адсорбции ионов возможен обмен между ионами раствора и твердой поверхности. Ионный обмен связан с адсорбцией ионов из раствора электролита и десорбции ионов из твердой поверхности в раствор. Поэтому ионный обмен называют ионообменной адсорбцией.
Ионный обмен – это обратимый процесс эквивалентного (стехиометрического) обмена ионами между раствором электролитов и твердым телом (ионитом). Иониты, которые еще называют ионо-обменниками или ионообменными сорбентами, представляют собой вещества, способные к ионному обмену при контакте с растворами электролитов. Ионит имеет две группы ионов (рис. 6.7), одна из них содержится в фазе ионита, а другая способна диссоциировать и является электролитом.

Рис. 6.7. Модель матрицы катионита:
1 — каркас; 2 — фиксированный анион;
3 — подвижный катион, способный к ионному обмену
По знаку обмениваемых ионов различают катиониты и аниониты. Они состоят из каркаса (матрицы), который обладает определенным зарядом, и ионом, способным к обмену. Катионит имеет закрепленные анионогенные группы и катионы, способные к обмену с окружающей средой. Если обозначить каркас катионита через [...], то типичная реакция катионного обмена выглядит следующим образом:
Кат+1 [...]– + Кат+2→ Кат+2 [...]– + Кат+1 . (6.20)
Анионы содержат закрепленные катионогенные группы и способные к обмену анионы. Реакция анионного обмена происходит по схеме
[...]+ Ан–1 + Ан–2 → [...]+ Ан–2 + Ан–1 . (6.21)
Катиониты содержат катионы Кат+, которые способны обмениваться на такие ионы раствора, как H+, Na+, K+, Ca2+, Mg2+ и др. У анионов обменными являются анионы Ан–: ОН–, С1–, SO2-4 и др., а каркас несет положительный заряд. Существуют еще амфолиты, которые в зависимости от условий способны проявлять катионообменные и анионообменные свойства.
Процесс ионного обмена включает следующие последовательные стадии: 1) движение адсорбированного иона к поверхности зерна адсорбента; 2) перемещение адсорбированного иона внутри зерна адсорбента; 3) собственно ионный обмен; 4) перемещение вытесняемого иона внутри зерна адсорбента; 5) переход вытесняемого иона от поверхности зерна адсорбента в раствор. Все стадии, кроме собственно химической реакции обмена, носят диффузионный характер, который и определяет суммарную скорость ионного обмена. Расчеты диффузионных стадий базируются на законах Фика (см. параграф 9.3). Коэффициенты диффузии определяют экспериментально; их значения для внешней диффузии составляют 10–9м2 ∙ с–1, а для внутренней (на второй и четвертой стадиях ионного обмена) – от 10–10 до 10–15 м2 ∙ с–1.
Ионный обмен имеет некоторое сходство с адсорбцией – на поверхности твердого тела происходит концентрирование ионов растворенного вещества. В то же время ионный обмен представляет собой стехиометрическое замещение – в обмен на адсорбцию ионит отдает в раствор эквивалентное количество другого иона с зарядом того же знака. Подобный процесс в случае адсорбции отсутствует. На практике, однако, трудно провести грань между процессами адсорбции и замещения, особенно учитывая, что адсорбенты могут быть одновременно и ионитами.
Различают природные и синтетические иониты. К природным относятся алюмосиликатные материалы – монтмориллонит, гидрослюда, цеолиты и др., а к синтетическим – ионообменные смолы. сульфированные угли (сульфоуголь), ионообменные целлюлозы, содержащие следующие функциональные группы: –SO3H, –COOН, –РО(ОН)2, –CH2OH.
Ионообменные свойства ионитов характеризуются некоторыми особенностями. Oни селективны, т.е. проявляются для определенных ионов и зависят от ряда условий, в том числе от рН среды. Ионообменная способность ионитов небезгранична. Она характеризуется емкостью, показывающей, какое число г-экв ионов может адсорбироваться на 1 кг сухого ионита. В связи со специфичностью свойств ионитов их ионообменную способность (емкость) определяют по отношению к 0,1 н раствору NaOH (для катионита) или 0,1 н раствора НСl (для анионита) Поэтому емкость ионита является условной величиной. Именно эта величина приведена в табл. 6.2.
Иониты находят широкое применение в различных отраслях. Например, иониты в аналитической химии позволяют концентрировать мельчайшие количества определяемых веществ, оценивать состав и концентрацию различных ионов, удалять мешающие обмену ионы, разделять количественно компоненты сложных смесей.
Ионообменная адсорбция применяется для очистки от примесей, умягчения и обессоливания воды в очистительных сооружениях (в том числе и городских и в приборах индивидуального пользования), в атомной энергетике, в электронной и других отраслях промышленности, для гидрометаллургической переработки бедных руд различных цветных металлов, при получении лекарственных препаратов, для очистки сточных вод и других целей. Причем часто осуществляется комплексная очистка с помощью анионитов и катионитов.
Т а б л и ц а 6.2
Иониты, применяемые в пищевой промышленности
| Тип | Функци-ональные группы | Емкость г-экв/кг | Области применения |
| Катиониты Аниониты | –SO3Н –СOOH -N(CH3)3, –NH2,=NH | 3,0–7,0 6,0–10,0 2,5–5,0 | Производство молока и сахара, очистка воды от положительно заряженных примесей, умягчение воды, производство пищевых кислот и пектина. Разделение аминокислот, улавливание пищевых кислот, обесцвечивание сахарорафинадных растворов. Очистка воды от отрицательно заряженных примесей, понижение кислотности молока. |
Иониты различного класса применяют в пищевой промышленности для химическою анализа пищевых продуктов (табл. 6.2). Иониты широко используют для очистки воды и для удаления различных примесей, содержащихся в жидких пищевых массах и полупродуктах. Например, для тщательного удаления красящих веществ свекловичного и тростникового соков на заключительной стадии обработки применяют иониты. Первоначально сок пропускают через катионит для удаления одновалентных и двухвалентных катионов (K+, Ca2+, Mg2+ и др.). Ионный обмен происходит по схеме (6.20). Катионит поглощает катионы, отдавая при этом раствору ионы Н+. При помощи анионного обмена, который протекает по схеме (6.21), улавливают анионы Сl–, SO2-3, SO2-4 и др., а в раствор переходят анионы анионита.
Ионный обмен имеет место в почве, и ее ионообменная емкость является одной из характеристик, определяющих ценность почвы.
Почва представляет собой сложную дисперсную систему, в состав которой входят высокодисперсные частицы размером от 0,001 до 0,2 мкм. Они образуют коллоиды почвы и своеобразный почвенный комплекс. В его состав входят нерастворимые в воде алюмосиликатные, органические и органоминеральные соединения (глина, гумус), которые формируют своеобразный ионит. Благодаря огромной поверхности почвенный комплекс обладает повышенной адсорбционной и ионообменной способностью, главным образом катионообменной. Катионообменные свойства являются основной причиной поступления в почву и удержания в ней многих важных для питания растений катионов. Например, при поглощении ионов кальция и магния, которые необходимы для развития растений, ионный обмен протекает по следующей схеме:
Ca2+[...]2– + 2H+ → H2+ [...]2– + Ca2+. (6.22)
Почвенный Растение Почвенный Растение
комплекс комплекс
↑
Ca2+
Почвенный раствор
Кислые и щелочные почвы неблагоприятны для развития растений. Поэтому кислотность почвы, т.е. величина рН, является важнейшим ее показателем. Если в нейтральных почвах ионообменную емкость почвенного комплекса определяют катионы Ca2+ и Mg2+, а в кислых – Al3+ и Н+, то для щелочных почв катионный обмен обусловлен ионом Na+. Подкисление почв происходит за счет выделения корнями растений ионов водорода, угольной и органических кислот.
Для бедных почв (подзол, суглинок) обменная емкость недостаточна для проявления ионообменных свойств и составляет 0,05 – 0,2 г-экв/кг. В черноземных почвах (их ионообменная способность 0,6 – 0,8 г-экв/кг) осуществляется ионный обмен за счет ионов Са2+ и Mg2+.
Путем известкования можно возродить плодородие кислых почв, к которым относятся и торфяные почвы, так как их ионообменные свойства определяются катионом Н+. Для придания этим почвам необходимых свойств производят их известкование или обработку аммиачной селитрой.
H2+ [...]2– + Ca(OH)2 → Ca2+[...]2– + 2H2O,
Н+[...]– + NH4OH → NH4+ [...]– + H2O. (6.23)
Торф Торф
Торф приобретает катионы Ca2+ и , которые затем усваиваются растениями в результате ионного обмена [см. схему (6.22)]. Известкование почв можно проводить путем введения кальциево-магниевых карбонатных пород (известняков, доломитов и др.).
Таким образом, ионообменные адсорбционные процессы не только широко применяются в различных отраслях промышленности, но и имеют прямое отношение к урожайности сельскохозяйственных культур и качеству растительного сырья.
Дата добавления: 2018-11-24; просмотров: 4095; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
