Фундаментальное уравнение адсорбции Гиббса
Адсорбция относится к поверхностным явлениям и протекает самопроизвольно. Концентрация веществ на поверхности раздела фаз происходит до достижения равновесия между процессами адсорбции и десорбции (см. рис. 4.1).
Для нахождения условий протекания самопроизвольного равновесного процесса обратимся к основам химической термодинамики. Адсорбция идет самопроизвольно, когда имеет место уменьшение энергии Гиббса, т.е. dG < 0. Согласно условию (2.1) для изобарно-изотермического процесса в отсутствие изменений площади поверхности раздела фаз и заряда поверхности (dТ = 0, dp = 0, dB = 0 и dq = 0) можно записать
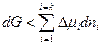 . (4.6)
. (4.6)
Для однокомпонентной системы получим
dG < Δμdn, или ΔG < ΔμΔn. (4.7)
Если обозначить химический потенциал i-гo компонента в объеме адсорбтива через (μiV ) и на поверхности адсорбента (μiВ), то согласно согласно (4.7) изменение энергии Гиббса определится по формуле
ΔG < (μiB – μiV )dni . (4.8)
Для самопроизвольных процессов (dG < 0) из условия (4.8) получим
μiV > μiB. (4.9)
Химический потенциал является фактором интенсивности любого физико-химического процесса, в том числе и адсорбции. Согласно условию (4.9) химический потенциал вещества в объеме μiV превышает химический потенциал этого же вещества на поверхности μiB.
|
|
|
Процесс адсорбции будет протекать до тех пор, пока будут достигнуты равновесные условия, т.е. до достижения состояния, когда ΔG = 0, что, согласно условию (4.8), соответствует равенству химических потенциалов адсорбтива и адсорбата (μiV = μiB). В условиях равновесия скорости адсорбции и десорбции становятся равными.
На основании этого адсорбцию можно определить как процесс выравнивания химического потенциала, приводящего к росту концентрации компонентов на границе раздела фаз по сравнению с их концентрацией в объеме.
Для изобарно-изотермического процесса, когда dT = 0, dp = 0, dq = 0, с учетом всех компонентов системы в условиях равновесия (dG = 0) из уравнения (2.1) получим
μidni + σdB = 0. (4.10)
Это уравнение связывает поверхностное натяжение с процессами, протекающими на границе раздела фаз. В нем экстенсивные величины стоят под знаком дифференциала (dni и dВ). Для однородной функции первой степени относительно экстенсивных величин можно воспользоваться теоремой Эйлера, которая позволяет интегрировать это уравнение при постоянных значениях коэффициентов интенсивных величин (μi и σ) при дифференциалах.
|
|
|
Напомним, что согласно теореме Эйлера любая однородная функция степени k, имеющая непрерывные частные производные, удовлетворяет равенству
f/x(x,y,z)x + f/y(x,y,z)y + f/z(x,y,z)z = kf(x,y,z).
Однородной называется функция, если при умножении всех ее аргументов на множитель она приобретает этот же множитель в k-й степени, т.е. f(tx1, ..., txm) = fk(x1, ..., xm).
Таким образом, если состав поверхностного слоя не изменяется, что соответствует конечному значению В и ni, то можно записать
 . (4.10, a)
. (4.10, a)
Полный дифференциал от всех переменных уравнения (4.10, а) выглядит так:
 . (4.11)
. (4.11)
Из уравнения (4.11) вычтем уравнение (4.10), в результате получим
 . (4.12)
. (4.12)
Используя уравнение (4.4) для выражения адсорбции, вместо формулы (4.12) можно записать
 ;
;  . (4.13)
. (4.13)
Это уравнение называют фундаментальным уравнением адсорбции Гиббса.
В случае адсорбции только одного компонента уравнение (4.13) упрощается:
–dσ = Гdμ; Г = –dσ/dμ. (4.14)
Уравнения (4.13) и (4.14) справедливы для всех видов адсорбции; они показывают, что при адсорбции происходит самопроизвольное снижение удельной свободной поверхностной энергии (поверхностного натяжения) по мере изменения химического потенциала.
|
|
|
Адсорбция определяется избытком концентрации адсорбива с и обусловлена изменением поверхностного натяжения σ, которое зависит от температуры (см. параграф 2.3). Все величины, определяющие адсорбцию, взаимосвязаны, т.е. Г = f(c, σ, Т). Для нахождения этой зависимости воспользуемся уравнениями (4.13), в которых dσ характеризует уменьшение поверхностного натяжения в результате самопроизвольного процесса при адсорбции; Гi определяет адсорбцию количественно, а dμi показывает возможность и интенсивность самопроизвольного процесса в результате изменения химического потенциала.
Используя уравнения (4.13), определим адсорбцию одного i-гo компонента из смеси веществ:
Гi = – (дσ/дμi)μ1, …, μi–1, μi+1, ..., μk. (4.15)
Адсорбция одного компонента i согласно условию (4.15) есть частная производная от поверхностного натяжения (удельной свободной поверхностной энергии) по изменению химического потенциала при постоянных химических потенциалах других компонентов.
Для нахождения химического потенциала воспользуемся следующим соотношением:
|
|
|
μi = μi0 + RTlnc, (4.16)
где μi, μi0 – равновесный и стандартный химический потенциал адсорбтива; с – концентрация адсорбтива.
Если адсорбтив является сильным электролитом и его концентрация значительна, то вместо концентрации в этом уравнении следует использовать активность а.
Дифференцируя уравнение (4.16) и учитывая, что μi0 есть величина постоянная, получим
dμi = RTdlnc = RT(dc/c). (4.17)
Заменив dμi в уравнении (4.13), подставив полученное выражение для dμi в уравнение (4.17), получим
Г = – (с/RT)(dσ/dc). (4.18)
Уравнение (4.18) непосредственно следует из фундаментального уравнения адсорбции Гиббса (4.14) и характеризует влияние на избыточную адсорбцию концентрации адсорбтива и температуры, а также изменение поверхностного натяжения (удельной свободной поверхностной энергии) в зависимости от концентрации адсорбтива. Оно справедливо для всех видов адсорбции.
Таким образом, уравнение (4.18) связывает между собой основные параметры, характеризующие адсорбцию (Г, с, Т и σ), и определяет результат самопроизвольного процесса за счет снижения поверхностного натяжения. Обычно рассматривают зависимость адсорбции от концентрации адсорбтива, что и будет использовано в дальнейшем.
Причины и механизм адсорбции
Термодинамический подход, определяя возможность протекания адсорбции, абстрагируется от механизма процесса. Для уяснения причин адсорбции необходимо прежде всего рассмотреть особенности адсорбционных сил между адсорбентом и адсорбатом (в частности, когда в качестве адсорбента выступает твердая поверхность).
В зависимости от природы адсорбционных сил различают физическую и химическую адсорбцию. Последнюю называют хемосорбцией. При физической адсорбции взаимодействие адсорбента и адсорбата осуществляется за счет сил Ван-дер-Ваальса и водородных связей, а при хемосорбции — за счет образования химической связи. В результате физической адсорбции молекулы адсорбата сохраняют свои индивидуальные особенности. Физическая адсорбция обратима, малоспецифична, т.е. в незначительной степени зависит от природы адсорбата, не локализована (адсорбированные молекулы в состоянии передвигаться по поверхности адсорбента), может привести к образованию нескольких адсорбционных слоев и уменьшается с ростом температуры. За счет физической адсорбции осуществляется, например, адсорбция паров воды.
При хемосорбции молекулы адсорбата образуют с адсорбентом поверхностные химические соединения. Хемосорбцию следует рассматривать как химическую реакцию на поверхности раздела фаз, а применительно к дисперсным системам – между фазой и средой.
Между физической и химической адсорбцией существует много промежуточных случаев, обусловленных образованием водородных связей, электростатическими силами взаимодействия между ионами, диполями или квадруполями и другими причинами в зависимости от химической природы молекул адсорбтива и адсорбента. Значительная часть промежуточных случаев вызвана специфической адсорбцией, которая определяется химической природой молекул адсорбата и адсорбента. Кроме того, адсорбция зависит от геометрии поверхности раздела — в случае плоской поверхности речь идет об адсорбции на самой поверхности, а для пористой поверхности — об адсорбции в порах адсорбента.
В качестве адсорбента в промышленности широко применяют активированные угли (углеродные адсорбенты с развитой пористой структурой). При адсорбции на них, например, кислорода образуется химическая связь.
Хемосорбция необратима, определяется свойствами взаимодействующих молекул, т.е. специфична и локализована. Последнее обусловлено фиксированным положением адсорбированных молекул в основном в пределах одного адсорбционного слоя. Поэтому хемосорбция часто приводит к мономолекулярной адсорбции. В случае активированной хемосорбции, когда для осуществления химической реакции необходимо преодолеть энергетический барьер, определяемый энергией активации Е *, наблюдается увеличение адсорбции с ростом температуры.
К параметрам, определяющим равновесную адсорбцию (Г, А), относятся концентрация с (или парциальное давление адсорбтива р) и температура Т. Эти параметры связаны так называемым термическим уравнением адсорбции:
f(Г1, Г2, ...,Гi, ..., Гk; c1, c2, ..., сi, ..., сk; T) =0. (4.19)
В теории адсорбции обычно используют функцию Г(А) = φ[с(р)], которая определяет изотерму адсорбции (т.е. зависимость адсорбции от концентрации адсорбтива).
 |
Изотермы адсорбции могут иметь различный вид. На рис. 4.2 (кривая 1) приведена изотерма адсорбции, которая соответствует мономолекулярной адсорбции. Теория этого вида адсорбции разработана Ленгмюром. Основные предпосылки теории мономолекулярной адсорбции Ленгмюра заключаются в следующем (рис. 4.3, а): адсорбция происходит не на всей поверхности, а лишь в отдельных ее точках (активных центрах); энергия адсорбции всех молекул одинакова.
В случае адсорбции газов на твердых адсорбентах адсорбционное равновесие по Ленгмюру можно представить следующей схемой:
| Молекулы в газовой фазе | + | Свободный активный центр | → ← | Адсорбционный комплекс (заполненный центр) |
В качестве активных центров на твердой поверхности могут выступать группы химически активных атомов, катионы, нескомпенсированные соответствующим числом анионов и обнаруживающие высокое сродство к электронам. В результате адсорбции образуется один слой (монослой) адсорбированных молекул, взаимодействием между молекулами в котором можно пренебречь. Мономолекулярная адсорбция происходит в результате физической адсорбции газов при небольших давлениях и температурах, а также в результате хемосорбции.
Теория мономолекулярной адсорбции Ленгмюра, разработанная для адсорбции газов, редко оправдывается на практике. Тем не менее эта теория и методы определения адсорбции с ее помощью (см. параграф 5.4) не потеряли актуальности. Теория и уравнение Ленгмюра на ее основе позволяют получать приближенные, но достаточные для некоторых практических и теоретических целей решения. Дальнейшее развитие теории путем уточнения или исключения ряда допущений способствовало ее совершенствованию. В случае адсорбции из растворов и газов (см. параграфы 5.3 и 6.2) теория Ленгмюра отражает особенности адсорбционных процессов.
Полимолекулярную адсорбцию характеризует изотерма, имеющая S-образную форму (см. рис. 4.2, кривая 2). Этот вид адсорбции связан с образованием на поверхности адсорбента нескольких, во всяком случае больше одного, слоев молекул адсорбата.
Полимолекулярная адсорбция может проявляться в двух случаях: первый из них (см. рис. 4.3, б) соответствует потенциальной адсорбции, когда на поверхности адсорбента отсутствуют активные центры. Согласно этой теории, называемой по имени ее автора теорией Поляни, положение молекул адсорбата не локализовано.
Вблизи поверхности адсорбента существует потенциальное адсорбционное силовое поле, которое убывает по мере увеличения расстояния от поверхности. Равновесное давление адсорбтива вдали от поверхности адсорбента р возрастает и в области поверхностного слоя достигает значений давления насыщенного пара рs, при этом адсорбат конденсируется. Обратимая изотермическая работа ε адсорбционных сил, называемая адсорбционным, потенциалом, определяется следующим образом:
ε = RT lnps/p. (4.20)
Под воздействием адсорбционного потенциала создается возможность образования нескольких слоев молекул адсорбата. Наибольшее притяжение и сжатие испытывает первый адсорбционный слой; газообразные продукты в нем конденсируются в жидкость. Притяжение последующих слоев снижается до тех пор, пока плотность вещества понизится до его плотности в окружающей среде.
Потенциальная теория адсорбции Поляни позволяет описать адсорбцию на пористых адсорбентах, к которым относится, в частности, активированный уголь. Она получила дальнейшее развитие в теории объемного заполнения пор (см. параграф 6.2). Теория Поляни, однако, исключает возможность пересчета адсорбции с одной температуры на другую и не позволяет аналитически выразить изотермы адсорбции, что снижает ее значимость. Эта теория не получила практического подтверждения и в тех случаях, когда первый слой адсорбата представлял конденсированную жидкость.
При наличии активных центров на поверхности (см. рис. 4.3, в) адсорбционные слои не будут сплошными. Теория этого вида адсорбции разработана Брунауэром, Эмметом и Теллером и по первым буквам их фамилии называется теорией БЭТ. Теория БЭТ учитывает наличие активных центров (в этом заключается ее общность с теорией Ленгмюра) и возможность образования нескольких слоев адсорбата (в этом ее общность с теорией Поляни).
Согласно теории БЭТ при температуре ниже критической каждая молекула, адсорбированная в первом слое, является активным центром для молекул, образующих второй слой адсорбата, и т.д., а дифференциальная теплота адсорбции qа во всех слоях, кроме первого, равна теплоте конденсации ΔНк. В результате авторы получили следующее уравнение изотермы адсорбции:
 , (4.21)
, (4.21)
где k = ехр [(qa – ΔНк)/RT].
Уравнение (4.21) в координатах А – р/рs соответствует S-образной кривой
(рис. 4.4, а), а в координатах p/ps —  — прямой линии (см. рис.4.4, б). При 0,05 < р/рs < 0,30 по наклону этой прямой можно графически определить предельную адсорбцию А∞. Теория БЭТ позволяет также определить площадь, занимаемую одной молекулой адсорбата.
— прямой линии (см. рис.4.4, б). При 0,05 < р/рs < 0,30 по наклону этой прямой можно графически определить предельную адсорбцию А∞. Теория БЭТ позволяет также определить площадь, занимаемую одной молекулой адсорбата.
Теория БЭТ применима главным образом в случае адсорбции газов и паров на твердых поверхностях и предусматривает образование на поверхности адсорбента своеобразных последовательных комплексов, т.е. активных центров с несколькими слоями молекул адсорбата. Причем процесс адсорбции идет последовательно с образованием одного, двух и последующих слоев молекул. При этом, по аналогии с теорией Ленгмюра, оценивается абсолютная адсорбция.
Теория БЭТ позволяет по изотерме адсорбции определить поверхность адсорбента. Дальнейшее развитие теории БЭТ сделало ее более универсальной и позволило снять некоторые ограничения (учитывать энергетическую неоднородность адсорбента, взаимодействие молекул адсорбата).
Уменьшение подвижности молекул адсорбата по сравнению с подвижностью молекул адcорбтива приводит к уменьшению энтропии. В условиях равновесия изменение энергии Гиббса связано с изменением энтропии следующим образом:
ΔG = ΔH – TΔS. (4.22)
Когда ΔG = 0, a ΔS < 0, то ΔH < 0, т.е. адсорбция газов сопровождается выделением тепла.
Теплота физической адсорбции соизмерима с теплотой конденсации, а теплота хемосорбции значительно выше. Различают интегральную, дифференциальную и среднюю теплоты адсорбции.
Интегральная теплота адсорбции Qa равна убыли энтальпии при изменении адсорбции от А1 до А2: Qa = – (ΔH2 – ΔH1) и измеряется в единицах теплоты, приходящейся на единицу площади поверхности или массы адсорбента (Дж/м2 или Дж/кг).
Дифференциальная теплота qа равна убыли энтальпии при изменении адсорбции А на dA и измеряется в единицах теплоты, приходящейся на единицу количества адсорбата (Дж/моль); qа = (dН/dA). Тогда
Qa =  , или qа = dQ/dA. (4.23)
, или qа = dQ/dA. (4.23)
Средняя теплота адсорбции Qa, Дж/моль, находится по формуле
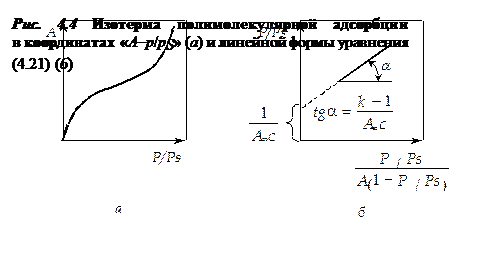 |
Qa = [Qa/(А2 – А1)]=
 . (4.23, a)
. (4.23, a)
Если дифференциальная теплота адсорбции показывает изменение интегральной теплоты в зависимости от изменения адсорбции, то средняя теплота характеризует отношение интегральной теплоты (а не ее изменение) к изменению адсорбции от А1 до А2.
В начале процесса при формировании первого адсорбционного слоя дифференциальная теплота адсорбции достигает максимального значения. С ростом А интегральная теплота адсорбции увеличивается, а дифференциальная теплота адсорбции может уменьшаться, увеличиваться или оставаться неизменной в зависимости от природы адсорбата и адсорбента.
Дата добавления: 2018-11-24; просмотров: 1358; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
