Зависимость адсорбции от концентрации адсорбтива
Снижение поверхностного натяжения в результате адсорбции ПАВ можно определить на основании экспериментальных измерений. Так, лимонная кислота, которая используется для пищевых целей, является ПАВ и снижает поверхностное натяжение воды (при 293 К) в зависимости от концентрации следующим образом:
Концентрация лимонной кислоты, % 0 10 20 40
Поверхностное натяжение, мДж/м2 72,8 69,6 68,5 65,5
Зависимость поверхностного натяжения от концентрации ПАВ в растворе характеризует кривая 1 (рис. 5.3). Поверхностное натяжение с увеличением концентрации ПАВ снижается со значения σ0, характерного для воды в отсутствие ПАВ (с = 0), до значения σ при концентрации ПАВ, равной с/.
Снижение поверхностного натяжения Δσ в результате адсорбции ПАВ на границе раздела жидкость — газ можно определить при помощи уравнения Шишковского
Δσ= σ0 — σ = aln(1 + bc), (5.2)
где a, b — эмпирические коэффициенты.
Это уравнение получено в результате обработки экспериментальных данных. Оно является аналитическим выражением изотермы поверхностного натяжения.

 Коэффициент а не изменяется в гомологическом ряду неполярного радикала молекул ПАВ. Коэффициент b определяют экспериментально; его значение зависит от свойств жидкости и ПАВ. Если известны коэффициенты а и b, а также поверхностное натяжение растворителя σ0, то, используя уравнение (5.2), несложно вычислить поверхностное натяжение раствора ПАВ с концентрацией с.
Коэффициент а не изменяется в гомологическом ряду неполярного радикала молекул ПАВ. Коэффициент b определяют экспериментально; его значение зависит от свойств жидкости и ПАВ. Если известны коэффициенты а и b, а также поверхностное натяжение растворителя σ0, то, используя уравнение (5.2), несложно вычислить поверхностное натяжение раствора ПАВ с концентрацией с.
|
|
|
Теория Ленгмюра и уравнение (4.34), определяющее изотерму адсорбции, применимы для адсорбции из растворов, в том числе и для адсорбции ПАВ.
Используя уравнение Ленгмюра и уравнение Гиббса (4.18), можно пояснить значение коэффициентов а и b в уравнении Шишковского (5.2). Для этого, принимая во внимание условие (4.3), приравняем правые части уравнений (4.18) и (4.34):
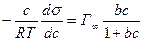 (5.3)
(5.3)
Разделим переменные:
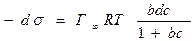 . (5.4)
. (5.4)
Проинтегрируем правые и левые части равенства (5.4) при Т = соnst:
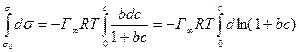 (5.5)
(5.5)
Учитывая, что d(l + bс) = d(bc), после интегрирования уравнения (5.5) получим
σ = σ0 — Г∞RTln(1 + bc). (5.6)
Обозначим через а произведение Г∞RT, тогда
Г∞ = a/RT. (5.7)
Подставив равенство (5.7) в формулу (5.6), получим уравнение Шишковского, которое соответствует формуле (5.2).
Коэффициенты а и b этого уравнения, которые ранее рассматривались как эмпирические, теперь приобретают определенный физический смысл. В соответствии с равенством (5.7) коэффициент а определяет предельную адсорбцию, а коэффициент b, согласно уравнению (4.29), — равновесный характер адсорбции и является константой равновесия.
|
|
|
Кроме уравнения (5.2), снижение поверхностного натяжения в результате адсорбции можно определить при помощи уравнения Фрумкина
Δσ = σ0 — σ = — RTГ∞ln(1 — Г/Г∞). (5.8)
Если уравнение Шишковского (5.2) связывает поверхностное натяжение с концентрацией адсорбтива, а уравнение Ленгмюра (4.34) — адсорбцию с концентрацией, то уравнение Фрумкина определяет изменение поверхностного натяжения в зависимости от адсорбции. Фундаментальное уравнение Гиббса (4.18) связывает все параметры, которые характеризуют адсорбцию (σ, с, Г)
Предельная адсорбция
Величину Г∞, которая согласно условию (4.3) равна А∞, входящую в уравнение Ленгмюра (4.34), называют предельной адсорбцией. Увеличение концентрации ПАВ приводит к росту адсорбции, но после достижения определенной концентрации ПАВ адсорбция перестанет возрастать и будет оставаться постоянной, так как поверхностный слой целиком заполнен. Это есть предельная адсорбция — адсорбция в момент образования монослоя адсорбата, состоящего из молекул ПАВ.
|
|
|
По значению предельной адсорбции Г∞, можно определить параметры адсорбционного слоя: В0 — площадь, занимаемую одной молекулой ПАВ, и δ— толщину адсорбционного слоя (см. рис. 5.2, б).
Если обозначить число молекул насыщенного адсорбционного слоя площадью 1м2 через n∞, то площадь, занимаемая одной молекулой, будет определяться по формуле
B0 = 1/n∞ = 1/(Г∞NA), (5.9)
где NА — число Авогадро.
Зная плотность растворенного вещества ρ и его молекулярную массу М, можно рассчитать толщину предельного адсорбционного слоя, которая будет соответствовать длине молекул (вследствие вертикальной ориентации молекул в мономолекулярном слое). Произведение Г∞М эквивалентно массе адсорбата на 1 м2: моль/м2 ∙ кг/моль = кг/м2 Эту же массу можно выразить через произведение δρ(м∙кг/м3 = кг/м2), т.е.
Г∞М = δρ; δ= Г∞М/ρ. (5.10)
Таким образом, предельная адсорбция позволяет определить размеры молекул ПАВ в насыщенном адсорбционном слое.
Предельная адсорбция определяет площадь, занимаемую гидрофильной частью молекул ПАВ, которая не зависит от длины углеводородного радикала, т.е. гидрофобной части молекулы.
|
|
|
Так, например, гидрофильная часть алифатических спиртов определяется гидроксильной группой ОН, и их предельная адсорбция (выраженная в молях на м2) будет одинакова. В соответствии с уравнением (5.9) площадь в адсорбционном слое одной молекулы всех спиртов будет также одинакова и равна 0,25 нм2, или 0,25 ∙ 10—18 м2. Для всех жирных кислот (например, уксусной, пропионовой, масляной, валериановой, капроновой, гептановой), несмотря на различие углеводородной части, площадь поперечного сечения молекул в адсорбционном насыщенном слое составляет 0,20 нм2, или 0,20 ∙ 10—18 м2.
По значению предельной адсорбции с помощью уравнений (5.9) и (5.10) в 1919 г. коллоидно-химическими методами впервые удалось определить размеры молекул. По мере развития науки размеры молекул стали определять другими методами, результаты которых подтвердили достоверность полученных ранее данных.
Предельную адсорбцию Г∞, которая является важнейшей характеристикой мономолекулярной адсорбции, можно определить графическим путем. Для этой цели уравнение (4.34) представляют в следующем виде:
 ;
;  (5.11)
(5.11)
или
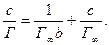 (5.12)
(5.12)
В координатах «1/Г — 1/с» уравнение (5.12) описывается прямой (линия 1 на рис. 5.4). Тангенс угла наклона этой прямой есть величина, обратная предельной адсорбции, т.е. tgα = 1/Г∞b. Отрезок, отсекаемый на оси ординат, характеризует величину 1/Г∞, первое слагаемое правой части уравнения (5.12), т.е. величину, обратную предельной адсорбции, что позволяет найти предельную адсорбцию Г. По тангенсу угла наклона прямой 1 можно определить значение Г∞b, а по ранее известной 1/Г∞ — численное значение константы b. Так, например, рассчитанные по описанному выше методу значения предельной адсорбции для гексилового СН3(СН2)4СН2ОН и гептилового СН3(СН2)5СН2ОН спиртов совпадают и равны 1∙10—5 моль/м2.
Таким образом, по изотерме адсорбции Г = f(с) можно определить не только значение предельной адсорбции, но и константу b уравнения Ленгмюра [уравнение (4.34)].
В соответствии с уравнением (4.29) b характеризует константу равновесия процессов адсорбции и десорбции, когда адсорбция не достигла предельного значения, а снижение поверхностного натяжения определяется поверхностной активностью g [см. формулу (5.1) и рис. 5.1].
Иными словами, константа равновесия адсорбционного процесса связана с поверхностной активностью g.
Рассмотрим рис. 5.5. На рис. 5.5, а изображены изотермы адсорбции, а на рис. 5.5, б показано снижение поверхностного натяжения по мере увеличения концентрации пропилового C3H7OH (кривая 1), бутилового С4Н9ОН (кривая 2) и пентилового С5Н11ОН (кривая 3) спиртов. Поверхностная активность g в соответствии с формулой (5.1) есть производная функции dσ/dc при с → 0 и определяется тангенсом угла наклона кривых 1, 2 и 3. Поверхностная активность различных спиртов неодинакова; из рис. 5.5, б следует, что
—tgα3 > —tgα2 > —tgα1,
→
(dσ/dc)3 > (dσ/dc)2 > (dσ/dc)1; g3 > g2 > g1. (5.13)
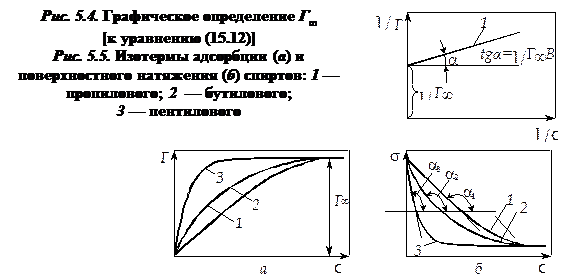 |
Условие (5.13) означает, что с увеличением длины углеводородного радикала, характеризующего гидрофобную часть молекулы ПАВ, поверхностная активность увеличивается. Чем больше величина поверхностной активности, тем круче изотерма адсорбции (сравним кривые 1 и 3 на рис. 5.5, а) и быстрее достигается предельная адсорбция.
Поверхностная активность зависит от длины углеводородного радикала, и согласно эмпирическому правилу Траубе-Дюкло при удлинении углеводородного радикала на одно звено (группу) СН2 поверхностная активность увеличивается примерно в 3—3,5 раза. Это правило соблюдается для водных растворов некоторых ПАВ при небольшой длине углеводородного радикала и комнатной температуре.
Константа b, входящая в уравнение (4.34), увеличивается (как и поверхностная активность) примерно в 3—3,5 раза при удлинении на одну группу СH2 углеводородной части молекул ПАВ данного гомологического ряда. Константа b для гексилового спирта C6H13OH равна 1,1 ∙ 10—3, а для гептилового С7Н15ОН — 3,3 ∙ 10—3, т.е. увеличивается в 3,3 раза при удлинении углеводородной цепи на одну группу СН2; в данном случае соблюдается правило Дюкло-Траубе.
Гидрофобные взаимодействия
Термин «гидрофобные взаимодействия» был предложен Ленгмюром еще в 1916 г. при выводе уравнения изотермы мономолекулярной адсорбции. Они возникают только в водных растворах в результате взаимодействия полярных молекул воды с неполярными гидрофобными частицами, молекулами (углеводородами) или неполярными радикалами молекул, в частности неполярными радикалами молекул ПАВ.
Гидрофобные взаимодействия вызваны особенностями структуры воды. Между молекулами воды образуются водородные связи (показаны пунктиром):
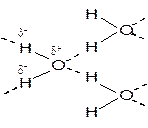 Энергия водородной связи между молекулами воды больше энергии взаимодействия молекул воды с неполярными частицами и радикалами.
Энергия водородной связи между молекулами воды больше энергии взаимодействия молекул воды с неполярными частицами и радикалами.
Кроме того, вода является сильноассоциированной структурированной жидкостью. Наряду с упорядоченной, но рыхлой структурой (плотность структурированной твердой фазы — льда — меньше плотности воды) существует более плотная, лишенная упорядоченности структура. Растворение углеводородов в воде приводит к тому, что структура становится более упорядоченной. Следствием этого является увеличение числа водородных связей в воде.
Значительная энергия взаимодействия между молекулами воды за счет водородных связей и увеличение числа этих связей предопределяет притяжение гидрофобных частиц, т.е. гидрофобное взаимодействие. На рис. 5.6 схематически показано возникновение гидрофобных взаимодействий между двумя гидрофобными неполярными частицами 1 и 2. Эти частицы окружены молекулами воды, которые самопроизвольно ориентируются на границе с неполярной средой, образуя сначала максимально уплотненный мономолекулярный слой 3. Этот монослой является своеобразной «матрицей» для построения за счет водородных
 |
связей следующих слоев 4 и образования структуры в объеме системы. Образовавшаяся вокруг частиц структура способствует сближению частиц. Таким
 |
образом, неполярные частицы прижимаются друг к другу окружающими их молекулами воды.
Гидрофобные взаимодействия выполняют лишь ориентирующую функцию — они обеспечивают наиболее предпочтительный контакт между родственными гидрофобными частицами. Сам же контакт реализуется за счет межмолекулярных (ван-дер-ваальсовых), электростатических, донорно-акцепторных и других сил.
Возникновение гидрофобных взаимодействий получило термодинамическое обоснование. Процесс растворения в воде неполярных гидрофобных веществ, а также ПАВ, приводит к снижению энтропии (ΔS < 0). Оно происходит за счет изменения свойств воды в результате вкрапления в нее неполярных частиц и формирования более упорядоченной по сравнению с чистой водой структуры.
Гидрофобные взаимодействия определяют адсорбцию молекул ПАВ на границе раздела фаз. В результате растворения ПАВ, молекулы которых имеют неполярный гидрофобный радикал, происходит увеличение числа водородных связей в структуре воды и понижение энтропии системы (т.е. водного раствора ПАВ). Реакцией системы на понижение энтропии будет такая перестройка, которая приведет к максимально возможному повышению энтропии. В свою очередь повышение энтропии обусловливает уменьшение числа контактов между неполярными радикалами молекул ПАВ и молекулами воды, что достигается путем самопроизвольного выталкивания молекул ПАВ из объема на поверхность и адсорбции. Подчеркнем, что самопроизвольный процесс адсорбции обусловлен присутствием неполярного гидрофобного радикала в молекулах ПАВ.
Свободная энергия переноса молекул ПАВ из объема раствора на поверхность в расчете на одну СН2 группу примерно равна 3 кДж/моль; относительное постоянство ее значения служит своеобразным подтверждением правила Траубе-Дюкло.
Гидрофобные взаимодействия имеют место и при нахождении молекул ПАВ в адсорбционном слое. На границе раздела фаз неполярные радикалы молекул ПАВ сохраняют контакт с водой. При малых концентрациях молекулы ПАВ располагаются на определенном расстоянии друг от друга и как бы плавают на поверхности. При увеличении концентрации ПАВ и по мере насыщения адсорбционного слоя происходит сближение молекул в поверхностном слое, и между неполярными углеводородными радикалами молекул ПАВ возникают двухмерные гидрофобные взаимодействия. В отличие от трехмерных гидрофобных взаимодействий в объеме системы двухмерные взаимодействия распространяются в двух взаимно перпендикулярных направлениях по отношению к границе раздела фаз.
Двухмерные гидрофобные взаимодействия слабее трехмерных, так как углеводородный радикал лишь частично погружен в воду. Они растут с увеличением размеров углеводородных радикалов молекул ПАВ, поскольку последнее способствует их горизонтальной ориентации в адсорбционном слое, что благоприятствует двухмерным гидрофобным взаимодействиям.
Гидрофобные взаимодействия оказывают влияние на устойчивость дисперсных систем, мицеллообразование коллоидных ПАВ, конформацию белковых молекул, а также на ряд других явлений, которые будут рассмотрены в последующих главах.
Дата добавления: 2018-11-24; просмотров: 639; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
