Классификация кислот по составу.
Часть 1. Классификация неорганических веществ.
Часть 2. Оксиды.
Часть 3. Основания.
Часть 4. Амфотерные гидроксиды.
Часть 1.Классификация неорганических веществ.
К важнейшим классам неорганических веществ по традиции относят:
· простые вещества (металлы и неметаллы),
· оксиды (кислотные, основные и амфотерные),
· гидроксиды (часть кислот, основания, амфотерные гидроксиды),
· соли.
Простые вещества обычно делят на металлы и неметаллы.
Металлы – простые вещества, в которых атомы связаны между собой металлической связью.
Неметаллы – простые вещества, в которых атомы связаны между собой ковалентными (или межмолекулярными) связями.
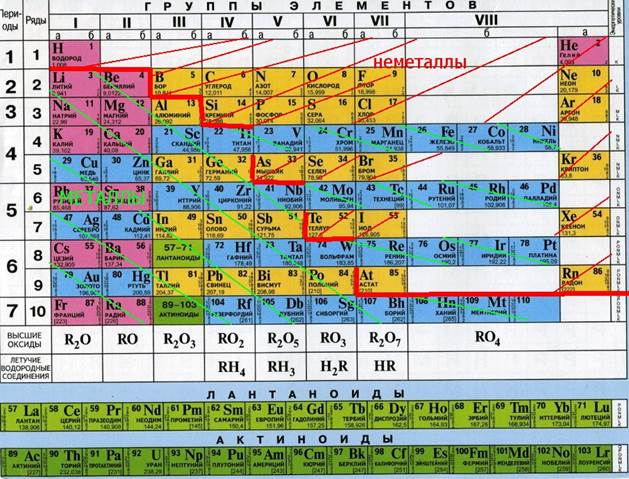
По химическим свойствам среди металлов выделяют группу так называемых амфотерных металлов.
Это название отражает способность этих металлов, их оксидов и гидроксидов реагировать как с кислотами, так и со щелочами.
Оксиды – бинарные соединения, одним из двух элементов в которых является кислород со степенью окисления -2.
| Основные | Амфотерные | Кислотные | Несолеобразующие | Солеобразные ( двойные) | ||
| Оксиды металлов в степенях окисления +1, +2, кроме амфотерных. | Оксиды металлов в степенях окисления +2: только Be , Zn , Sn , Pb ; +3 (все, кроме La2O3), +4 | 1) Оксиды неметаллов, кроме несолеобразующих; 2) Оксиды металлов в степенях окисления от +5 и выше. | Оксиды неметаллов, которым не соответствуют кислоты. NO , N 2 O , CO, (SiO ) | Некоторые оксиды, в которых элемент имеет 2 степени окисления: Fe3O4 | ||
| С о л е о б р а з у ю щ и е
| ||||||
Каждому солеобразующему оксиду соответствует гидроксид:
Основным оксидам соответствуют основания;
Амфотерным оксидам – амфотерные гидроксиды,
Кислотным оксидам – кислородсодержащие кислоты.
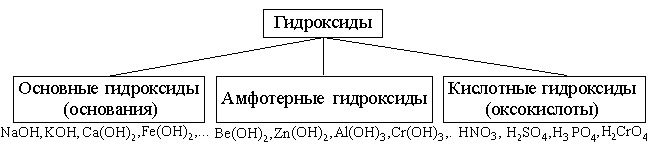
Гидроксиды – соединения, в состав которых входит группа Э–О-Н.И основания, и кислородсодержащие кислоты, и амфотерные гидроксиды – относятся к ГИДРОКСИДАМ!
Связь между оксидом и гидроксидами.
| Степень окисления |
Оксид | Гидроксиды |
Примеры | ||
| Основания | Кислоты | ||||
| +1 | Э2О | ЭОН | НЭО | КОН | НClO |
| +2 | ЭО | Э(ОН) 2 | Н2ЭО2 | Ba(OH) 2 | ? |
| +3 | Э2О3 | Э(ОН) 3 | НЭО2 (мета-форма) --(+H2O) à Н3ЭО3 (орто-форма) | Al(OH) 3 | HNO2 H3PO3 |
| +4 | ЭО2 | ----- | H2ЭО3à H 4ЭO 4 | ----- | Н2СО3 H 4SiO 4 |
| +5 | Э2О5 | ----- | НЭО3 à Н3ЭО4 | ----- | HNO3 H3PO4 |
| +6 | ЭО3 | ----- | H2ЭO4 | ----- | H2SO4 |
| +7 | Э2О7 | ----- | НЭО4 --(+ 2H2O) à H 5ЭО6 | ----- | HClO4 H5IO6 |
КАК СОСТАВИТЬ ФОРМУЛУ КИСЛОТНОГО ГИДРОКСИДА
А. Если чётная степень окисления элемента в оксиде: ПРИБАВЛЯЕМ ВОДУ к оксиду. Пример: WO 3 –(+ H 2 O ) à H 2 WO 4
Б. Если нечетная степень окисления:
|
|
|
| Мета-форма кислоты - ОДИН атом водорода: НЭОх | Орто-форма кислоты – отличается от МЕТА-формы на одну молекулу воды. Н3ЭОх+1 |
Пример: Оксид As 2 O 5, степень окисления мышьяка +5.
Составим формулу кислоты: Н+ As +5 O -2 x
Так как суммарный заряд =0, легко рассчитать, что х=3.
HAsO 3 Это МЕТА-форма кислоты - мета-мышьяковая кислота.
Но для фосфора и мышьяка существует и более устойчива ОРТО-форма. Прибавив к мета-форме Н2О, получим H 3 AsO 4 . Это орто-
мышьяковая кислота.
Основания – сложные вещества, содержащие в своем составе гидроксид-ионы ОН- и при диссоциации образующие в качестве анионов только эти ионы.
Типы оснований
| Растворимые (Щелочи) | Нерастворимые |
| 1) гидроксиды металлов первой группы главной подгруппы: LiOH , NaOH , KOH , RbOH , CsOH 2) гидроксиды металлов второй группы главной подгруппы, начиная с кальция: Ca(OH)2, Sr(OH)2, Ba(OH)2 | Все остальные гидроксиды металлов. |
КИСЛОТНОСТЬ основания – это число групп ОН в его формуле:
однокислотные – содержащие только 1 гидроксогруппу
двухкислотные – имеющие 2 гидроксогруппу;
трёхкислотные – с тремя группами ОН.
Кислоты – сложные вещества, содержащие в своем составе ионы оксония Н+ или при взаимодействии с водой образующие в качестве катионов только эти ионы.
|
|
|
Классификация кислот по составу.
Дата добавления: 2018-11-24; просмотров: 191; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
