Барометрическая формула распределения Больцмана
Вследствие притяжения молекул к Земле, молекулы газа неравномерно распределены по высоте. Их концентрация уменьшается по мере увеличения расстояния (высоте) над земной поверхности.

p-h p+dp-h+dh Расмотрим слой газа толщиной dh Разность давлений на границах слоя будет равна весу газа в объёме этого слоя
p-(p+dp)=ро dhSg pd=-ро gdh (S=1)
pV=mRT/мю ро=m/V=ромю/kT

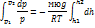

 h1=0 h2=h
h1=0 h2=h
 - барометрическая формула P=nkT
- барометрическая формула P=nkT
 мю=m0Na R=kNa
мю=m0Na R=kNa
 распределение больцмана для концентрации (справедливо для любого потенциального поля)
распределение больцмана для концентрации (справедливо для любого потенциального поля)
Средняя длина свободного пробега молекул
Расстояние λ, которое молекула проходит за время свободного пробега между 2мя столкновениями, называется длиной свободного пробега.
<λ>-средняя длина свободного пробега, т.к для разных молекул она разная.
<λ>=<U>/<Z> За единицу времени молекул в среднем пролетает на расстояние. Равное средней арифметической скорости, при этом испытывая примерно Z столкновений.
При взаимодействии молекул между собой они сближаются до min расстояния d, называемого эффективным диаметром молекул. Dзависит от тем-ры, которая определяет скорость движения молекул. Т.о, за 1 сек рассматриваемая молекула может столкнуться со всеми молекулами, центры которых лежат внутри «ломанного цилиндра» c площадью основания pid^2 и высотой равной средней арифметической скорости <U> <Z>=npid^2<U>
Данный расчет был рпоизведен без учета движения других молекул. Длина свободного пробега зависит от относительной скорости движения молекул. V1, V2 Vотн=V1-V2 Vотн^2=V1^2+V2^2-2V1V2 < Vотн^2>=<V1^2>+<V2^2>-<2V1V2>
|
|
|
События заключающиеся в том что 1 молекула обладает скоростью V1, а 2 скоростью V2 являются статистически независимыми. Поэтому <V1V2> =<V1>V2>и
Поскольку для газа находящемся в состоянии равновесия, средние значения степеней свободы равны 0, то каждая из них равна 0.
<Uотн^2>=2<U^2> Uотнкв=2^(1/2)<Uкв)
Средняя квадратичная скорость пропорциональна средней арифметической скорости <Uотн>=2^1/2<U> <λ>=<U>/<Z>=<U>/npi(d^2)*(2^1/2)<U>
<λ>=1/(2^1/2*pi*d^2*n) p=nkT <λ1>/<λ2>=p2/p1
Т.о ср длина пробега обратно пропорциональна давлению газа при фиксированной температуре.
Внутреняя энергия идеального газа
Внутренняя энергия ид газа может изменяться двояким образом, либо путем сообщения ему некоторого ко-ва теплоты, либо совершением работы. В отличие от внутр эн Q1-2 и A1-2 являются энергетическими характеристиками системы и поэтому зависят от процесса перехода системы из одного состояния в другое. Изменение внутр энергии ∆U1-2=Q1-2+A’1-2 A’1-2-работа совершаемая внешними силами над системой. A’1-2=- A1-2 Q1-2=∆U1-2+A1-2 δQ=dU+δA dQ=dU+dA-для малых величин
|
|
|
Первое начало термодинамики
Первое начало термодинамики представляет собой закон сохранения энергии для тепловых процессов.
dA=pdV>0 при расширении газа
dA!=0, при сжатии газа dU>0 при нагревании газа dU<0 пр охлаждении газа. dQ>0 если получает количество теплоты dQ<0 если отдает количество теплоты
Если ∆U1-2=0, то A1-2=Q1-2
Таким образом из данного соотношения нельзя построить периодически действующий двигатель, который совершал бы большую работу, чем количество теплоты сообщенной системе из вне.
Дата добавления: 2018-10-27; просмотров: 231; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
