Средняя арифметическая скорость
Опытные законы ид. газа.
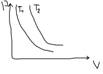
Идеальным наз-ся газ, удовлетворяющий след условиям: 1. Размеры молекул пренебрежимо малы по сравнению с размерами объёма, в котором они находятся. 2. Между молекулами газа отсутствуют силы взаимодействия. 3. Столкновение молекул между собой и со стенками сосуда абсолютно упругое. Модель ид газа описывает реальные газы при низких давлениях и высоких температурах. 1. Закон Бойля Мариотта(изотерм проц) pv=const p1v1=p2v2
Закон Гей люссака(р=const, изобар проц) V/T=const V1/T1=V2/T2
Закон Шарля (V=const изохор проц) p/T=const p1/T1=p2/t2
Закон авагадро: согласно этому закону 1 моль любого газа при одинаковых условиях(давление темп-ра) занимают одинаковый объём V=22.4л=22.4*10^-3 м^3 pн=10^5 Th=273K в 1 моле любого газа содержится одинаковое число молекул Na=6.02*10^23 моль^-1
Закон дальтона: согласно этому закону, давление смеси газов равно сумме парциальных давлений. P=p1+p2+…+pn
Моль-кол-во веществ. Численно равное его молекулярной массе.
Уравнение клайперона менделеева
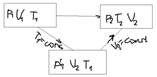
1. P1V1=p1’V2 2. P1’/T1=p2/T2 p1’=p2T1/T2
P1V1/T1=p2V2/T2 уравнение Клайперона
pV/T=B=const B-константа для данного наза. Но разичная для различных газов
Vm pVm/T=B=R R-универсальная газовая постоянная.
Если расматривать произвольное количество газа, массой m, то занимаемый им объем будет равен произведению V=нью*Vm=mVm/мю
pV=mRT/мю R=8.31 Дж/моль*К R=KNa k-постоянная Больцмана k=1.38*10^-23
нью=m/мю=N/Na
P=N/Na*(Na*k*T/V)=nkT
N=N/V-концентрация p=nkT
Правомерность этих законов доказывается экспериментальным путем.
|
|
|
Основное уравнение МКТ Идеальных газов
Данное уравнение связывает параметры состояния газа(pnV) с Кинетической энергией теплового движения молекул газа.
Предположим, что взаимодействие соударения молекул со стенками сосуда значительно превышает числа соударений между собой.
Движение молекул совершенно хаотичное
Соударение молекул со стенками сосуда абсолютно упругое.
Вследствие хаотичности движения молекул средняя скорость их движения вдоль любого направления будет равна нулю.
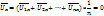
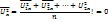
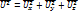
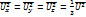 вследствие хаотического движения.
вследствие хаотического движения.
Сигмаt-время столкновения f’сигмt=дельтp F=dp/dt
F’сигмаt-импульс силы
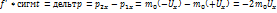
По второму закону Ньютона 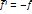
Fсигмt=+2m0 Vx дельтt>>сигмt
Со стенкой способны взаимодействовать только те молекулы, которые расположены на растоянии не превышающей 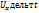
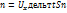
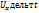
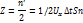
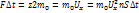
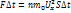
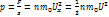 импульс
импульс
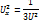
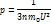
n-концентрация молекул
m0-масса 1 молекулы
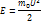
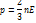
Следствия из основного уравнения МКТ
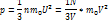
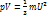 m-масса всего газа
m-масса всего газа
m=мю (нью=1)
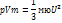
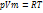
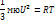
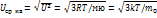
R=kNa мю= Nam0
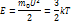
Т.о термодинамическая температура T является мерой средней кинетической энергии поступательного движения молекул газа.
Поскольку 1 атомная молекула обладает 3мя степениями свободы поступательного движения. То на каждую степень свободы приходится одинаковая энергия, равная 3/2kT. Данный 3-к называется 3-ном равномерного распределения энергии по степеням свободы.
|
|
|
Одинаково и для случая вращательного движения.
Распределения Максвелла
По МКТ следует, что как бы не изменялись скорости молекул при их столкновениях средняя квадратичная скорость молекул однородного газа, находящемся в равновесном положении ст, остается равным 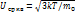
Данное обстоятельство объясняется тем, что в газе, находящемся в термодинамическом равновесии. Устанавливается некоторое стационарное положение по скоростям. Это и есть закон Распределения Максвелла.
Согласно Максвеллу, доля молекул обладающ0их скоростью от U до U+dU и обозначается как 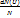 выражается как f(U)dU
выражается как f(U)dU 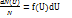 f(U)-функция распределения по скоростям.
f(U)-функция распределения по скоростям.
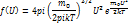
Для функции распределения f(U) справедливо соотношение 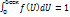
 Uв-наиболее вероятная скорость (ей обладает большинство молекул)
Uв-наиболее вероятная скорость (ей обладает большинство молекул)
F’(U)=0
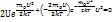
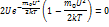
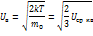
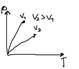
С увеличением температуры Tmax распределение будет смещаться в сторону более высоких скоростей

При этом площадь под кривой остается неизменной. Т.к. площадь определяет общее число молекул газа.
Средняя арифметическая скорость
|
|
|
Для определения средней арифметической скорости необходимо относительную долю молекулы 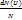 умножить на эту скорость U и просуммировать по всем скоростям. При непрерывном распределении скорости сум- не заменяющихся интегралом.
умножить на эту скорость U и просуммировать по всем скоростям. При непрерывном распределении скорости сум- не заменяющихся интегралом.
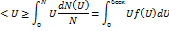
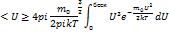
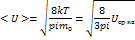
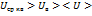
Дата добавления: 2018-10-27; просмотров: 387; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
