Pressure–Temperature Diagrams for
Лекция 5. 6.11.2014. «Гидраты природных газов». 2. Концепция газовых гидратов. Состав, структура и физико-химические свойства газовых гидратов. Фазовые диаграммы газовых гидратов (ПЗ – 10 ч., СР – 10 ч.). Состав, структура и физико-химические свойства газовых гидратов. Молекулярные структуры. Сходство и различие со льдом. Фазовые диаграммы газовых гидратов. Параметры состояния. Гидраты индивидуальных углеводородных и неуглеводородных компонентов. Гидраты бинарных систем. Гидраты смесей углеводородных и неуглеводородных компонентов. Гидраты природных углеводородных газов. На предыдущей лекции мы говорили о кристаллических структурах природных газовых гидратов и льда. Говорили о том, что образование наиболее стабильных структур обусловлено формированием такой конфигурации молекул и связей, которая обеспечивает минимальную энергию. На прошлой лекции мы вплотную подошли к тому, чтобы начать обсуждать фазовые диаграммы систем вода – углеводороды. Фазовые диаграммы систем вода – углеводороды. Прежде чем начать говорить о фазовых диаграммах систем вода – углеводороды гидраты, мы вспомнили о том, что представляют собой фазовые диаграммы вообще. Термодинамические диаграммы – это диаграммы, в которых по осям координат откладываются давление, температура, мольный объём и наносятся кривые фазового равновесия, называются фазовыми диаграммами. Кривой фазового равновесия называется линия на фазовой диаграмме, соответствующая состояниям равновесия сосуществующих фаз. Какие равновесные фазы мы знаем? Основной интерес для нас представляют: газообразная, жидкая и твёрдая фазы. Напомню, что фазой называется часть гетерогенной термодинамической системы, разграниченная от других частей поверхностью раздела и имеющая во всех своих точках одинаковые физические свойства и состав. Напомню, что в курсе «Теории фазовых переходов и критических явлений… мы определили термодинамическую систему как совокупность взаимодействующих друг с другом тел, способных обмениваться с окружением энергией и веществом. Если система состоит из отдельных частей, разграниченных поверхностями и обладающих различными свойствами, то она называется гетерогенной системой. Такую систему можно назвать многофазной. При отсутствии разграничивающих поверхностей между любыми частями системы она называется гомогенной системой. Если же во всех частях системы её свойства одинаковы, то такая гомогенная система называется однородной. Всякое физическое тело (система), поставленное в определённые внешние условия, рано или поздно приходит в состояние термодинамического (статистического) равновесия. Для равновесной системы справедливо правило фаз Гиббса, которое записывается в следующем виде: F = K – Ф + 2, где К – число компонентов в системе, Ф – число фаз. Правило фаз Гиббса предопределяет конфигурацию фазовой диаграммы. F = 0 – нонвариантная система, F = 1 – моновариантная система, F = 0 – бивариантная система, и т.д.
|
|
|
|
|
|
Фазовые диаграммы гидратов индивидуальных углеводородных и неуглеводородных компонентов.
Фазовое поведение смесей углеводород + вода значительно отличается от фазового поведения смесей нормальных углеводородов (об их фазовом поведении мы будем говорить в курсе теории фазовых переходов …). Различия возникают от двух эффектов, каждый из которых проистекает от водородных связей.
Первый, фаза гидрата покрывает значительную часть всех фазовых диаграмм углеводород + вода для углеводородов с молекулярным размером меньшим 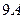 .
.
Второй, молекулы воды и углеводородов настолько различны, что в конденсированном состоянии образуются две жидкие различные фазы, каждый компонент которой очень мало растворим в другой фазе.
Диаграммы давление – температура систем CH4 + H2 O (или N2 + H2 O)
Рассмотрим диаграммы давление – температура для систем CH4 + H2O или N2 + H2O схематически показанные на рисунке при условиях, охватывающих гидратную область.
|
|
|
Так как метан – основной компонент природного газа, эта диаграмма, а также связанная с ней T–x диаграмма обеспечивают понимание всей гидратной области газовых систем, не содержащих жидкую углеводородную фазу.
Согласно правилу фаз Гиббса, двухкомпонентная система метан + вода представляется на диаграмме давление – температура как:
область (для двух фаз), и линией (три фазы) или точкой (четыре фазы вода-лёд-гидрат-газ).
Равновесные кривые фазовых равновесий вода - гидрат – углеводородный компонент (газ, жидкость) строятся по данным, полученным в результате исследования процессов образования и разложения гидратов. Кривые равновесия фаз вода (лёд) – гидрат – углеводороды (газ, жидкость), представленные на рисунке.
На этом рисунке также отображены нижние и верхние квадрупольные точки гидратов соответствующих углеводородных компонентов метана, этана и пропана. У метана, имеющего критическую температуру Tc = 190,55 K, нет верхней квадрупольной точки - Q2.
Нижняя квадрупольная точка отделяет кривую равновесия, на которой при разложении гидрата одной из образующихся фаз является лёд от кривой равновесия, на которой при разложении гидрата одной из образующихся фаз является вода. Нижняя квадрупольная точка находится на пересечении кривых равновесия лёд – гидрат – газ и вода – гидрат – газ, соответствующего углеводородного компонента. Её температура соответствует температуре плавления льда при соответствующем давлении.
|
|
|
Верхняя квадрупольная точка – это точка пересечения кривой равновесия вода – гидрат – газ с кривой сосуществования жидкость – пар соответствующего гидратообразующего углеводорода.
Из представленных на рисунке графиков видно, что при давлении выше давления верхней квадрупольной точки (Q2’, Q2”) этан и пропан находятся в жидком состоянии. В термобарической области выше верхней квадрупольной точки кривая разложения гидрата пропана почти вертикальна, а кривая разложения гидрата этана имеет наклон (dP/dT)eq ~ 7,361 МПа/град. Кривая разложения гидрата метана при температуре выше 0 0С более полога, нежели кривые разложения гидратов пропана и этана. Кривая разложения гидрата этана в области температуры выше верхней квадрупольной точки проходит при более высокой температуре, нежели соответствующая кривая разложения гидрата пропана.
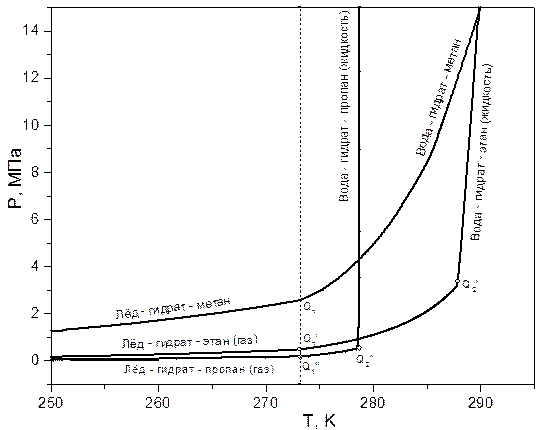
Кривые равновесия фаз системы вода (лёд) – гидрат – индивидуальные углеводороды.
Q1 – нижняя квадрупольная точка, Q2 – верхняя квадрупольная точка.
Проведенные нами экспериментальные исследования показали, что процесс образования гидрата в значительной степени отличается от процесса его разложения. Существует обширная термобарическая область метастабильного (безгидратного) состояния.
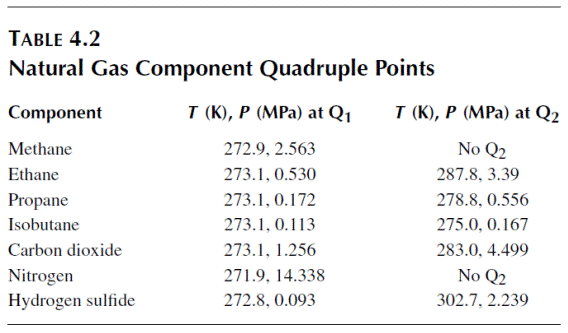
Нижняя квадрупольная точка, также как и верхняя квадрупольная точка индивидуальны для каждого углеводородного компонента газогидратов. Их значения для метана, этана и пропана представлены в таблице.
Значения нижней и верхней квадрупольной точки углеводородов алканового ряда.
| Гидратообразующий УВ компонент | Метан | Этан | Пропан |
| Нижняя квадрупольная точка (Q1) Т(К)/Р(МПа) | 273,14/2,5719 | 273,15/0,4835 | 273,15/0,1715 |
| Верхняя квадрупольная точка (Q2) Т(К)/Р(МПа) | - | 287,89/3,3716 | 278,60/0,5804 |
Рассмотрим квадрупольную точку (Q1), в которой четыре фазы (I–LW–H–V) сосуществуют. Температура квадрупольной точки приблизительно лежит в окрестности 273,16 K для всех гидратов, однако давления для разных компонентов разнятся более значительно (например, 0.0113 МПа для i-C4H10, 2.56 МПа для CH4, и 14.3 МПа для N2).
Квадрупольная точка (Q1) является стартовой точкой для линий равновесного сосуществования четырёх и трёх фаз:
1. Линия LW–H–V в координатах давление – температура представляет наибольший практический интерес для природных газовых систем.
2. Линия I–H–V, имеет меньший P–T наклон, чем линия LW–H–V. Однако имеется очень мало данных в области ниже 273 K.
3. Линия I–LW–H поднимается вертикально от квадрупольной точки, с очень резким ростом давления при малом изменении температуры, что типично для несжимаемых фаз.
4. Линия I–LW–V, которая связывает квадрупольную точку с тройной точкой воды (I–LW–VW) (273.16 K, 0.62 kPa), соответствует переходу между водой и льдом без гидратообразования. Так как Q1 имеет приблизительно 273 K для всех систем природных газов, линия I–LW–V распространяется почти вертикально вниз от Q1 до 0.62 кПа.
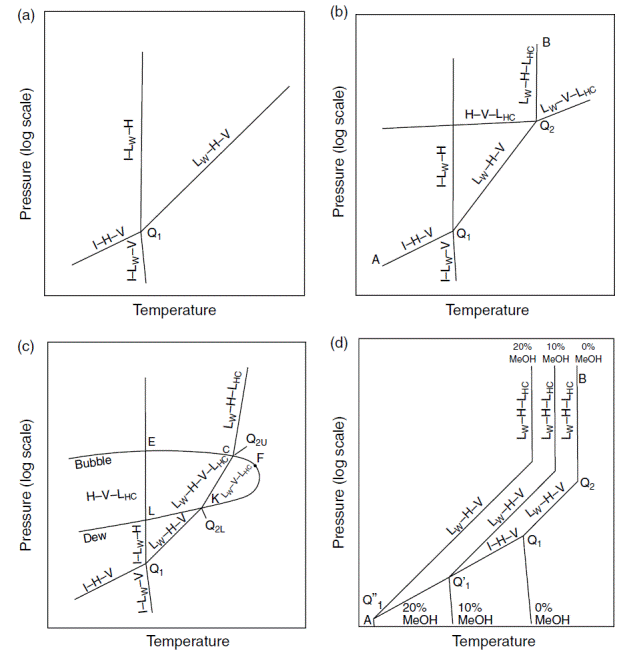
Pressure–temperature diagrams. (a) Methane + water or nitrogen + water system in the hydrate region. (b) Hydrocarbon + water systems with upper quadruple points. (c) Multicomponent natural gas+water systems. (d) Hydrocarbon+water systems with upper quadruple points and inhibitors.
In all of Figure 4.2 note that composition, a third dimension, has been compressed onto the two shown (pressure and temperature), so that the lines shown may project from or into the page.
1. Давление и температура линий LW–H–V and the I–H–V определяют пределы гидратообразования. При более высокой температуре и пониженном давлении относительно этих линий гидраты не могут образовываться и система будет содержать только водную и углеводородную фазы, в то время как гидратообразование может происходить левее линий LW–H–V and I–H–V. Так как лёд, так и гидраты создают проблемы течению
Since ice and hydrates both cause flow problems, a gas pipeline rule of thumb is to keep the system temperature above the ice point and to the right of the LW–H–V and the I–H–V lines, or to displace the LW–H–V line below the pipeline operating conditions by injection of a thermodynamic inhibitor such as methanol.
2. The LW–H–V line has no upper pressure or temperature limit because the pure methane (or nitrogen) vapor–liquid critical points (at 191 and 126 K respectively) are far below the quadruple point Q1. Such low critical temperatures prevent intersection of the vapor pressure line with the LW–H–V line above 273 K to produce an upper quadruple point.
3. Similarly, no upper pressure limit to the I–LW–H line has been found. Note that these phases are all incompressible, so that a very large pressure change results from only a small temperature change, in a closed system.
4. The areas between the three-phase lines represent the two-phase region held in common with the bounding three-phase lines. For instance, the area between LW–H–V and I–H–V is the H–V region in which hydrates are in equilibrium only with vapor (water saturated). Similarly, the LW–H two-phase region exists between LW–H–V and I–LW–H lines, and the I–H two-phase region exists between the I–LW–H and I–H–V lines. In this two-dimensional plot the two-phase regions overlap, indicating that the three-phase lines are not all in the plane of the page, but have been compressed into two dimensions, from three, with the third dimension being composition. The compression of the composition axis onto the P–T plane causes the two-phase regions to overlap. Two-phase regions are discussed with T–x diagrams in Section 4.1.5.
5. The diagram schematic is the same for simple hydrate systems of sI (CH4 + H2O) and sII (N2 + H2O) as well as those of fixed natural gas mixture compositions, without a liquid hydrocarbon phase. Systems containing a liquid hydrocarbon are similar in behavior to the
C3H8 + H2O diagram, discussed in Section 4.1.2.
It has been shown (Bansal et al., 1993) that curvature in the LW–H–V line in
Figure 4.2a results if the guest vapor–liquid critical temperature is slightly below
the LW–H–V conditions.
4.1.2 Systems (e.g., H2O + C2H6, C3H8, or i-C4H10) with Upper Quadruple Points
Figure 4.2b shows the equivalent of Figure 4.2a to be slightly more complex for systems such as ethane+water, propane+water, isobutane+water, or water with the two common noncombustibles, carbon dioxide or hydrogen sulfide. These systems have a three-phase (LW–V–LHC) line at the upper right in the diagram.
This line is very similar to the vapor pressure (V–LHC) line of the pure hydrocarbon,
because the presence of the almost pure water phase adds a very low vapor pressure
(a few mmHg at ambient conditions) to the system.
Figure 4.2b shows that at the intersection of the LW–V–LHC line with the
LW–H–V line, a second quadruple point (Q2 = LW–H–V–LHC) is formed. Measured
upper quadruple points for simple natural gas components are shown in
Table 4.2. Point Q2 is the origin for two additional three-phase lines: (1) a LW–
H–LHC line that is almost vertical due to the three incompressible phases and
(2) a H–V–LHC line, of less concern, because it exists within the LW–H–LHC and
the LW–H–V boundaries.
For systems with two quadruple points, the hydrate region is bounded by line
I–H–V at conditions below Q1, line LW–H–V between Q1 and Q2, as well as line
LW–H–LHC at conditions above Q2. Hydrates can form at lower temperatures and
higher pressures to the left of the region enclosed by the three lines in Figure 4.2b; to
the right, no hydrates are possible. Upper quadruple pointQ2 is often approximated
as the maximum temperature of hydrate formation, because line LW–H–LHC is
almost vertical; however see data in Chapter 6 for exceptions.
In Figure 4.2b, the areas between the three-phase lines represent two-phase
regions held in common with the three-phase lines. The area bound by three
three-phase lines (I–LW–H, LW–H–V, and LW–H–LHC) is the LW–H region in
which hydrates are in equilibrium only with liquid water. Similarly, the H–V
region is between the three three-phase lines (H–V–LHC, LW–H–V, and I–H–V).
Finally, the H–LHC two-phase region exists between LW–H–LHC and H–V–LHC
lines and the I–H two-phase region exists between the I–LW–H and I–H–V lines.
Estimation Techniques for Phase Equilibria 201
See Section 4.1.5 for a T–x diagram with another perspective of these two-phase
regions.
Note that the last paragraph contains two-phase regions(H–V,H–LHC, and I–H)
for hydrate equilibrium with a phase that is not liquid water. There is a common
misconception that hydrates cannot form without a liquid water phase, a condition
clearly possible in these diagrams. Professor Kobayashi’s laboratory measured
hydrate conditions without a free water phase from vapor or liquid systems from
1973 to 2000. Such equilibria are of interest for gas and gas condensate pipelines
without a free water phase.
Pressure–Temperature Diagrams for
Дата добавления: 2018-10-26; просмотров: 280; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
