Посев уколом в столбик агара или желатины.
Пробирку с агаром или желатиной держат дном кверху. Материал, подлежащий посеву, берут платиновой иглой, которую отвесно вкалывают в поверхность агара или желатины и продвигают по оси пробирки до самого дна. Иглу затем извлекают, обжигают и закрывают пробирку пробкой.(Рис. 5.3).

Рис. 5.3. Посев уколом в МПА
5.5. Посев в чашку Петри.
Посев в чашку осуществляют, как правило, для получения изолированных колоний микроорганизмов, что позволяет выделять чистые культуры бактерий. Чистой культурой называется совокупность клеток только одного определенного вида. Методов выделения чистых культур существует в основном три: а) посев на чашку Петри, б) посев на элективную (избирательную) среду, в) выделение культуры из организма животного, чувствительного к тому или иному микроорганизму.
Посев на плотную питательную среду можно производить разными методами: с помощью петли – штрихом, с помощью шпателя – рассевом и др.(Рис. 5.4)


Рис. 5.4. Методы посева на плотную среду в чашку Петри.
При посеве шпателем на поверхность агара наносят петлей одну каплю исследуемой бактериальной суспензии. Затем, приоткрыв чашку, прокаленным и остуженным стеклянным шпателем размазывают каплю по всей поверхности, производя легкие поглаживающие движения во все стороны по поверхности агара.
Если необходимо выделить чистые культуры из суспензии с высокой концентрацией бактерий посев можно сделать в несколько чашек не обжигая шпателя. Шпателем распределяют каплю бактериальной суспензии по поверхности среды, затем этим же шпателем протирают поверхность плотной среды последовательно во 2-й, 3-й и 4-й чашках. Обычно, в первых двух чашках наблюдают сплошной рост микроорганизмов, тогда как в последующих - изолированные колонии.
|
|
|
Для получения относительных количественных характеристик микрофлоры на поверхность среды наносят мерное количество бактериальной суспензии с определенной концентрацией клеток. Подсчитывая затем количество выросших колоний.
Рассевать культуру можно петлей методом истощающего штриха. В этом случае петлей берут каплю суспензиии, касаются ей поверхности плотной среды в углу чашки, давая капле стечь, а затем проводят штрихи в таком порядке, как указано на рисунке 5.4
При высокой концентрации клеток каплю суспензии рассевают сначала в первой чашке, а затем той же петлей, не набирая материала, вновь наносят штрихи на второй и третьей чашке с агаром. В первой чашке может получиться сплошной рост, тогда как во второй и третьей наблюдается рост единичных, изолированных колоний.
Каждая колония представляет обособленное скопление клеток – потомков исходной – клон бактерий одного вида. При последующем пересеве из колоний на скошенный агар или другую питательную среду получают чистую культуру.
|
|
|
После посева чашки помещают в термостат крышками вниз, чтобы конденсационная вода, образовавшаяся на крышке чашки Петри при застывании агара, не помешала получить изолированные колонии. Чашки выдерживают в термостате в течение 1-7 суток в зависимости от скорости роста микроорганизмов.
Посевы на поверхность среды делают при культивировании аэробных бактерий. Изолированные колонии анаэробных микроорганизмов получают методом глубинного посева. Для этого плотную питательную среду предварительно разливают в пробирки по 15-20 мл и стерилизуют. Непосредственно перед посевом пробирки помещают в кипящую водяную баню, чтобы из среды удалить кислород. Посев проводят следующим образом. В пробирку с расплавленной и остуженной до 48-50° агаризованной средой вносят 0,5-1,0 мл. исследуемой суспензии. Посевной материал тщательно перемешивают, вращая пробирку между ладонями. Затем возле пламени горелки вынимают из пробирки пробку, обжигая края пробирки в пламени горелки, и быстро выливают содержимое пробирки в чашку Петри. После того, как среда застынет, чашки Петри помещают в термостат. Колонии выросшие в толще среды, вырезают стерильным скальпелем, петлёй или извлекают стерильными капиллярными трубками, и переносят в жидкую среду, благоприятную для развития выделяемых микроорганизмов.
|
|
|
Исследования природных субстратов предполагает определение как видового разнообразия бактерий, так и количества их клеток, содержащихся в том или ином объеме субстрата. Число клеток в единице объема можно посчитать различными методами. Иногда, для определения абсолютного числа, проводят прямой счет клеток в исследуемой среде. Однако это отнимает много времени и сил. Часто достаточно относительной количественной оценки. Одним из методов такой оценки является метод высева на плотные среды.
5.6. Определение количества клеток методом высева на плотные среды (чашечный метод). Сущность метода заключается в высеве определенного объема исследуемой суспензии микроорганизмов на плотную среду в чашки Петри и последующем подсчете выросших колоний. При этом исходят из того, что каждая колония является результатом размножения одной клетки. Чашечный метод особенно широко используется для определения количества микроорганизмов в почве и других естественных субстратах. Однако следует учитывать, что для микроорганизмов, образующих цепочки или другие скопления клеток, результаты по определению их числа будут всегда несколько занижены. Поэтому в микробиологической практике часто используют понятие колониеобразующей единицы (КОЕ). Колониеобразующая единица это одна или несколько клеток, давших начало колонии.
|
|
|
Работа этим методом включает три этапа:
- приготовление разведений,
- посев на плотную среду в чашки Петри,
- подсчет выросших колоний.
Приготовление разведений. Чтобы получить изолированные колонии, культуру или материал, содержащий микроорганизмы, как правило, разводят – уменьшая концентрацию клеток в единице объёма. Обычно разведения проводят в стерильной водопроводной воде, пользуясь некоторым постоянным коэффициентом разведения, чаще всего равным 10. Таким образом, получают серию разведений, в которых концентрации клеток образуют геометрическую прогрессию. В ходе одного опыта целесообразно использовать один и тот же коэффициент разведения, так как в этом случае при большом числе подсчетов уменьшается вероятность ошибки. Для приготовления разведений стерильную водопроводную воду разливают по 9 мл. в стерильные сухие пробирки. Затем 1 мл. исходной суспензии, взятый стерильной пипеткой, переносят в пробирку с 9 мл. стерильной воды—это 1-е разведение, 1: 10. Полученную в 1-м разведении суспензию с помощью новой стерильной пипетки тщательно перемешивают, вбирая в пипетку и выпуская из нее полученную взвесь. Эту процедуру выполняют 3–5 раз, что обеспечивает перемешивание суспензии и уменьшает адсорбцию клеток на стенках пипетки. Затем этой же пипеткой берут 1 мл. полученного разведения и переносят его во 2-ю пробирку—это 2-е разведение, 1: 100. Таким же образом готовят и последующие разведения. (Рис. 5.5) Если используется другой коэффициент разведения, например, 3, тогда 1-е разведение будет 1: 3, 2-е— 1: 9, 3-е—1: 27 и т. д. Степень разведения определяется концентрацией исходной суспензии микроорганизмов и соответственно число разведении тем больше, чем больше концентрация исходной суспензии. Для приготовления каждого разведения следует обязательно использовать отдельную пипетку. Пренебрежение этой предосторожностью может привести к получению ошибочного результата, иногда в 100 и более раз превышающего истинный. Ошибка связана с адсорбцией микроорганизмов на стенках пипетки, в результате чего не все клетки удаляются из пипетки при каждом разведении. Часть клеток, оставшаяся на стенках пипетки, может затем попасть в одно из последующих разведении, что и явится причиной получения завышенного результата.
Посев в чашки. Высевать суспензию можно поверхностным или глубинным способом (см. выше). Перед посевом суспензии поверхностным способом (рис.) в стерильные чашки Петри разливают расплавленную плотную, чаще всего агаризованную, питательную среду. Среду обычно разливают из большой колбы последовательно в ряд чашек Петри по 15—20 мл в каждую, и чашки оставляют на горизонтальной поверхности, пока агаризованная среда не застынет. Поверхность агаровых сред рекомендуется подсушивать, чтобы образующиеся колонии не расплывались по поверхности агара. Для этого чашки с застывшей средой помещают открытыми в сушильный шкаф, нагретый до 70—80°С. Шкаф предварительно необходимо простерилизовать. Среду подсушивают до появления на ее поверхности муаровой пленки. При этом с крышек чашки Петри удаляется конденсационная вода. В некоторых случаях агаризованную среду подсушивают, помещая чашки в термостат на 2—3 суток крышками вниз. Когда среда готова, на ее поверхность стерильно пипеткой наносят строго определенный объем (0, 05—0, 2 мл) соответствующего разведения.

Рис. 5.5. Схема приготовления последовательных разведений бактериальной суспензии.
Этот объем распределяют стерильным стеклянным шпателем по поверхности агаризованной среды в чашке Петри. Высевы на плотную среду производят обычно из трех последних разведении. Из каждого разведения делают 2—4 параллельных высева. Посевы из разведении можно делать одной пипеткой, но начинать следует обязательно с большего разведения. Для каждого разведения используют новый стерильный шпатель.
Выросшие колонии подсчитывают, определяя концентрацию клеток в определенном объеме того или иного разведения. Трудно не заметить возможность использования этого метода и для выделения чистых культур микроорганизмов. Изолированные колонии – прекрасная возможность отсеять небольшое количество клеток на скошенный стерильный МПА.
В качестве исследуемого по такой схеме субстрата может быть не только вода или почва, но и воздух. Для этого на стерильный бумажный фильтр (предварительно взвешенный) осаждают клетки, прокачивая определенное количество воздуха. Затем фильтр помещают в стерильную воду или физиологический раствор, где клетки смывают готовя суспензию. Приготовленную суспензию исследуют, как было описано выше.
Метод секторных посевов
Для определения числа микробных клеток в 1 мл бактериальной суспензии (в частности мочи при клинических анализах) можно использовать метод секторных посевов. Платиновой петлей, диаметром 2 мм, емкостью 0,005 мл, производят посев суспензии (30-40 штрихов) на сектор А чашки Петри с питательным агаром. После этого петлю прожигают и производят 4 штриховых посева:
- из сектора А в сектор 1
- из сектора 1 в сектор 2
- и аналогичным образом - из сектора 2 в 3.
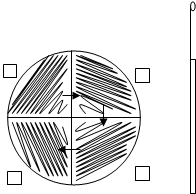 |
Рис. 5.1 Схема секторных посевов
Чашки инкубируют при 37°С 18-24 часа, после чего подсчитывают число колоний, выросших в разных секторах. Определение степени микробной загрязнённости исследуемой суспензии по количеству выросших колоний производят согласно таблице 1.
Таблица 1
| Количество колоний в секторах | Количество бактерий в 1 мл. суспензии | |||
| А | 1 | 2 | 3 | |
| 0 | 0 | 0 | Менее 103 | |
| 1-6 | 0 | 0 | 0 | 3*103 |
| 8-20 | 0 | 0 | 0 | 5*103 |
| 20-30 | 0 | 0 | 0 | 104 |
| 30-60 | 0 | 0 | 0 | 5 *104 |
| 70-80 | 5-10 | 0 | 0 | 105 |
| 100-150 | 20-30 | 0 | 0 | 5 *105 |
| Более 200 | 40-60 | 0 | 0 | 106 |
| -“- | 100-140 | 10-20 | 0 | 5 *106 |
| -“- | Более 200 | 30-40 | 0 | 107 |
| -“- | -“- | 60-80 | Единичные колонии | 108 |
| -“- | ||||
Метод секторных посевов позволяет не только определить степень загрязнённости суспензии, но и выделить чистые культуры микроорганизмов.
Важно отметить, что схема исследования суспензий в принципе одинакова для самых разных случаев, в том числе при изучении микрофлоры воздуха или смывов с любой поверхности.
5. 4 Метод "тампон-петля":
Смывы с поверхности можно исследовать методом “тампон – петля”. Материал, взятый ватным стерильным тампоном, засевают на плотную питательную среду (МПА). Посев на чашку с агаром производят методом “тампон – петля”.(См. рис. 5.2)
- тампоном проводится "дорожка" по диаметру чашки,
- затем другой стороной тампона в обратном направлении засевается еще одна "дорожка", параллельная первой,
- материал рассевают по чашке при помощи петли штрихами, перпендикулярными к "дорожкам".
Такой посев позволяет выделить микроорганизмы в виде отдельных колониеобразующих единиц даже из ассоциации микроорганизмов. Засеянные питательные среды термостатируют при 37°С в течение 18-24 часов. При обнаружении роста производят отсев отдельных колоний на стерильные среды с целью их идентификации. При отсутствии роста в первые сутки посевы оставляют в термостате, ежедневно просматривают. Ответ об отсутствии роста выдают через 5 суток термостатирования.
 |
Рис.5.2 Схема посева “тампон-петля”
Схема посева при выполнении этого метода может быть и несколько иной. Тампоном делают не полоски а пятна – отпечатки, которые затем расштриховывают петлёй.
5.6 Транспортировка инфекционного материала
Доставка инфекционного материала в лабораторию осуществляется в специальном металлическом футляре, биксе и т.п. Не допускается перевозка инфекционного материала в хозяйственных сумках, чемоданах, портфелях и других предметах личного пользования. Распаковка материала, присланного в лабораторию для исследования, проводится с соблюдением мер предосторожности: банки и пробирки, содержащие материал, обтирают дезинфицирующим раствором и ставят на металлические подносы или штативы.
Перенос инфекционного материала из одной лаборатории в другую на территории учреждения осуществляется в специально приспособленной опломбированной металлической посуде (металлических баках, биксах). За пределы данного учреждения инфекционный материал выносится в запаянных ампулах, флаконах и пр., завернутых в лигнин или гигроскопическую вату и помещенных в металлический сосуд (пенал) с плотно закрывающейся крышкой, опломбированной или опечатанной сургучной печатью. Документация оформляется в соответствии с действующим Положением (см. пункт 1.5а).
Список литературы
Правила устройства, техники безопасности, производственной санитарии, противоэпидемического режима и личной гигиены при работе в лабораториях (отделениях, отделах) санитарно-эпидемиологических учреждений системы министерства здравоохранения СССР УТВЕРЖДЕНЫ Президиумом ЦК профсоюза медицинских работников 2 октября 1981 г., протокол N 58 МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР
УТВЕРЖДАЮ
Заместитель Министра здравоохранения СССР, Главный государственный санитарный врач СССР П.Н.БУРГАСОВ 20 октября 1981 г. N 2455-81
1. Блохина И.Н., Ладыгина Г.Н., Соколова К.Я., Залесских Н.В., Коровенков А.Н. Методы идентификации бактерий. Учебное пособие. Горький. Изд.ГГУ, 1986. 76 с.
2. Борисов Л. Б., Козьмин-Соколов Б.Н., Фрейдлин И.С. Руководство к лабораторным занятиям по медицинской микробиологии, вирусологии и иммунологии. Уч. пособие. М. Медицина. 1993. 240 с.
3. Звягинцев Д.Г. Почва и микроорганизмы. М. Изд. МГУ, 1987. 256 с.
4. Мейнелл Дж., Мейнелл Э. Экспериментальная микробиология. (Теория и практика). М. Мир. 1967. 348 с.
5. Пименова М.И., Гречушкина Н.Н., Азова Л.Г. Руководство к практическим занятиям по микробиологии (малый практикум). М. Изд. МГУ, 1971. 222 с.
6. Практикум по микробиологии.// учебное пособие. Под редакц. Н.С.Егорова. М. Изд-во моск. ун-та. 1976. 307 с.
7. Стейниер Р., Эдельберг Э., Ингрем ДЖ.. Мир микробов. в 3 т. М.Мир.1979. т.3. 486 с.)
8. Справочник по микробиологическим и вирусологическим методам исследования. Под ред. М.О. Биргера. М. Медицина. 1982. 464 с.
9. Утевский Н.Л. Элементы медицинской микробиологии и медицинской техники. М.Медгиз.1952. 303 с.
10. Никитин Д.П., Новиков Ю.В., Рощин А.В.Справочник помошника санитарного врача и помошника эпидемиолога. М. Медицина. 1990. С. 512. Изд-е второе. Под редакц. Д.П. Никитина, А.И. Заиченко
11. Определитель бактерий Берджи. В 2-х томах. Перев. С англ./ Под редакц. Дж. Хоулта, Н. Крига, П. Снита, Дж. Стейли, С. Уильямса. М. Мир. 1997. Т. 1. С. 432., т. 2. С. 368.
Дата добавления: 2018-09-23; просмотров: 2808; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
