Цистаденомы поджелудочной железы
Одним из наименее изученных разделов хирургической панкреатологии являются кистозные опухоли. Согласно последней Международной классификации ВОЗ (1983) все они отнесены к эпителиальным опухолям и представлены простыми и папиллярными цистаденомами (ЦА). Различают микрокистозные ЦА, отличающиеся доброкачественным течением, и слизистые (муцинозные) макрокистозные ЦА – потенциально злокачественные. ЦА представляют собой кистозные многокамерные опухоли с кистами от 1–2 до 5–6 см в диаметре. Содержимое кист прозрачное, бесцветное, имеет серозный или слизистый характер. В случае нагноения содержимого – секрет гноевидный. ЦА локализуются чаще в хвосте ПЖ в виде четко ограниченного образования, достигающего 15–20 см в диаметре. ЦА следует отличать от врожденного поликистоза железы, для которого характерно наличие кистозных образований по всему длиннику органа с резкой атрофией паренхимы. Эпителиальная выстилка ЦА представлена цилиндрическим или уплощенным эпителием, расположенным в один ряд, в редких случаях с пролиферацией клеток и образованием папиллярных разрастаний. Строма ЦА фиброзная. Внутри капсулы можно обнаружить скопления отдельных групп ацинусов и островки Лангерганса. Возможно озлокачествление ЦА, при этом просвет кист выполнен разрастаниями опухолевой ткани в виде цветной капусты мягкой консистенции, серовато‑розового цвета. Опухолевая ткань часто подвергается некрозу. Отличить ЦА от цистаде‑нокарциномы можно только после гистологического исследования удаленной опухоли.
|
|
|
К настоящему времени в литературе описано немногим более 600 случаев панкреатических ЦА. Частота кистозной формы РПЖ составляет 1 % от числа всех первичных карцином этого органа.
Необходима своевременная диагностика и оперативное лечение ЦА ПЖ. У 10 % больных опухоль протекает бессимптомно, 70 % больных беспокоят чувство тяжести, дискомфорт в эпигастрии. Диспептические симптомы выявляются редко. Жалобы на снижение аппетита, трудоспособности, похудание отмечаются лишь у 15 % больных. Даже при локализации кистозных опухолей в головке ПЖ механическая желтуха не возникает, но иногда может наблюдаться портальная гипертензия. Почти у 90 % пациентов в верхних отделах живота пальпируется слабо болезненное и малоподвижное объемное образование округлой формы, плотной консистенции. Общеклинические и биохимические лабораторные показатели малоинформативны. У 20 % больных при обзорной рентгенографии брюшной полости в проекции ЦА обнаруживают кальцификаты. Основными методами инструментальной диагностики ЦА являются УЗИ и КТ.
|
|
|
Адекватное лечение ЦА заключается в полном удалении опухоли: левосторонней резекции ПЖ с опухолью (при локализации ЦА в хвосте и теле ПЖ), энуклеация ЦА, если это технически возможно, значительно реже – ПДР резекция (при локализации ЦА в головке ПЖ).
Паллиативные операции (цистодигестивные анастомозы) направлены на снижение компрессии окружающих опухоль тканей, возможны лишь у пациентов высокой степени операционного риска.
Нейроэндокринные опухоли поджелудочной железы
Нейроэндокринные опухоли поджелудочной железы (НЭО ПЖ) (апудомы) – опухоли из клеток АПУД‑системы (аббревиатура APUD – Amine Precursor Uptake and Decarboxylation – означает захват и декарбоксилирование предшественников аминов). Соответствующие нейроэндокринные клетки локализуются в органах желудочно‑кишечного тракта, бронхах, надпочечниках и некоторых других эндокринных органах. Они способны продуцировать биологически активные амины и пептиды, в том числе относящиеся к классу гормонов. Эти клетки могут быть источником развития нейроэндокринных опухолей, характеризующихся возникновением ряда эндокринных синдромов. В большинстве случаев сама опухоль очень мала и не может нарушать функцию органа. В то же время гормональная активность опухоли приводит к развитию клинических проявлений, порой очень тяжелых, которые в большей своей части специфичны для каждого вида опухоли. Подавляющее большинство нейроэндокринных опухолей локализуется в ПЖ. Они берут начало из клеток со специфической функцией и поэтому носят название, соответствующее единственному или преобладающему в их секрете веществу, например, глюкагонома, инсулинома, гастринома. Опухоли, берущие начало от EC‑клеток с неизвестной физиологической функцией, названы карциноидами. Они являются наиболее распространенным видом нейроэндокринных опухолей.
|
|
|
В настоящее время функционирующие опухоли ПЖ принято делить на две группы: ортоэндокринные, секретирующие гормоны, свойственные физиологической функции островков, и параэндокринные, выделяющие гормоны, не свойственные им. К первой группе относятся новообразования альфа‑, бета‑, дельта– и F‑клеток, которые секретируют соответственно глюкагон, инсулин, соматостатин и панкреатический пептид, что отражено в их названиях (глюкагонома, инсулинома, соматостатинома, ПП‑ома). Цитогенез параэндокринных опухолей в настоящее время окончательно не установлен, известно лишь, что они не бета‑клеточного типа. К ним относятся новообразования, выделяющие гастрин – гастринома , вазоактивный интестинальный пептид (ВИП) – випома , АКТГ – кортикотропинома , а также опухоли, способные давать клинику карциноидного синдрома. К параэндокринным относятся также некоторые редкие опухоли, секретирующие другие пептиды и простагландины.
|
|
|
Как правило, новообразованиям островков Лангерганса, особенно злокачественным, свойственна полигормональная секреция. «Чистые» опухоли являются редкостью. Тем не менее превалирование секреции того или иного гормона приводит к развитию определенного клинического эндокринного синдрома.
Распространенность островковоклеточных опухолей изучена недостаточно. Одна аденома выявляется на каждые 1000–1500 патологоанатомических вскрытий. Около 60 % всех эндокринных опухолей ПЖ – инсулиносекретирующие.
Кроме того, существует современная классификация нейроэндокринных опухолей ПЖ, в соответствии с которой выделяют опухоли в зависимости от степени злокачественности.
Классификация нейроэндокринных опухолей ПЖ в зависимости от степени злокачественности
1. Доброкачественные
а) Высокодифференцированная аденома
б) Инсулинома
в) Нефункционирующая аденома
2. Пограничные (с неопределенным потенциалом злокачественности)
а) Высокодифференцированные опухоли без инвазии сосудов
б) Инсулинома
в) Гастринома, випома, глюкагонома, соматостатинома и пр.
3. Нефункционирующие опухоли
4. Опухоли с низкой степенью злокачественности
а) Высоко– и умеренно дифференцированная карцинома
б) Инсулинома
в) Гастринома, випома, глюкагонома, соматостатинома и пр.
г) Нефункционирующая карцинома
5. Опухоли с высокой степенью злокачественности
а) Низкодифференцированная карцинома (функционирующая и нефункционирующая)
Ортоэндокринные опухоли
Инсулинома – опухоль из бета‑клеток островков Лангерганса, секретирующая избыточное количество инсулина, что проявляется гипогликемическим симптомокомплексом: слабость, тремор, тахикардия, потливость, беспокойство и чувство голода, головная боль, двоение в глазах, обмороки, нервно‑психические нарушения.
Вследствие диагностических ошибок, больные с инсулиномой длительно и безуспешно лечатся с самыми разнообразными диагнозами (эпилепсия, опухоль головного мозга, вегетососудистая дистония и т. д.). Нарушение высшей нервной деятельности в межприступном периоде выражается в снижении памяти и умственной работоспособности, потере профессиональных навыков, что нередко вынуждает больных переходить к менее квалифицированному труду.
Чаще всего приступ гипогликемии развивается в ранние утренние часы, что связано с продолжительным (ночным) перерывом в приеме пищи. Обычно они не могут «проснуться», переходя в состояние расстройства сознания различной глубины. Длительное время больные остаются дезориентированными, производят ненужные повторяющиеся движения, односложно отвечают на простейшие вопросы. Нередко наблюдаемые эпилептиформные припадки отличаются от истинных большей продолжительностью, хореоформными судорожными подергиваниями, гиперкинезами, обильной нейровегетативной симптоматикой.
Больные сами обнаруживают быстрый и выраженный эффект от приема пищи, которая предупреждает или купирует едва начавшийся приступ. Это заставляет их носить с собой мучное и сладкое в качестве «лекарства», поскольку особого аппетита они не ощущают. Часто отмечается избыточная масса тела.
Большое место среди функционально‑диагностических методов при этом виде опухолей принадлежит различным тестам. Не потеряла своего значения классическая триада Уиппла, которую в клинических условиях удается констатировать при проведении пробы с голоданием во время которой: 1) развивается клиническая картина гипогликемии, 2) сахар крови падает ниже 2,7 ммоль/л, 3) сам приступ купируется внутривенным введением глюкозы.
Проба с толбутамидом (растиноном) состоит в том, что при внутривенном введении препарата у больных с функционирующими бета‑клеточными новообразованиями уровень гликемии снижается через 20–30 мин более чем на 50 %, тогда как у больных с гипогликемиями другого генеза – менее чем на 50 %.
Среди лабораторных показателей при подозрении на инсулиному существенное значение имеет исследование иммунореактивного инсулина (ПРИ), проинсулина и С‑пептида.
Подавляющее число инсулином не превышает в размерах 0,5–2 см в диаметре, вследствие чего у 20 % больных их не удается обнаружить даже при повторных вмешательствах. Злокачественные инсулиномы составляют 10–15 % общего их числа, причем треть из них метастазирует. У 4‑14 % больных инсулиномы множественны, причем около 2 % новообразований располагаются вне ПЖ (дистопия). Невозможность предварительного суждения об объеме операции заставляет хирурга быть готовым к объему вмешательства от энуклеации до панкреатэктомии. В целях топической диагностики инсулином в настоящее время используют три метода: ангиографический, катетеризацию портальной системы и метод компьютерной томографии.
Современная топическая диагностика позволяет у 80–95 % больных с инсулиномами до операции установить локализацию, размер, распространенность и характер опухолевого процесса, выявить метастазы. При интраоперационном определении локализации образования используется эхография.
Глюкагонома – опухоль из альфа‑клеток островков Лангерганса, секретирующих глюкагон. Глюкагономы обычно достигают значительных размеров. Только в 14 % случаев они не превышают 3 см в диаметре, тогда как более чем у 30 % больных размер первичного очага составляет 10 см и более. В подавляющем большинстве случаев (86 %) альфа‑клеточные образования злокачественны, причем 2/3 из них на момент установления диагноза уже имеют метастазы. Почти у половины больных опухоль обнаруживается в хвосте ПЖ, реже (20 %) – в ее головке. При глюкагономах развивается сложный симптомокомплекс, наиболее часто включающий дерматит, диабет, анемию и похудание. Реже отмечаются диарея, поражение слизистых оболочек, тромбозы и эмболии. В клинической картине глюкагономы доминируют кожные проявления, поэтому подавляющее большинство больных выявляются дерматологами. Причиной дерматита, резистентного к проводимой терапии, является выраженный катаболический процесс, обусловленный опухолевой гиперглюкагонемией, которая приводит к нарушению обмена белков и аминокислот в тканевых структурах.
Диабет при глюкагономе у 75 % больных протекает в легкой форме, и лишь четверть больных нуждаются в инсулинотерапии.
Выраженные катаболические изменения при глюкагономе, независимо от характера опухолевого процесса (злокачественный или доброкачественный), являются причиной похудания, отличительная особенность которого – потеря массы тела при отсутствии анорексии. Анемия при данном синдроме резистентна к витаминотерапии и препаратам железа.
Среди лабораторных показателей особое место занимает исследование иммунореактивного глюкагона (превышает нормальные показатели в десятки и сотни раз). Характерна гиперхолестеринемия, гипоальбуминемия, гипоаминоацидемия.
Из‑за, как правило, значительных размеров опухоли топическая диагностика глюкагономы особых затруднений обычно не вызывает. Наиболее эффективными методами считаются УЗИ, КТ и висцеральная артериография.
Лечение больных глюкагономой – хирургическое и химиотерапевтическое. Четверть всех оперативных вмешательств заканчивается пробной лапаротомией из‑за генерализации процесса. Попытка паллиативного удаления первичного очага должна быть предпринята при любых обстоятельствах, поскольку уменьшение опухолевой массы создает более благоприятные условия для проведения химиотерапии. Препаратами выбора при глюкагономе являются стрептозотоцин и дакарбазин, позволяющие годами поддерживать ремиссию злокачественного процесса. Имеются сообщения об эффективности сандостатина (октреотида) (аналоги соматостатина).
Соматостатинома (дельта‑клеточная опухоль островков Лангерганса) – встречается крайне редко (в литературе описано немногим более 30 больных). При ней часто отмечается холелитиаз, сахарный диабет, диарея или стеаторея, гипохлоргидрия, анемия, похудание.
По‑видимому, многие проявления опухоли являются результатом блокирующего действия соматостатина на ферментативную функцию ПЖ и секрецию других гормонов островками Лангерганса, вследствие чего этот симптомокомплекс иногда называют «ингибирующий синдром».
Большинство описанных соматостатином по характеру секреции оказались полигормональными. Вероятно, что это одна из причин гетерогенности клинических проявлений заболевания. Лечение соматостатином оперативное – удаление опухоли или резекция ПЖ вместе с опухолью.
Параэндокринные опухоли
Гастринома – не‑β‑клеточная опухоль ПЖ (по некоторым данным, это опухоль из G‑клеток ПЖ, гастрин секретируется и G‑клетками желудка). В основе проявления заболевания лежит гипергастринемия, которая вызывает постоянную стимуляцию функции обкладочных клеток желудка, выделяющих соляную кислоту. Желудочная гиперсекреция с очень высокой концентрацией соляной кислоты обусловливает большинство проявлений синдрома (по имени описавших его авторов – синдром Цоллингера‑Эллисона) и в первую очередь – изъязвления слизистой оболочки желудка и ДПК. Наиболее часто язвы локализуются в постбульбарном отделе ДПК, хотя имеются наблюдения изъязвлений от пищевода до подвздошной кишки. Почти у четверти больных язвы множественные. С гуморальным характером желудочной гиперсекреции связана и склонность язв к рецидивированию даже после ваготомии и неоднократных резекций желудка. Другой особенностью заболевания является высокая частота осложнений язв (кровотечения, перфорации, стенозы). Практически у всех больных имеется выраженный болевой синдром. Изменение pH в верхних отделах тонкой кишки из‑за массивного поступления кислого содержимого желудка приводит к развитию диареи, а инактивация панкреатических и кишечных ферментов – к стеаторее.
Исследование желудочного сока в значительной степени определяет диагноз гастриномы. Для больных ульцерогенным синдромом характерна 12‑часовая ночная секреция соляной кислоты – более 100 мэкв и часовая базальная – более 15 мэкв (N 1,5–5,5 мэкв).
Особое диагностическое значение имеет показатель секреции иммунореактивного гастрина. Если его уровень составляет более 300 нг/мл, то вероятность гастриномы велика.
Лечение синдрома Цоллингера‑Эллисона – хирургическое. Даже в случае диагностирования и возможности удаления гастриномы операцией выбора считается гастрэктомия, цель которой – устранение органа‑эффектора, поскольку никогда нет уверенности в одиночности первичной опухоли или отсутствии метастазов. Медикаментозное лечение гастриномы малоэффективно. Применение антацидов и антихолинергических средств ведет лишь к временному ослаблению симптоматики.
ВИПома. В 1958 г. Вернер и Моррисон описали синдром водной диареи у больного с не‑(3‑клеточная опухолью ПЖ. Прежде это заболевание считалось вариантом синдрома Цоллингера‑Эллисона, его атипичной безъязвенной формой с гипокалиемией. Дальнейшие исследования показали, что причиной клинических проявлений в этих случаях является секреция не гастрина, а вазоактивного интестинального пептида (ВПП), отчего и произошло название опухоли – ВИПома. Иногда заболевание называют панкреатической холерой. Более 70 % ВИПом злокачественны, причем у 2/3 из больных на момент установления диагноза имеются печеночные метастазы. У 20 % больных симптомокомплекс может быть результатом не опухоли, а лишь гиперплазии островкового аппарата.
Хирургическое лечение эффективно только при радикальном удалении всей функционирующей опухолевой ткани, что удается далеко не всегда. При невозможности установить локализацию опухоли при явных клинико‑лабораторных проявлениях заболевания рекомендуется резекция дистальной части ПЖ, где наиболее часто локализуется ВИПома.
Кортикотропинома. Эктопическая секреция АКТГ‑подобного гормона может наблюдаться во многих органах и тканях, в том числе и в ПЖ. Клинический симптомокомплекс при этом выражается глюкокортикоидным гиперкортицизмом. Эктопический синдром Кушинга имеет ряд особенностей, главные из которых гиперпигментация и гипокалиемия, сопровождающиеся отеками и алкалозом.
Эктопическая кортикотропинома ПЖ обычно выявляется уже в стадии метастазирования, поэтому хирургическое лечение заболевания заключается в паллиативном вмешательстве. Рекомендуется двусторонняя адреналэктомия, что устраняет проявления гиперкортицизма. Возможно также медикаментозное воздействие на функцию коры надпочечников с помощью хлодитана и элиптена. По последним данным, применение сандостатина дает хорошие результаты.
Паратиринома. Гиперкальциемия как ведущий признак эндокринных опухолей ПЖ – явление редкое. Эктопическая секреция паратгормона при апудомах ПЖ окончательно не доказана, поскольку трудно решить, являются ли проявления гиперпаратиреоза результатом опухоли ПЖ или это составная часть множественной эндокринной неоплазии, которая нередко наблюдается при островковоклеточных новообразованиях.
Опухоли ПЖ с карциноидным синдромом. Многие опухоли ПЖ продуцируют избыток биологически активных веществ, попадающих в системный кровоток: серотонин, гистамин, брадикинин и простагландины. Ряд этих опухолей сопровождается так называемым карциноидным синдромом с типичными для него ощущениями приливов крови к голове, диареей, болями в животе и изредка – поражением правых отделов сердца с развитием фиброза трикуспидального клапана, возникающим под влиянием серотонина.
Типичным внешним проявлением карциноида, обязанным избытку брадикинина и гистамина, является периодическое покраснение кожных покровов от незначительного до выраженного с развитием багрово‑синюшного оттенка длительностью от нескольких минут до нескольких часов и локализующегося преимущественно на лице и верхней части туловища. Наличие клинических проявлений обычно указывает на преодоление биогенными аминами печеночного барьера в результате метастатического процесса.
Лабораторная диагностика позволяет выявить в крови больных высокие уровни серотонина, гистамина и 5‑окситриптофана, а также повышенную экскрецию с мочой 5‑оксииндолуксусной кислоты.
Медикаментозное лечение карциноидного синдрома заключается в комбинированном использовании антагонистов Н^ и Н2‑рецепторов гистамина или метилдопы. Положительный эффект получен от применения сандостатина.
Внутрипротоковые папиллярно‑муцинозные опухоли поджелудочной железы
Внутрипротоковая папиллярная муцинозная опухоль (ВПМО) – это редкая экзокринная опухоль ПЖ, исходящая из главного панкреатического протока или одной из его ветвей и характеризующаяся секрецией большого количества внеклеточной слизи, сосочковым типом роста, скоплением слизи в панкреатических протоках, высокой степенью резектабельности и хорошим прогнозом, диагноз которой в настоящее время ставится все чаще.
Подобные опухоли продуцируют большое количество муцина, что приводит к прогрессивному расширению главного протока железы и/или кистозному расширению протоков 2–3 порядка в зависимости от локализации опухоли.
ВПМО гистологически различаются и могут представлять собой как малых размеров доброкачественные аденомы, так и инвазивные карциномы с агрессивным типом роста и высокой степенью летальности.
ВПМО имеют более благоприятный прогноз, чем протоковые аденокарциномы ПЖ. Однако они часто предшествуют инвазивной аденокарциноме. Злокачественные опухоли встречаются у 30–90 % пациентов и представляют собой либо карциному in situ , либо инвазивную карциному. ВПМО, являющиеся инвазивной карциномой, имеют значительно худший прогноз, чем другие ВПМО поджелудочной железы.
Клиническая картина и данные объективного исследования
ВПМО встречается на шестом‑седьмом десятилетии жизни у мужчин и женщин приблизительно в равной степени с несколько большей частотой у мужчин. В целом это медленно развивающиеся опухоли с относительно благоприятным прогнозом. От появления первых симптомов до постановки диагноза обычно проходит не меньше года.
От 5 до 30 % ВПМО в момент постановки диагноза имеют злокачественный неинвазивный характер, а 15–40 % – являются инвазивным папиллярно‑муцинозным раком. При этом около половины инвазивных опухолей сопровождается наличием метастазов. Локализация процесса определяет его клиническое течение. До 65 % ВПМО локализуется в головке ПЖ, 30 % – в головке или хвосте железы и в 5‑10 % – отмечено диффузное поражение.
Клиническая картина заболевания определяется избыточной секрецией муцина, что, препятствуя нормальному оттоку панкреатического сока, приводит к постепенному расширению главного протока поджелудочной железы или его ветви, и, как следствие – к постепенно развивающимся явлениям хронического панкреатита. До 70–80 % пациентов предъявляют жалобы на дискомфорт и/или боли в эпигастрии, иррадиацию болей в спину, снижение массы тела. В ряде случаев превалирует клиника острого панкреатита умеренной степени тяжести. Часто встречается длительная гиперамилаземия. Хроническая недостаточность функции ПЖ может приводить к развитию сахарного диабета и/или появлению стеатореи. Нередко развивается желтуха: либо в результате закупорки ампулы фатерового соска вязкой слизью, либо при сдавлении общего желчного протока массивной, обычно злокачественной опухолью, либо при врастании в стенку общего желчного протока солидного компонента опухоли. Тем не менее до 75 % случаев
ВПМО протекает бессимптомно, что может быть обусловлено локализацией вне головки ПЖ или сравнительно низкой степенью продукции муцина.
Диагностика
Трансабдоминальное УЗИ, по данным литературы, считается скрининговым методом исследования при обследовании пациентов с подозрением на ВПМО. Следует отметить, что использование трех‑и четырехмерной реконструкции ультразвукового изображения значительно повышает диагностическую ценность УЗИ, позволяя более четко дифференцировать сосочковые выросты, а также пристеночные гипоэхогенные массы в просвете протока. При КТ и магнитно‑резонансной томографии ВПМО может иметь веретенообразную форму при поражении ГПП (Вирсунгова протока) или выглядеть как гроздьевидное скопление кистозных структур при долевом и смешанных типах опухоли.
Магнитно‑резонансная холангиопанкреатография (МРХПГ), особенно после введения секретина для расширения протоков ПЖ, может сравниться по точности с результатами классической ретроградной холангиопанкреатографии (РХПГ) и позволяет обнаружить как расширение протоков, так и наличие в их просвете муциновых пробок или папиллярных разрастаний, которых не всегда легко отличить друг от друга. При опухолях боковых ветвей большое значение имеет возможность установить наличие протока, идущего к ГПП, что служит важнейшим диагностическим признаком ВПМО.
Большое значение имеет дифференциальная диагностика с муцинозными кистозными опухолями ПЖ. Они обычно представлены одиночным кистозным образованием с толстой накапливающей контраст фиброзной капсулой, отграничивающей опухоль от остальной ткани железы. При муцинозных кистозных опухолях обычно нет сообщения с протоковой системой железы.
Лечение
Основным методом лечения ВПМО является хирургический. Резектабельность при данном заболевании превышает 80 %, а 5‑летняя выживаемость после резекции составляет 70–80 %, причем в случае доброкачественных или пограничных с морфологической точки зрения образований она приближается к 100 %. Наличие распространения на другие органы ухудшает прогноз.
Опухоль должна быть удалена. Стандартный объем операции – панкреато‑дуоденальная резекция либо дистальная резекция ПЖ, в зависимости от локализации процесса. Экономные резекции ПЖ возможны, но не всегда оправданы и выполнимы технически при доброкачественной опухоли, исходящей из боковых протоков ПЖ.
Тестовые задания для самоконтроля
Выберите один или несколько правильных ответов.
1. Следующие анатомические образования объединяются в понятие «панкреатодуоденальная область»:
1) поджелудочная железа и двенадцатиперстная кишка;
2) большой дуоденальный сосочек, терминальный отдел общего желчного протока;
3) головка поджелудочной железы и большой дуоденальный сосочек;
4) выходной отдел желудка и двенадцатиперстная кишка;
5) поджелудочная железа, двенадцатиперстная кишка и внепеченочные желчные протоки.
2. Наиболее частой патоморфологической формой рака поджелудочной железы является: 1) плоскоклеточный рак;
2) аденокарцинома;
3) гигантоклеточный рак;
4) мелкоклеточный рак;
5) диморфный рак.
3. К инструментальным методам диагностики опухолей панкреатодуоденальной зоны относятся: 1) УЗИ брюшной полости;
2) ФГДС;
3) ЭРХПГ, ЧЧХГ;
4) КТ, МРТ, МРХПГ, ПЭТ;
5) биохимический анализ крови.
4. Максимальная ширина общего желчного протока в норме (визуально и по данным УЗИ) составляет: 1)5 мм и 7 мм соответственно;
2) 8 мм и 6 мм соответственно;
3) 11 мм и 9 мм соответственно;
4) 10 мм и 12 мм соответственно;
5) все перечисленное неверно.
5. Наиболее часто гематогенные метастазы при раке головки поджелудочной железы локализуются: 1) в печени;
2) в плоских костях;
3) в головном мозге;
4) в легких;
5) в почках.
6. Наиболее типичное расположение большого дуоденального сосочка отмечается: 1) в выходном отделе желудка;
2) в тощей кишке;
3) в верхней горизонтальной части 12‑перстной кишки;
4) в нисходящей части 12‑перстной кишки на задневнутренней стенке;
5) в дуоденоеюнальном изгибе.
7. Наиболее характерными симптомами рака головки поджелудочной железы являются: 1) боли в эпигастрии, похудание, расстройства стула;
2) периодическая мелена, рвота застойным желудочным содержимым;
3) повышенная кровоточивость, изжога;
4) желтуха, кожный зуд, лихорадка с ознобами;
5) боли в пояснице, запоры.
8. Основными ультрасонографическими признаками рака головки поджелудочной железы являются: 1) наличие очагового гипоэхогенного узла;
2) расширение главного панкреатического протока;
3) бугристые контуры поджелудочной железы в зоне очагового образования;
4) расширение внутри– и внепеченочных желчных протоков;
5) наличие свободной жидкости в брюшной полости.
9. Обязательным условием для наложения холецистоеюноанастомоза при нерезектабельной опухоли поджелудочной железы является: 1) отсутствие вовлечения в опухолевый процесс воротной вены;
2) ширина холедоха не более 1,5 см;
3) проходимость пузырного протока;
4) отсутствие отдаленных метастазов;
5) отсутствие высокой желтухи.
10. Наиболее информативным инструментальным методом диагностики рака большого дуоденального сосочка является: 1) УЗИ брюшной полости;
2) ФГДС;
3) МРХПГ;
4) релаксационная дуоденография;
5) ЧЧХГ.
11. Основными источниками кровоснабжения головки поджелудочной железы и 12‑перстной кишки являются: 1) аа. gastricae dextra et sinistra;
2) a. lienalis, a. hepatica propria;
3) a. gastroduodenalis, a. mesenterica superior;
4) a. mesenterica inferior, a. hepatica dextra;
5) a. renalis sinistra.
12. Пальпация увеличенного напряженного безболезненного желчного пузыря в сочетании с безболевой желтухой носит название: 1) симптом Воскресенского;
2) симптом Курвуазье;
3) симптом Кохера;
4) симптом Ортнера‑Грекова;
5) симптом Щеткина‑Блюмберга.
13. Дифференциальный диагноз опухоли терминального отдела общего желчного протока следует проводить со следующими заболеваниями: 1) псевдотуморозный головчатый панкреатит;
2) холедохолитиаз;
3) рубцовая стриктура холедоха;
4) опухоль поджелудочной железы;
5) опухоль поперечного отдела ободочной кишки.
14. Радикальная операция уиппла при раке головки поджелудочной железы включает в себя удаление: 1) головки поджелудочной железы;
2) 12‑перстной кишки;
3) дистального отдела общего желчного протока;
4) выходного отдела желудка;
5) поперечного отдела ободочной кишки.
15. Характерным симптомом для проксимальной опухоли внепеченочных желчных протоков является: 1) симптом Курвуазье;
2) желтуха;
3) лихорадка;
4) увеличение печени;
5) кожный зуд.
16. Основным источником кровоснабжения тела и хвоста поджелудочной железы является: 1) правая желудочно‑сальниковая артерия;
2) левая желудочно‑сальниковая артерия;
3) селезеночная артерия;
4) верхняя брыжеечная артерия;
5) общая печеночная артерия.
17. К особенностям клинической картины рака крючковидного отростка поджелудочной железы относится: 1) опухоль рано прорастает в воротную вену и забрюшинную клетчатку;
2) опухоль поздно распространяется на общий желчный проток и осложняется желтухой;
3) как правило, не развивается обтурационный панкреатит ввиду позднего вовлечения главного панкреатического протока;
4) раннее лимфогенное метастазирование;
5) возникновение аррозионных кровотечений.
18. Ультрасонографическими признаками нерезектабельной опухоли панкреатодуоденальной зоны является: 1) расширение внутрипеченочных желчных протоков, увеличение желчного пузыря;
2) асцит, значительное расширение вен портальной системы;
3) наличие опухолевого узла в средней трети холедоха;
4) полость распада в проекции опухолевого узла;
5) расширение Вирсунгова протока.
19. Восстановительный этап панкреатодуоденальной резекции включает следующие элементы: 1) формирование гастро– или дуоденоеюноанастомоза;
2) восстановление пассажа желчи с помощью формирования холедохоеюноанастомоза;
3) обработка культи поджелудочной железы с формированием панкреатикоеюноанастомоза;
4) наложение холецистоеюноанастомоза;
5) наложение илеотрансверзоанастомоза.
20. Радикальная операция при раке большого дуоденального сосочка – это: 1) эндоскопическая папиллэктомия;
2) трансдуоденальная папиллэктомия;
3) панкреатодуоденальная резекция;
4) дуоденэктомия;
5) наложение билиодигестивного анастомоза.
21. Отток венозной крови от органов панкреатодуоденальной области осуществляется в систему: 1) воротной вены;
2) нижней полой вены;
3) верхней полой вены;
4) непарной и полунепарной вен;
5) нижней брыжеечной вены.
22. Наиболее частыми симптомами рака тела и хвоста поджелудочной железы являются: 1) желтуха, диспепсия;
2) боли в верхних отделах живота и спине, потеря массы тела;
3) запоры, кожный зуд, повышенная кровоточивость;
4) систолический шум в эпигастральной области, изжога;
5) ферментативный перитонит.
23. Основным рентгенологическим признаком рака поджелудочной железы при эндоскопической ретроградной холангиопан‑креатикографии является: 1) обрыв тени контрастированного терминального отдела холедоха в виде «кончика сигары»;
2) сужение терминального отдела холедоха в виде «мышиного хвостика»;
3) заброс контрастного вещества в Вирсунгов проток;
4) наличие дефекта наполнения в просвете холедоха;
5) сужение главного панкреатического протока на ограниченном участке.
24. К опухолям поджелудочной железы из нейроэндокринных клеток относится: 1) гастринома;
2) инсулинома;
3) глюкагонома;
4) аденокарцинома;
5) липома.
25. В качестве I этапа оперативного вмешательства по поводу рака большого дуоденального сосочка (БДС) холецистостомия выполняется при: 1) сочетании опухоли БДС и холедохолитиаза;
2) высокой желтухе и резектабельной опухоли;
3) высокой желтухе и нерезектабельной опухоли;
4) наличии отдаленных метастазов;
5) отрицательном симптоме Курвуазье.
Рекомендуемая литература
Основная
Хирургические болезни / ред. Кузин М.И. 3‑е изд., перераб. и доп. М.: Медицина, 2002.
Дополнительная Блохин Н.Н., Итин А. Б., Клименков А. А. Рак поджелудочной железы и внепеченочных желчных путей. М.: Медицина, 1982. 272 с. Данилов М. В., Федоров В. Д. Руководство по хирургии поджелудочной железы. М.: Медицина, 1995. 510 с.
Кубышкин В. А., Вишневский В. А. Рак поджелудочной железы. М.: Медпрактика, 2003. 375 с.
Лапкин К В., Пауткин Ю. Ф. Билиопанкреатодуоденальный рак. М.: Изд‑во Ун‑та дружбы народов, 1991.
Патютко Ю.И., Котельников А. Г. Хирургия рака органов билио‑панкреатодуоденальной зоны. М.: Медицина, 2007. 448 с.
Путов Н.В., Артемьева Н.Н., Коханенко Н.Ю. Рак поджелудочной железы. СПб: Питер, 2005. 395 с.
Общая онкология. Руководство для врачей / Под ред. Н.П. Напалкова. Л.: Медицина, 1989. 468 с.
Заболевания ободочной кишки
Анатомия и физиология
Толстая кишка начинается от конечной части тонкой кишки и заканчивается заднепроходным отверстием. Выделяют следующие ее части (рис. 169): caecum – слепая кишка с червеобразным отростком – appendix vermiformis; colon ascendens – восходящая ободочная кишка; colon transversum – поперечная ободочная кишка; colon descendens – нисходящая ободочная кишка; colon sigmoideum – сигмовидная ободочная кишка; rectum – прямая кишка и canalis analis – заднепроходной (анальный) канал.
Общая длина толстой кишки колеблется от 1,0 до 1,5 м. Ширина в области caecum достигает 7 см, отсюда постепенно уменьшается, составляя в нисходящей ободочной кишке около 4 см. По своему внешнему виду толстая кишка отличается от тонкой не только более значительным диаметром, но и наличием: 1) особых продольных мышечных тяжей, или лент, teniae coli, 2) характерных вздутий, haustra coli, и 3) отростков серозной оболочки, appendices epiploicae, содержащих жир. Haustra coli, teniae coli и appendices epiploicae служат опознавательными признаками для отличия толстой кишки от тонкой во время операции (рис. 170).
Слизистая оболочка толстой кишки в связи с ослаблением процесса всасывания (всасывается главным образом вода) не имеет ворсинок, и поэтому она в отличие от слизистой оболочки тонкой кишки гладкая. Круговые складки, которые имеются в тонкой кишке, в толстой разбиваются на отдельные отрезки и становятся полулунными, состоящими не только из слизистой, но и из остальных слоев стенки. В слизистой оболочке содержатся только кишечные железы и одиночные фолликулы. Мышечная оболочка состоит из двух слоев: наружного – продольного и внутреннего – циркулярного. Сплошным является только внутренний циркулярный слой, суживающий просвет кишки, который утолщается в связи с необходимостью проталкивать плотные каловые массы. Наоборот, расширяющая продольная мускулатура (сплошная в тонкой кишке) в толстой распадается на описанные выше три teniae, так как расширение просвета облегчается давлением самих каловых масс.
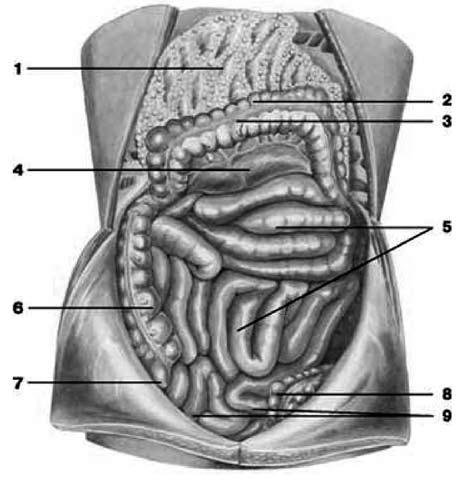
Рис. 169. Ободочная, тощая и подвздошная кишки. 1 – большой сальник;
2 – поперечная ободочная кишка;
3 – свободная лента ободочной кишки;
4 –брыжейка поперечной ободочной кишки; 5 – тощая кишка;
6 – восходящая ободочная кишка;
7 – слепая кишка;
8 – сигмовидная ободочная кишка;
9 – подвздошная кишка

Рис. 170. Структура ободочной кишки. 1 – гаустры; 2 – сальниковая лента; 3 – сальниковые отростки; 4 – свободная лента ободочной кишки; 5 – полулунные складки ободочной кишки; 6 – брыжеечная лента
Отношение ободочной кишки к брюшине следующее: colon as‑cendens в большинстве случаев покрыта брюшиной спереди и с боков, задняя же ее поверхность серозной оболочки не имеет, реже colon ascendens имеет короткую брыжейку (около 35 %). Colon transversum покрыта брюшиной со всех сторон и имеет длинную брыжейку, благодаря чему этот отдел ободочной кишки обладает значительной подвижностью. Отношение colon descendens к брюшине приблизительно то же, что и colon ascendens; брыжейка у нее встречается реже (около 25 %). Colon sigmoideum покрыта брюшиной со всех сторон, имеет значительно выраженную брыжейку и поэтому легко подвижна, образуя характерную для этой части толстой кишки S‑образную кривизну, откуда и происходит ее название. 
Рис. 171 . Артерии ободочной кишки. 1 – артерия червеобразного отростка; 2 – задняя ветвь слепой кишки; 3 – передняя ветвь слепой кишки; 4 – подвздошно‑ободочная артерия и ее ветви; 5 – правая ободочная артерия; 6 – передняя ветвь и 7 – задняя ветвь поджелудочно‑двенадцатиперстной артерии (8); 9 – прямые ветви средней ободочной артерии; 10 – брыжейка поперечной ободочной кишки; 11 – средняя ободочная артерия; 12 – верхняя брыжеечная артерия; 13 – первая ветвь тощей кишки; 14 – тоще– и подвздошнокишечная артерии; 15 – нижняя брыжеечная артерия; 16 – левая ободочная артерия; 17 и 18 – ветви левой ободочной артерии; 19 – сигмовидные артерии; 20 – брыжейка сигмовидной кишки; 21 – прямые ветви сигмовидных артерий; 22 – верхняя прямокишечная артерия
Артерии толстой кишки являются ветвями a. mesenterica superior et а. mesenterica inferior. Кроме того, к среднему и нижнему отделам прямой кишки подходят ветви от a. iliaca interna – аа. rectales media et inferior. При этом a. rectalis inferior является ветвью a. pudenda interna (рис. 171). Вены толстой кишки в разных отделах ее распространяются различно, соответственно строению, функции и развитию стенки кишки. Они впадают через v. mesenterica superior и v. mesenterica inferior в v. portae. Из среднего и нижнего отделов прямой кишки отток венозной крови происходит в v. iliaca interna (в систему нижней полой вены) (рис. 172).
Отводящие лимфатические сосуды толстой кишки впадают в узлы, расположенные по питающим ее артериям (20–50 узлов). Эти узлы по их принадлежности к различным отделам толстой кишки делят на 3 группы:
1) Лимфатические узлы слепой кишки и червеобразного отростка – nodi lymphatici ileocolici.
2) Лимфатические узлы ободочной кишки – nodi lymphatici colici (dextri, medii et sinistri, а также mesenterici inferiores). От поперечной ободочной кишки отводящие лимфатические сосуды идут к 9 группам лимфатических узлов, расположенным по стенке кишки, в брыжейке ее, в желудочно‑ободочной связке, в большом сальнике, в области желудка, поджелудочной железы и селезенки (рис. 173, 174).

Рис. 172. Вены ободочной кишки. Отток венозной крови в систему воротной вены. 1 – подвздошно‑ободочная вена; 2 – правая ободочная вена; 3 – средняя ободочная вена; 4 – верхняя брыжеечная вена; 5 – нижняя брыжеечная вена; 6 – левая ободочная вена; 7 – сигмовидные вены; 8 – верхняя прямокишечная вена
3) Лимфатические узлы прямой кишки. С точки зрения этапности возможного лимфогенного метастазирования принято различать четыре группы лимфатических коллекторов (рис. 174):
1) эпиколические – располагающиеся непосредственно возле стенки кишки;
2) параколические – по ходу краевого сосуда, питающего данный сегмент;
3) промежуточные – вдоль стволов крупных питающих артерий;
4) базальные или апикальные – около устья крупных сосудов (нижней брыжеечной артерии, ободочно‑кишечных артерий).

Рис. 173. Регионарные лимфатические узлы ободочной кишки

Рис. 174. Группы лимфатических коллекторов. 1 – эпиколические; 2 – параколические; 3 – промежуточные; 4 – апикальные
Все отделы толстой кишки получают иннервацию из симпатической (plexi mesentericus superior et inferior, plexi rectales superior, medium et inferior) и парасимпатической систем (n. vagus; для colon sigmoideum и rectum – nn. splanchnici pelvini). Ободочная кишка выполняет основные три функции: всасывательную, пищеварительную и двигательную. Пищевой химус через 3–6 часов после еды начинает поступать из тонкой кишки в толстую. В течение последующих 24–36 часов он постепенно продвигается в дистальном направлении, достигая сигмовидной и прямой кишки. Суточное количество жидкости, проходящей через илеоцекальную заслонку, составляет в норме 2000–4000 мл, причем основное количество этой жидкости всасывается в правых отделах ободочной кишки, а оставшиеся 70‑120 мл выводятся с калом. Участие толстой кишки в процессах всасывания и переваривания пищевых масс значительно снижено (это происходит в основном в тонкой‑тощей и подвздошных кишках), тем не менее в слепой и восходящей ободочной кишке всасываются моносахариды, аминокислоты, жиры и жирные кислоты. Под влиянием бактерий в правой половине толстой кишки осуществляется расщепление глюкозы, синтез витаминов группы В, витамина К, биотина, рибофлавина, тиамина, пантотеновой, никотиновой и фолиевой кислот.
Дивертикулы ободочной кишки
Дивертикулярная болезнь (дивертикулез) ободочной кишки представляет собой морфофункциональный патологический процесс, основным признаком которого является наличие грыжевых выпячиваний слизистой оболочки кишки (дивертикулов) через дефекты в мышечном слое кишечной стенки.
Описание в литературе дивертикулов ободочной кишки относится к первой половине XIX в. D. Fleischmann (1815), G. Cruveilheir (1849), находя на трупах подобные дивертикулам изменения, считали это достаточно редким заболеванием, связанным с запором. В настоящее время дивертикулез ободочной кишки стал довольно распространенным явлением в странах Европы и США. Заболевание встречается практически у 50 % обратившихся к проктологам и гастроэнтерологам, особенно в возрасте старше 60 лет, и почти у каждого в возрасте 80 лет.
Дивертикулы локализуются в разных отделах ободочной кишки с различной частотой. Изолированно в сигмовидной кишке дивертикулы встречаются у 30 % больных, в нисходящей ободочной кишке – у 13 %, наиболее часто дивертикулы занимают оба эти отдела – 38 % случаев. Значительно реже дивертикулез встречается в других отделах кишки: в поперечной ободочной – у 5 % больных, в восходящей – у 6 %, в слепой кишке – у 3 % пациентов. Тотальное поражение ободочной кишки также встречается достаточно редко – в 5 % случаев.
Этиология и патогенез
Причиной образования дивертикулов является снижение сопротивления кишечной стенки внутрито л стокишечному давлению. Ведущее значение в развитии этой патологии имеет потеря эластичности и растяжимости мышечных структур кишечной стенки, врожденная или приобретенная слабость соединительной ткани, нарушение моторики кишечника, слабость участков стенки кишки в точках прохождения кровеносных сосудов и другие. Имеются определенные анатомические предпосылки к развитию дивертикулов в ободочной кишке. К ним относятся: 1) формирование наружного мышечного слоя в виде трех полос (тений), что ослабляет кишку перед внутренним и внешним воздействиями; 2) характер сосудистой архитектоники – наличие артерий и вен перфорантов мышечного каркаса, в результате чего в стенке кишки образуются места наименьшего сопротивления; 3) наличие гаустр, в которых может генерироваться повышенное внутрикишечное давление.
Таким образом, дивертикулез ободочной кишки является многофакторным патологическим процессом, в развитии которого имеют значение как местные, так и системные факторы, приводящие к характерным изменениям в кишечной стенке.
Классификация
Попытки классификации дивертикулов желудочно‑кишечного тракта предпринимались с конца XIX века. Выделяют как истинные (Меккелев, Ценкеровский) дивертикулы – состоящие из всех слоев кишечной стенки, так и ложные – грыжеподобные выпячивания только слизистой и подслизистой оболочки кишки через ослабленный мышечный слой. На практике наиболее удобна клиническая классификация, которая позволяет оценить не только состояние кишки, но и выработать лечебную тактику при дивертикулярной болезни.
1) Бессимптомный дивертикулез.
2) Дивертикулез с клиническими проявлениями.
3) Осложненный дивертикулез:
а) дивертикулит;
б) околокишечный инфильтрат;
в) перфорация дивертикула;
г) кишечный свищ;
д) кишечное кровотечение.
Бессимптомный дивертикулез – случайное выявление дивертикулов при обследовании по поводу других заболеваний. При появлении «кишечной симптоматики» пациентов относят ко второй клинической группе, при которой показано проведение системной терапии. Осложненное течение дивертикулеза требует госпитализации в хирургический стационар и индивидуализированной лечебной тактики.
Клиническая картина и данные объективного обследования дивертикулярной болезни толстой кишки
Дивертикулез длительное время может протекать бессимптомно или иметь незначительные клинические проявления. Клинически выраженный неосложненный дивертикулез проявляется в основном болевым синдромом различного характера и интенсивности, а также нарушением стула. Чаще всего боли локализуются слева в нижних отделах живота. Они могут носить как спастический, так и постоянный ноющий характер. Как правило, боли усиливаются при переполнении кишечника каловыми массами. После дефекации их интенсивность уменьшается. Нарушение стула обычно проявляется в виде запора. Кроме того, больные нередко жалуются на чувство неполного опорожнения кишки и вздутие живота.
С течением времени мышечная оболочка в области устья дивертикулов истончается и замещается жировой тканью. В дивертикулах застаиваются каловые массы, которые на фоне дистрофии кишечной стенки и потери барьерных свойств эпителия приводят к развитию воспалительных изменений – дивертикулита (в связи с отеком слизистой нарушается опорожнение дивертикула, на фоне застоя создаются благоприятные условия для развития патогенной кишечной микрофлоры). Дивертикулит сопровождается появлением постоянной боли в животе, повышением температуры тела вплоть до фебрильных значений. Присоединение к очагу воспаления брыжейки сигмовидной кишки, большого сальника, окружающих органов формирует околокишечный инфильтрат, который может пальпироваться, как правило, в проекции сигмовидной кишки. Перфорация дивертикула в свободную брюшную полость ведет к развитию перитонита, а в брыжейку сигмовидной кишки – забрюшинной флегмоны. Если гнойник вскрывается на кожу брюшной стенки или близлежащий полый орган, то исходом нагноения являются внутренние и наружные свищи, соединяющие просвет ободочной кишки с кожей, мочевым пузырем, реже – тонкой кишкой или влагалищем. Выделения крови с калом бывает у 10–30 % больных дивертикулезом, однако кишечное кровотечение при дивертикулезе редко носит профузный характер. При выраженной атрофии слизистой оболочки травматизация ее твердыми каловыми массами может привести к повреждению сосудов и потере довольно большого объема крови при дефекации и отдельно от каловых масс. На основании жалоб больного (на периодические боли, чаще в левой половине живота, расстройства стула) можно заподозрить патологию толстой кишки.
Лабораторная и инструментальная диагностика
Лабораторные изменения не характерны для неосложненных дивертикулов толстой кишки. При кровотечении возможна анемия, при дивертикулите, перфорации может быть лейкоцитоз. В качестве инструментальных методов диагностики применяются рентгенологические (ирригоскопия) и эндоскопические (фиброколоноскопия) исследования. При дивертикулезе, по данным ирригоскопии, кишечная стенка имеет неровный контур и образует мешковидные выпячивания, имеющие суженное основание (устье). Размеры этих выпячиваний колеблются от 0,2–0,3 до 1–2 см, чаще они локализуются в сигмовидной и нисходящей ободочной кишках (рис. 175).
Рентгенологическое исследование позволяет выявить смещаемость отделов ободочной кишки или, напротив, их фиксацию вследствие паракишечного воспалительного процесса.
Не менее информативным методом выявления дивертикулеза является фиброколоноскопия, которая, кроме определения наличия дивертикулов, позволяет уточнить протяженность воспалительных изменений в просвете кишки, расположение дивертикулов и состояние их слизистой оболочки (рис. 176).
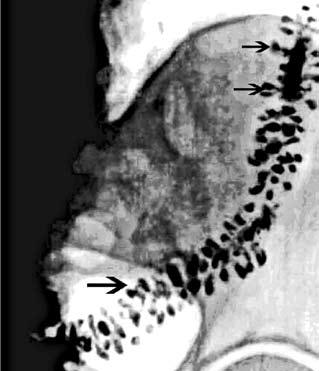
Рис. 175. Ирригограмма.
Множественные дивертикулы сигмовидной кишки (указано стрелкой) Необходимо помнить, что колоноскопия на фоне дивертикулита может привести к перфорации ободочной кишки и должна применяться осторожно, с учетом клиники и данных ирригоскопии.

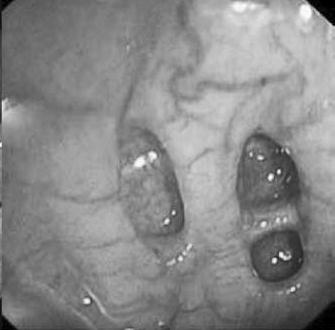


Рис. 176. Дивертикулы ободочной кишки при фиброколоноскопии
Дифференцировать неосложненную дивертикулярную болезнь ободочной кишки приходится с колитами, опухолями, синдромом раздраженной кишки. Точно установить диагноз на основании только клинических симптомов трудно. Для уточнения характера патологии выполняют колоноскопию и ирригоскопию. При осложненном течении дивертикулеза спектр заболеваний, с которыми приходится проводить дифференциальный диагноз, значительно расширяется. Это такие заболевания толстой кишки, как опухоли, болезнь Крона, неспецифический язвенный колит, острый аппендицит. Необходимо проводить дифференциальный диагноз и с внекишечной патологией: почечная колика, аднексит, перитонит неясной этиологии. В сложных диагностических ситуациях целесообразно применение лапароскопии, которая может являться как диагностической, так и лечебной процедурой.
Лечение
Лечебная тактика зависит от стадии заболевания. Так, например, при бессимптомном дивертикулезе, случайно обнаруженном при обследовании, не требуется специальной терапии. Необходимо указать пациенту на наличие у него риска возникновения осложнений заболевания. Профилактические мероприятия должны быть направлены на нормализацию стула с помощью диеты. При клинически выраженном дивертикулезе схема лечебной тактики включает в себя диету, богатую растительной клетчаткой и жидкостью (до 1,5–2,0 л жидкости в сутки), регулирование стула послабляющими средствами, спазмолитиками (при спастических явлениях). Важное значение имеет коррекция развивающегося дисбактериоза на фоне хронического нарушения опорожнения толстой кишки, что выявляют при исследовании кала и при необходимости назначают эубиотики. В случаях осложненного течения дивертикулеза (дивертикулит, паракольный инфильтрат) – больного госпитализируют. При умеренно выраженных явлениях интоксикации назначают вазелиновое масло для смягчения каловых масс, бесшлаковую диету с ограничением клетчатки. Показаны антибиотики широкого спектра действия, спазмолитики. Кровотечение в 90–95 % случаев удается остановить консервативными мероприятиями (гемостатическая и инфузионная терапия, постельный режим). При неэффективности этих мероприятий, для уточнения источника кровотечения, показано проведение селективной ангиографии верхней и нижней брыжеечных артерий с целью локализации источника кровотечения. Такие осложнения, как перфорация дивертикула, продолжающееся кровотечение, абсцедирование, невозможность исключить злокачественную опухоль являются показаниями для оперативного лечения в экстренном и срочном порядке. Периодически возникающие кишечные кровотечения, хронический рецидивирующий дивертикулит, свищи ободочной кишки, отсутствие эффекта от консервативного лечения являются показаниями к операции. Решение в каждом конкретном случае принимают индивидуально, в зависимости от характера патологии и соматического статуса пациента.
Объем операции при дивертикулярной болезни определяется характером заболевания и его осложнений. Чаще всего применяют резекцию наиболее пораженного дивертикулами сегмента ободочной кишки или зоны осложнений (перфорация, инфильтрат, свищ и т. п.). На выбор конкретного оперативного вмешательства влияют следующие факторы: распространенность дивертикулов, наличие воспалительных изменений, возраст и общее состояние больного. При воспалении кишки (дивертикулите) имеется высокий риск несостоятельности толсто‑толстокишечного анастомоза вследствие трофических изменений в кишечной стенке. Поэтому нередко приходится отказаться от формирования первичного анастомоза и разделить хирургическое лечение на несколько этапов: сначала выполнить резекцию измененной кишки и наложить колостому, а затем через 3–4 месяца восстановить непрерывность толстой кишки.
Болезнь Крона
Болезнь Крона – хроническое рецидивирующее заболевание неясной этиологии, характеризующееся трансмуралъным гранулематозным воспалением с сегментарным поражением разных отделов пищеварительного тракта. Заболевание впервые было описано американским врачом В. В. Crohn в 1932 году. Патология характерна для индустриально развитых стран и главным образом городского населения. Болезнь Крона поражает преимущественно молодых людей (средний возраст заболевших 20^10 лет), что делает ее социально значимым заболеванием. Мужчины и женщины болеют приблизительно с одинаковой частотой. Распространенность болезни в разных регионах мира колеблется в широком диапазоне – 20‑150 случаев на 100 000 населения, достигая максимальных показателей в скандинавских странах, Северной Америке, Канаде, Израиле. Ежегодный прирост заболеваемости в Европе составляет 5‑10 случаев на 100000 жителей. Воспалительный процесс при болезни Крона локализуется преимущественно в кишечнике, хотя могут поражаться все отделы желудочно‑кишечного тракта, включая пищевод, желудок, ротовую полость, язык. Выделяют болезнь Крона с поражением подвздошной кишки (терминальный илеит) – 30–35 %; илеоцекального отдела – около 40 %; толстой кишки, включая аноректальную зону – 20 %; тонкой кишки – 5‑10 %.
Этиология и патогенез
В настоящее время нет единого взгляда на этиологию воспалительных заболеваний кишечника. По современным представлениям, болезнь Крона считается полиэтиологическим заболеванием с генетической предрасположенностью, которая позволяет реализоваться неизвестным пока повреждающим агентам. На роль последних могут претендовать бактериальные антигены и их токсины, а также аутоантигены. Влияние микрофлоры рассматривается с позиций стимуляции медиаторов воспаления бактериальными эндотоксинами – липополисахаридами бактерий, которые являются мощными хемотаксическими веществами и вызывают миграцию клеточных элементов в очаг воспаления. Существенную роль в патогенезе играет, по‑видимому, генетически обусловленная повышенная проницаемость кишечной стенки, приводящая к снижению функции кишечного барьера для бактерий и их токсинов. В последнее время особое внимание исследователей привлекает концепция иммунопатогенеза хронических воспалительных заболеваний кишечника. Можно считать доказанным, что при болезни Крона повышается местная выработка антител и обнаруживается сдвиг соотношения секреции IgG и IgA в сторону увеличения продукции IgG.
Классификация
Существующие классификации характеризуют, в основном, локализацию воспалительного процесса в желудочно‑кишечном тракте, но не отражают многообразия клинического течения болезни Крона. За рубежом чаще всего используют классификацию Bocus (1976), согласно которой выделяют семь форм болезни Крона: 1‑я – еюнит, 2‑я – илеит, 3‑я – еюноилеит, 4‑я – энтероколит, 5‑я – гранулематозный колит, 6‑я – поражение анальной области, 7‑я – панрегиональное поражение кишечника с вовлечением верхнего отдела желудочно‑кишечного тракта (желудка, двенадцатиперстной кишки). В России наибольшее применение нашла классификация, предложенная В. Д. Федоровым и М. X. Левитаном (1982), в соответствии с которой выделяют: энтерит, энтероколит и колит.
Клиническая картина и данные объективного исследования
В клинической картине болезни Крона присутствуют несколько основных синдромов: кишечный синдром; эндотоксемия, обусловленная острым воспалением; внекишечные проявления; синдром мальабсорбции. Клинические симптомы определяются морфологическими особенностями воспаления, локализацией и протяженностью процесса. В активной фазе заболевания с развернутой клинической картиной отмечаются диарея, постоянные локализованные боли в животе, кровотечения. Боль в животе является классическим симптомом при болезни Крона и встречается у 85–90 % больных. Поскольку чаще всего воспаление при болезни Крона локализуется в терминальном отрезке подвздошной кишки, для этого заболевания характерна рецидивирующая боль в нижнем правом квадранте живота, причем она может симулировать картину острого аппендицита или непроходимости кишечника (по поводу которых иногда ошибочно больным выполняют лапаротомию, а если выполнен разрез в правой подвздошной области, то – и аппендэктомию). Диарея наблюдается у 90 % больных и обычно бывает менее тяжелой, чем при неспецифическом язвенном колите. При вовлечении в процесс только тонкой кишки частота стула колеблется от 2 до 5 раз в день, а в случаях энтероколитов – до 10 раз. Консистенция кала чаще бывает кашицеобразной. Однако у тех больных, у которых значительно поражена только тонкая кишка, стул может быть более жидким или водянистым. Упорная диарея и белковый катаболизм приводят к значительной потере массы тела. Источником кровотечений при болезни Крона являются глубокие язвы и трещины на каком‑либо участке кишечной стенки. Массивные кишечные кровотечения, которые рассматриваются как осложнение заболевания, отмечаются у 1–2% больных. Повышение температуры тела относится к основным проявлениям болезни Крона и регистрируется при обострении заболевания у трети больных. Лихорадка обычно связана с наличием гнойных процессов (свищи, инфильтраты, абсцессы) или системными осложнениями токсико‑аллергического характера. Уменьшение массы тела при болезни Крона, так же как и при язвенном колите, связано с недостаточным поступлением питательных веществ из‑за отсутствия аппетита и боли в животе, нарушением процесса их всасывания и усилением катаболизма. Основные нарушения обмена веществ включают анемию, стеаторею, гипопротеинемию, авитаминоз, гипокальциемию, гипомагниемию и дефицит других микроэлементов. Болезнь Крона часто сопровождается аутоиммунным системным поражением органов. Наиболее часто встречаются артропатии, примерно у 40–60 % пациентов. Обычно отмечаются моно– и полиартриты крупных суставов, артралгии и артропатии мелких суставов, реже встречаются анкилозирующий спондилит, сакроилеит. Кожные поражения чаще проявляются узловатой эритемой и гангренозной пиодермией. Наиболее типичным осложнением со стороны слизистых оболочек является афтозный стоматит. Часто встречается остеопороз, который имеет смешанный механизм развития. Как правило, он связан с нарушением всасывания и обмена кальция или является следствием стероидной терапии, однако возможен и иммуновоспалительный компонент в его развитии. Местными осложнениями болезни Крона могут быть анальные и перианальные поражения (свищи прямой кишки, абсцессы в параректальной клетчатке, анальные трещины), стриктуры различных отделов кишечника, инфильтраты и абсцессы в брюшной полости, наружные и внутренние свищи. Такие жизнеугрожающие осложнения, как перфорация и токсическая дилатация кишки при болезни Крона встречаются редко.
Лабораторная и инструментальная диагностика
Следующие лабораторные показатели дают ориентировочную информацию о степени тяжести воспалительного процесса в кишечнике: СОЭ, С‑реактивный белок, лейкоциты, тромбоциты, альбумин сыворотки, железо, показатели свертывающей системы крови. Лабораторная диагностика болезни Крона основана на определении антител к пекарским дрожжам Saccharomyces cerevisiae (ASCA) класса Js6, антител к цитоплазме нейтрофилов с определением типа свечения, антител к Saccharomyces cerevisiae (ASCA) класса JSA, антител к бокаловидным клеткам кишечника, антител к экзокринной части поджелудочной железы, антител к цитоплазме нейтрофилов класса SgA. Информативность этих тестов в комплексе до 95 %.
Рентгенологическая диагностика болезни Крона основывается на выявлении прерывистого характера поражения кишечника, вовлечения в процесс тонкой и толстой кишок, правосторонней локализации процесса в ободочной кишке с образованием глубоких язв‑трещин, внутренних свищей, ретроперитонеальных абсцессов с формированием свищей и слепых синусов в случаях вовлечения в процесс тонкой кишки. Ведущим рентгенологическим симптомом болезни Крона является сужение пораженного участка кишки. Степень сужения прямо пропорциональна давности заболевания. В отдельных случаях кишка суживается неравномерно и эксцентрично. Гаустры в недалеко зашедших случаях сглаживаются и принимают неправильную форму, при прогрессировании процесса они исчезают вовсе. Весьма характерным при болезни Крона считается чередование пораженных фрагментов кишки с нормальными. Эндоскопическая картина при болезни Крона характеризуется наличием афтоидных язв на фоне неизмененной слизистой оболочки. По мере прогрессирования процесса язвы увеличиваются в размерах, принимают линейную форму. Чередование островков сохранившейся слизистой оболочки с глубокими продольными и поперечными язвами‑трещинами создает картину «булыжной мостовой» (рис. 177).
При морфологическом исследовании биоптатов отмечается трансмуральный характер воспаления, наличие гранулем с характерными клетками типа Пирогова‑Ланхганса. К сожалению, даже при микроскопии точный диагноз устанавливается лишь в 23–30 % случаев.
Таблица № 1 Дифференциально‑диагностические критерии неспецифического язвенного колита и болезни Крона




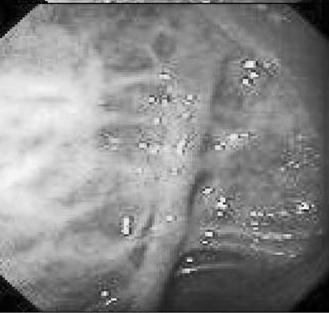
Рис. 177. Эндоскопическая картина при болезни Крона.
Болезнь Крона необходимо дифференцировать от многих заболеваний. Гранулематозное поражение тонкой кишки часто диагностируется как аппендикулярный абсцесс или острый аппендицит, так как дифференцировать их крайне трудно. Иногда невозможно отличить болезнь Крона от воспаления в дивертикуле Меккеля и других острых заболеваний брюшной полости. Наиболее сложна дифференциальная диагностика болезни Крона и неспецифического язвенного колита, от которого она отличается отсутствием поражения прямой кишки в 50 % случаев, более глубокими язвами толстой кишки, асимметричностью и прерывистостью процесса, тенденцией к формированию стриктур и свищей. Основные дифференциальнодиагностические критерии язвенного колита и болезни Крона отражены в таблице 1 (Г. И. Воробьев, 2001, с изменениями). Лечение
Принципы консервативного и противорецидивного лечения болезни Крона включают в себя противовоспалительную, гормональную, симптоматическую терапию. Комплексная терапия назначается на фоне специальной щадящей диеты с исключением цельного молока, фруктов и овощей, включением нежирного мяса и рыбы. Основными медикаментами являются салазопрепараты – сульфасалазин, месалазин, салофальк и другие. Широко применяются кортикостероиды, они, как правило, высокоэффективны как при системном, так и при местном применении. Однако необходимо отметить, что применение гормональной терапии уменьшает клинические проявления заболевания, но не улучшает гистологическую и эндоскопическую картину заболевания. У пациентов с повышенной психологической возбудимостью целесообразно назначение седативных препаратов.
Хирургическое лечение болезни Крона, в отличие от язвенного колита, не носит радикальный характер, так как гранулематозное воспаление может развиваться в любом отделе желудочно‑кишечного тракта. Целями хирургического лечения при болезни Крона являются борьба с осложнениями и улучшение качества жизни пациентов, когда этого невозможно достичь медикаментозными средствами. Независимо от характера течения болезни Крона примерно у 60 % пациентов в связи с развитием осложнений возникает необходимость в оперативном лечении, особенно в случаях поражения толстой и подвздошной кишки. Неэффективные кортикостероидная и иммуносупрессивная терапия, даже при отсутствии осложнений, также являются показанием к операции – резекции пораженного участка. Однако нет никакой гарантии, что после операции не возникнет рецидив в зоне анастомоза или в любом другом месте ЖКТ, так как естественное течение болезни Крона не прерывается и после хирургического вмешательства. Частота послеоперационных рецидивов составляет 20–40 % в течение 5 лет после резекции, как минимум каждый третий больной нуждается в повторной операции.
Дата добавления: 2018-09-22; просмотров: 260; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
