В (А – определяемое вещество, В - титрант)
Прием титрования:
| a)p | заместительное |
| b)p | обратное |
| c)p | прямое реверсивное |
| d)p | прямое истинное |
| Вопрос №401 |
Эквивалент в методах окислительно-восстановительного титрования определяют по соответствию:
| a)p | одному электрону |
| b)p | одному протону |
| c)p | одному положительному заряду металло-иона |
| Вопрос №402 |
Схема титрования
В
↓
А + вспомогательное в-во → заместитель А (А – определяемое вещество, В - титрант)
Прием титрования:
| a)p | прямое реверсивное |
| b)p | обратное |
| c)p | прямое истинное |
| d)p | заместительное |
| Вопрос №403 |
Титрование 10,00 мл 0,1000 н. раствора щавелевой кислоты ≈ 0,1 н. раствором перманганата калия относят к
| a)p | прямому истинному |
| b)p | заместительному |
| c)p | обратному |
| d)p | прямому реверсивному |
| Вопрос №404 |
Титр титранта по определяемому веществу Т(В/А) – это:
| a)p | число молей вещества в 1 литре раствора |
| b)p | отношение массы вещества к массе раствора |
| c)p | число молей эквивалентов вещества в 1 литре раствора |
| d)p | число граммов вещества в 1 литре раствора |
| e)p | число граммов вещества, которое соответствует 1 мл титранта |
| Вопрос №405 |
Массовая доля вещества в растворе (ω%) – это:
|
|
|
| a)p | число граммов вещества в 1 миллилитре раствора |
| b)p | число молей вещества в 1 литре раствора |
| c)p | число граммов вещества в 100 граммах раствора |
| d)p | число граммов вещества в 1 литре раствора |
| e)p | число молей эквивалентов вещества в 1 литре раствора |
| Вопрос №406 |
Количество значащих цифр в числе 0,008050:
| [.........4.........] |
| Вопрос №407 |
Титр титранта – это:
| a)p | число молей-эквивалентов вещества в 1 литре раствора |
| b)p | число граммов вещества в 1 литре раствора |
| c)p | число молей вещества в 1 литре раствора |
| d)p | число граммов вещества в 1 миллилитре раствора |
| e)p | отношение массы вещества к массе раствора |
| Вопрос №408 |
Формула для расчета содержания вещества в растворе в граммах (способ отдельных навесок), если известен титр титранта по определяемому веществу:
| a)p | g(A),г = T(B/A)·V(B) |
| b)p | g(A),г = T(B/A) - V(B) |
| c)p | g(A),г = T(B/A) / V(B) |
| d)p | g(A),г = T(B/A)+V(B) |
| Вопрос №409 |
Формула для расчета содержания вещества в растворе в граммах (способ аликвотных частей):
| a)p | 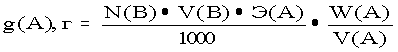
|
| b)p | 
|
| c)p | 
|
| d)p | 
|
|
|
|
| Вопрос №410 |
Формула для расчета содержания вещества в растворе в % (способ аликвотных частей):
| a)p | 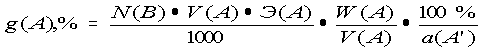
|
| b)p | 
|
| c)p | 
|
| d)p | 
|
| Вопрос №411 |
Формула для расчета титра раствора титранта (В) по определяемому веществу (А):
| a)p | 
|
| b)p | 
|
| c)p | 
|
| d)p | 
|
| Вопрос №412 |
Формула для расчета содержания вещества в растворе в % (способ отдельных навесок):
| a)p | 
|
| b)p | 
|
| c)p | 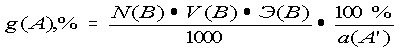
|
| Вопрос №413 |
Формула для расчета поправочного коэффициента (К) к нормальности раствора:
| a)p | 
|
| b)p | 
|
| Вопрос №414 |
Формула для расчета содержания вещества в растворе в граммах (способ отдельных навесок):
| a)p | 
|
| b)p | 
|
| c)p | 
|
| d)p | 
|
| Вопрос №415 |
Формула для расчета концентрации раствора титранта по закону эквивалентов:
| a)p | 
|
| b)p | 
|
| c)p | 
|
| Вопрос №416 |
Формула для расчета концентрации раствора стандартного вещества:
| a)p | 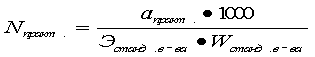
|
| b)p | 
|
| c)p | 
|
| Вопрос №417 |
Формула для расчета навески вещества для приготовления раствора:
|
|
|
| a)p | 
|
| b)p | 
|
| c)p | 
|
| d)p | 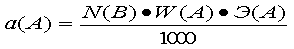
|
| Вопрос №418 |
Титрантом в алкалиметрическом титровании является:
| a)p | NH3.H2O |
| b)p | H2SO4 |
| c)p | NaOH |
| d)p | HCl |
| Вопрос №419 |
Титрантом в методе Мора является
| a)p | комплексон III |
| b)p | AgNO3 |
| c)p | K2Cr2O7 |
| d)p | МgSO4·7H2O |
| Вопрос №420 |
Титрантом в иодиметрическом титровании является
| a)p | NaNO2 |
| b)p | Na2S2O3·5H2O |
| c)p | H2C2O4·2H2O |
| d)p | Na2SO4 |
| Вопрос №421 |
Титрантом в методе Фольгарда является
| a)p | NH4NCS |
| b)p | МgSO4·7H2O |
| c)p | K2Cr2O7 |
| d)p | комплексон III |
| Вопрос №422 |
Титрантом в ацидиметрическом титровании является
| a)p | NaOH |
| b)p | H2C2O4·2H2O |
| c)p | H2SO4 |
| d)p | CH3COOH |
| Вопрос №423 |
Титрантом в перманганатометрическом титровании является
| a)p | КМnO4 |
| b)p | HМnO4 |
| c)p | H2C2O4·2H2O |
| d)p | МnSO4 |
| Вопрос №424 |
Уравнение полуреакции титранта в перманганатометрическом титровании в сильнокислой среде
| a)p | MnO4– + 8H+ + 2e– = Mn2+ + 4H2O |
| b)p | MnO4– + H+ + 5e – = Mn2+ + 4H2O |
| c)p | MnO4– + 8H+ + 5e– = Mn2+ + 4H2O |
| d)p | MnO4– + 8H+ + 3e– = Mn2+ + 4H2O |
|
|
|
| Вопрос №425 |
Титрантом в тиоцианатометрическом титровании является
| a)p | комплексон III |
| b)p | K2Cr2O7 |
| c)p | NH4NCS |
| d)p | МgSO4·7H2O |
| Вопрос №426 |
Титрантом в дихроматометрическом титровании является
| a)p | K2Cr2O7 |
| b)p | Cr2(SO4)3 |
| c)p | Na2S2O3·5H2O |
| d)p | K2CrO4 |
| Вопрос №427 |
Титрантом в методе Фаянса является
| a)p | NH4NCS |
| b)p | AgNO3 |
| c)p | K2Cr2O7 |
| d)p | МgSO4·7H2O |
| Вопрос №428 |
Титрантом в иодиметрическом титровании является
| a)p | I3- |
| b)p | KIO3 |
| c)p | ICl |
| d)p | KI |
| Вопрос №429 |
Стандартным веществом в иодиметрическом титровании является
| a)p | Na2B4O7·10H2O |
| b)p | H2C2O4·2H2O |
| c)p | МgSO4·7H2O |
| d)p | K2Cr2O7 |
| Вопрос №430 |
Стандартным веществом в методе Мора является
| a)p | AgNO3 |
| b)p | NaCl |
| c)p | K2Cr2O7 |
| d)p | H2C2O4·2H2O |
| Вопрос №431 |
Стандартным веществом в дихроматометрическом титровании является
| a)p | K2Cr2O7 |
| b)p | Na2S2O3·5H2O |
| c)p | МgSO4·7H2O |
| d)p | H2C2O4·2H2O |
| Вопрос №432 |
Стандартным веществом в методе Фаянса является
| a)p | AgNO3 |
| b)p | Na2S2O3·5H2O |
| c)p | K2Cr2O7 |
| d)p | NaCl |
| Вопрос №433 |
Стандартным веществом в тиоцианатометрическом титровании является
| a)p | H2C2O4·2H2O |
| b)p | Na2S2O3·5H2O |
| c)p | NaCl |
| d)p | NH4NCS |
| Вопрос №434 |
Стандартным веществом в методе Фольгарда является
| a)p | H2C2O4·2H2O |
| b)p | NaCl |
| c)p | K2Cr2O7 |
| d)p | Na2S2O3·5H2O |
| Вопрос №435 |
Стандартным веществом в алкалиметрическом титровании является:
| a)p | НCl |
| b)p | H2C2O4·2H2O |
| c)p | Na2B4O7·10H2O |
| d)p | H2SO4 |
| Вопрос №436 |
Уравнение полуреакции стандартного вещества в перманганатометрическом титровании в сильнокислой среде
| a)p | Н2С2O4 +2e– = 2СО2 + 2H+ |
| b)p | Н2С2O4 - 2e– = 2СО2 + H+ |
| c)p | Н2С2O4 - 2e– = СО2 + 2H+ |
| d)p | Н2С2O4 - 2e– = 2СО2 + 2H+ |
| e)p | Н2С2O4 - e– = 2СО2 + 2H+ |
| Вопрос №437 |
Стандартным веществом в ацидиметрическом титровании является
| a)p | H2C2O4·2H2O |
| b)p | NH3.H2O |
| c)p | NaOH |
| d)p | Na2B4O7·10H2O |
| Вопрос №438 |
Вспомогательным веществом при стандартизации Na2S2O3·5H2O по K2Cr2O7 является
| a)p | I2 |
| b)p | H2SO4 |
| c)p | KIO |
| d)p | KI |
| Вопрос №439 |
Стандартным веществом в комплексонометрическом титровании является
| a)p | H2C2O4·2H2O |
| b)p | Na2S2O3·5H2O |
| c)p | МgSO4·7H2O |
| d)p | K2Cr2O7 |
| Вопрос №440 |
Стандартным веществом в перманганатометрическом титровании является
| a)p | K2Cr2O7 |
| b)p | МgSO4·7H2O |
| c)p | H2C2O4·2H2O |
| d)p | Na2B4O7·10H2O |
| Вопрос №441 |
Тип индикатора железо-аммонийные квасцы
| a)p | металлохромный |
| b)p | осадительный |
| c)p | редокс |
| d)p | адсорбционный |
| Вопрос №442 |
Индикатором в алкалиметрическом титровании является:
| a)p | дифениламин |
| b)p | фенолфталеин |
| c)p | флуоресцеин |
| d)p | мурексид |
| Вопрос №443 |
Индикатором в методе Фаянса является
| a)p | избыточная капля титранта |
| b)p | флуоресцеин |
| c)p | дихромат калия |
| d)p | хромат калия |
| Вопрос №444 |
Индикатором в методе Фольгарда является
| a)p | флуоресцеин |
| b)p | хромат калия |
| c)p | избыточная капля титранта |
| d)p | железоаммонийные квасцы |
| Вопрос №445 |
Тип индикатора хромата калия
| a)p | металлохромный |
| b)p | осадительный |
| c)p | редокс |
| d)p | адсорбционный |
| Вопрос №446 |
Индикатором в иодиметрическом титровании является
| a)p | метилоранж |
| b)p | крахмал |
| c)p | мурексид |
| d)p | избыточная капля титранта |
| Вопрос №447 |
Тип индикатора флуоресцеина
| a)p | адсорбционный |
| b)p | редокс |
| c)p | металлохромный |
| d)p | осадительный |
| Вопрос №448 |
Индикатором в дихроматометрическом титровании является
| a)p | метилоранж |
| b)p | избыточная капля титранта |
| c)p | дифениламин |
| d)p | мурексид |
| Вопрос №449 |
Индикатором в комплексонометрическом титровании является
| a)p | избыточная капля титранта |
| b)p | дифениламин |
| c)p | метилоранж |
| d)p | мурексид |
| Вопрос №450 |
Индикатором в ацидиметрическом титровании является
| a)p | флуоресцеин |
| b)p | метилоранж |
| c)p | дифениламин |
| d)p | мурексид |
| Вопрос №451 |
Раствор перманганата калия можно использовать в качестве индикатора, так как он
| a)p | окрашен |
| b)p | окислитель |
| c)p | устойчив при хранении |
| Вопрос №452 |
Серная кислота оттитрована гидроксидом натрия. Укажите индикаторную ошибку при использовании индикатора фенолфталеина с рТ = 9:
| a)p | гидроксидная (+) |
| b)p | кислотная |
| c)p | основная |
| d)p | водородная (-) |
| e)p | водородная (+) |
| Вопрос №453 |
Азотная кислота оттитрована гидроксидом натрия. Укажите индикаторную ошибку при использовании индикатора метилового красного с рТ = 5:
| a)p | гидроксидная (-) |
| b)p | водородная (-) |
| c)p | кислотная |
| d)p | водородная (+) |
| e)p | основная |
| Вопрос №454 |
Тетраборат натрия оттитрован хлороводородной кислотой. Укажите индикаторную ошибку при использовании индикатора метилового оранжевого с рТ = 4 (рНт.э.= 5,1)
| a)p | гидроксидная (-) |
| b)p | водородная (-) |
| c)p | гидроксидная (+) |
| d)p | водородная (+) |
| e)p | основная |
| Вопрос №455 |
Соляная кислота оттитрована гидроксидом натрия. Укажите индикаторную ошибку при использовании индикатора метилового оранжевого с рТ = 4:
| a)p | основная |
| b)p | кислотная |
| c)p | водородная (-) |
| d)p | водородная (+) |
| e)p | гидроксидная (+) |
| f)p | гидроксидная (-) |
| Вопрос №456 |
Тип индикатора мурексида
| a)p | редокс |
| b)p | адсорбционный |
| c)p | металлохромный |
| d)p | осадительный |
| Вопрос №457 |
Индикатором в методе Мора является
| a)p | избыточная капля титранта |
| b)p | дихромат калия |
| c)p | хромат калия |
| d)p | флуоресцеин |
| Вопрос №458 |
Гидроксид натрия оттитрован хлороводородной кислотой. Укажите индикаторную ошибку при использовании индикатора фенолфталеина с рТ = 9
| a)p | гидроксидная (-) |
| b)p | водородная (-) |
| c)p | гидроксидная (+) |
| d)p | водородная (+) |
| e)p | основная |
| Вопрос №459 |
Индикатором в перманганатометрическом титровании является
| a)p | метилоранж |
| b)p | мурексид |
| c)p | избыточная капля титранта |
| d)p | флуоресцеин |
| Вопрос №460 |
Индикатором в тиоцианатометрическом титровании является
| a)p | флуоресцеин |
| b)p | хромат калия |
| c)p | дихромат калия |
| d)p | железоаммонийные квасцы |
| Вопрос №461 |
Фактор эквивалентности перманганата калия при титровании им в кислой среде равен
| a)p | 1 |
| b)p | 1/2 |
| c)p | 1/5 |
| d)p | 1/4 |
| Вопрос №462 |
Фактор эквивалентности щавелевой кислоты при определении ее алкалиметрическим титрованием равен:
| a)p | 1/2 |
| b)p | 1/4 |
| c)p | 1 |
| d)p | 1/3 |
| Вопрос №463 |
Фактор эквивалентности перманганата калия в кислой среде
| a)p | 1/5 |
| b)p | 1/2 |
| c)p | 1 |
| d)p | 1/4 |
| Вопрос №464 |
Фактор эквивалентности МgSO4·7H2O в комплексонометрическом титровании равен
| a)p | 1 |
| b)p | 1/6 |
| c)p | 1/3 |
| d)p | 1/2 |
| Вопрос №465 |
Фактор эквивалентности K2Cr2O7 в дихроматометрическом титровании равен
| a)p | 1/2 |
| b)p | 1 |
| c)p | 1/6 |
| d)p | 1/5 |
| Вопрос №466 |
Фактор эквивалентности Na2S2O3·5H2O в иодиметрическом титровании
| a)p | 1/5 |
| b)p | 1/3 |
| c)p | 1/2 |
| d)p | 1 |
| Вопрос №467 |
Фактор эквивалентности гидроксида натрия равен:
| [........1..........] |
| Вопрос №468 |
Фактор эквивалентности карбоната калия при определении его ацидиметрическим титрованием с индикатором метиловым оранжевым равен
| a)p | 1 |
| b)p | 1/4 |
| c)p | 1/2 |
| d)p | 1/3 |
| Вопрос №469 |
Фактор эквивалентности тиоцианата аммония в тиоцианатометрическом титровании равен
| a)p | 1 |
| b)p | 1/2 |
| c)p | 1/3 |
| d)p | 1/6 |
| Вопрос №470 |
Фактор эквивалентности оксалата калия при определении его перманганатометрическим титрованием равен
| a)p | 1 |
| b)p | 1/4 |
| c)p | 1/3 |
| d)p | 1/2 |
| Вопрос №471 |
Фактор эквивалентности тетрабората натрия при определении его ацидиметрическим титрованием равен
| a)p | 1/2 |
| b)p | 1 |
| c)p | 1/3 |
| d)p | 1/4 |
| Вопрос №472 |
Фактор эквивалентности карбоната калия при определении его ацидиметрическим титрованием с индикатором фенолфталеином равен
| a)p | 1 |
| b)p | 1/3 |
| c)p | 1/4 |
| d)p | 1/2 |
| Вопрос №473 |
Фактор эквивалентности серной кислоты в ацидиметрическом титровании равен
| a)p | 1/2 |
| b)p | 1/3 |
| c)p | 1/4 |
| d)p | 1 |
| Вопрос №474 |
Фактор эквивалентности Al3+ в комплексонометрическом титровании равен
| a)p | 1 |
| b)p | 1/2 |
| c)p | 1/3 |
| d)p | 3 |
| Вопрос №475 |
Фактор эквивалентности комплексона III в комплексонометрическом титровании равен
| a)p | 1/6 |
| b)p | 1/2 |
| c)p | 1 |
| d)p | 1/5 |
| Вопрос №476 |
Фактор эквивалентности нитрата серебра в аргентометрическом титровании равен
| a)p | 1/6 |
| b)p | 1/5 |
| c)p | 1/2 |
| d)p | 1 |
| Вопрос №477 |
Фактор эквивалентности серной кислоты при определении ее алкалиметрическим титрованием равен:
| a)p | 1/2 |
| b)p | 1/4 |
| c)p | 1/3 |
| d)p | 1 |
| Вопрос №478 |
Фактор эквивалентности хлорида натрия титровании равен
| a)p | 1 |
| b)p | 1/6 |
| c)p | 1/5 |
| d)p | 1/2 |
| Вопрос №479 |
Преимущества метода дихроматометрии
| a)p | титрант готовят по точной навеске |
| b)p | все перечисленное |
| c)p | растворы дихромата калия очень устойчивы |
| d)p | титровать можно в сильнокислой среде |
| Вопрос №480 |
Для приготовления 100 мл стандартного раствора щавелевой кислоты следует использовать:
| a)p | цилиндр на 100 мл |
| b)p | мензурку на 100 мл |
| c)p | мерную колбу вместимостью 100 мл |
| d)p | мерную колбу вместимостью 200 мл |
| Вопрос №481 |
Количественное определение пероксида водорода можно провести методом
| a)p | алкалиметрии |
| b)p | перманганатометрии |
| c)p | комплексонометрии |
| d)p | ацидиметрии |
| Вопрос №482 |
Для приготовления 200 мл стандартного раствора тетрабората натрия следует использовать
| a)p | цилиндр на 250 мл |
| b)p | мерную колбу вместимостью 100 мл |
| c)p | мерную колбу вместимостью 200 мл |
| d)p | мензурку на 200 мл |
| Вопрос №483 |
Иодиметрическим титрованием можно определить
| a)p | КМnO4 |
| b)p | H2SO4 |
| c)p | Na2CO3 |
| d)p | Na2SO4 |
| Вопрос №484 |
При титровании щелочного раствора кислотой в присутствии двух индикаторов затрачено 18 мл кислоты с индикатором ФФ и 20 мл – с МО. В смеси содержатся:
| a)p | ОН - |
| b)p | НСО3- и СО32- |
| c)p | НСО3- |
| d)p | СО32- и ОН- |
| e)p | СО32- |
| Вопрос №485 |
При титровании щелочного раствора в присутствии двух индикаторов затрачено 20 мл кислоты с индикатором ФФ и 20 мл – с МО. В смеси содержатся:
| a)p | НСО3- |
| b)p | НСО3- и СО32- |
| c)p | СО32- и ОН- |
| d)p | СО32- |
| e)p | ОН- |
| Вопрос №486 |
Алкалиметрическим титрованием можно определить:
| a)p | Na2CO3 |
| b)p | Na2B4O7·10H2O |
| c)p | NH3.H2O |
| d)p | NaOH |
| e)p | CH3COOH |
| Вопрос №487 |
Определение перманганата калия иодиметрическим титрованием проводят в
| a)p | среде ацетатного буферного раствора |
| b)p | щелочной среде |
| c)p | нейтральной среде |
| d)p | кислой среде |
| e)p | среде аммиачного буферного раствора |
| Вопрос №488 |
При титровании щелочного раствора в присутствии двух индикаторов затрачено 8 мл кислоты с индикатором ФФ, а с МО – 16 мл. В смеси содержатся:
| a)p | НСО3- |
| b)p | СО32- |
| c)p | ОН- |
| d)p | СО32- и ОН- |
| e)p | НСО3- и СО32- |
| Вопрос № 489 |
Перманганатометрическим титрованием можно определить
| a)p | H2C2O4·2H2O |
| b)p | CH3COOH |
| c)p | Na2CO3 |
| d)p | H2SO4 |
| Вопрос №490 |
Для стандартизации раствора гидроксида натрия нельзя использовать кислоту:
| a)p | соляную |
| b)p | щавелевую |
| c)p | янтарную |
| d)p | бензойную |
| Вопрос №491 |
При титровании щелочного раствора кислотой в присутствии двух индикаторов затрачено 8 мл кислоты с индикатором ФФ, а с МО – 20 мл. В смеси содержатся:
| a)p | СО32- |
| b)p | НСО3- |
| c)p | СО32- и ОН- |
| d)p | НСО3- и СО32- |
| e)p | ОН- |
| Вопрос №492 |
Дихроматометрическое титрование используют для
| a)p | всего перечисленного |
| b)p | заместительного титрования ни окислителей, ни восстановителей |
| c)p | прямого титрования восстановителей |
| d)p | обратного титрования окислителей |
| Вопрос №493 |
При титровании щелочного раствора кислотой в присутствии двух индикаторов затрачено примерно 0 мл с индикатором фенолфталеином и 20 мл кислоты с индикатором метиловым оранжевым. В смеси содержатся:
| a)p | СО32- и ОН- |
| b)p | НСО3- и СО32- |
| c)p | СО32- |
| d)p | ОН- |
| e)p | НСО3- |
| Вопрос №494 |
Недостатки метода иодиметрии
| a)p | иод летуч |
| b)p | титр раствора иода меняется при хранении |
| c)p | все перечисленное |
| d)p | нельзя титровать в щелочной среде |
| Вопрос №495 |
Прямым перманганатометрическим титрованием нельзя определить
| a)p | H2O2 |
| b)p | FeSO4 |
| c)p | H2C2O4·2H2O |
| d)p | Fe2(SO4)3 |
| Вопрос №496 |
Автокатализатором в перманганатометрическом титровании является
| a)p | MnO2 |
| b)p | MnO42– |
| c)p | MnO4– |
| d)p | Mn2+ |
| Вопрос №497 |
Иодиметрическое титрование используют для
| a)p | прямого титрования препаратов, содержащих иод |
| b)p | заместительного титрования окислителей |
| c)p | всего перечисленного |
| d)p | заместительного титрования ни окислителей, ни восстановителей |
| e)p | обратного титрования летучих восстановителей |
| Вопрос №498 |
Дихроматометрическим титрованием можно определить
| a)p | КМnO4 |
| b)p | Na2SO4 |
| c)p | H2SO4 |
| d)p | FeSO4 |
| Вопрос №499 |
Ацидиметрическим титрованием можно определить
| a)p | CH3COOH |
| b)p | H2SO4 |
| c)p | Na2CO3 |
| d)p | H2C2O4·2H2O |
| Вопрос №500 |
Перманганатометрическое титрование используют для
| a)p | заместительного титрования ни окислителей, ни восстановителей |
| b)p | всего перечисленного |
| c)p | для определения органических веществ |
| d)p | обратного титрования окислителей |
| e)p | прямого титрования восстановителей |
| Вопрос №501 |
Перманганатометрическое титрование оксалатов проводят в
| a)p | нейтральной среде |
| b)p | щелочной среде |
| c)p | кислой среде |
| d)p | сильнощелочной среде |
| Вопрос №502 |
Значение рН титриметрической системы при титровании 100 мл раствора KOH (А) с С = 0,1 моль/л раствором HI (В) с такой же концентрацией, когда прибавлено 100,0 мл HI, равно:
| [.........7.........] |
| Вопрос №503 |
Значение рН титриметрической системы при титровании 100 мл раствора HCl (А) с С = 0,1 моль/л раствором NaOH (В) с такой же концентрацией, когда прибавлено 100,1 мл NaOH, равно:
| [.......10...........] |
| Вопрос №504 |
Значение рН титриметрической системы при титровании 100 мл раствора NaOH (А) с С = 0,1 моль/л раствором HI (В) с такой же концентрацией, когда прибавлен 101 мл HI, равно:
| [........3..........] |
| Вопрос №505 |
Значение рН титриметрической системы при титровании 100 мл раствора HCl (А) с С = 0,4 моль/л раствором NaOH (В) с такой же концентрацией, когда прибавлено 99,9 мл NaOH, равно:
| [.....3,3..3,5...........] |
| Вопрос №506 |
Значение рН титриметрической системы при титровании 100 мл раствора NaOH (А) с С = 0,1 моль/л раствором HNO3 (В) с такой же концентрацией, когда прибавлено 99,9 мл HNO3, равно:
| [.......10...........] |
| Вопрос №507 |
Значение рН титриметрической системы при титровании 100 мл раствора KOH (А) с С = 0,4 моль/л раствором HCl (В) с такой же концентрацией, когда прибавлено 99 мл HCl, равно:
| [......11,5...11,7.........] |
| Вопрос №508 |
Значение рН титриметрической системы при титровании 100 мл раствора HNO3 (А) с С = 0,4 моль/л раствором NaOH (В) с такой же концентрацией, когда прибавлено 110 мл NaOH, равно:
| [.......10,5...10,7........] |
| Вопрос №509 |
Значение рН титриметрической системы при титровании 100 мл раствора HBr (А) с С = 0,1 моль/л раствором NaOH (В) с такой же концентрацией, когда прибавлено 100,1 мл NaOH, равно:
| [.........10.........] |
| Вопрос №510 |
Значение рН титриметрической системы при титровании 100 мл раствора HBr (А) с С = 0,1 моль/л раствором KOH (В) с такой же концентрацией, когда прибавлено 110,0 мл KOH, равно:
| [........12..........] |
| Вопрос №511 |
Значение рН титриметрической системы при титровании 100 мл раствора HI (А) с С = 0,1 моль/л раствором NaOH (В) с такой же концентрацией, когда прибавлено 110,0 мл NaOH, равно:
| [.........12.........] |
| Вопрос №512 |
Значение рН титриметрической системы при титровании 100 мл раствора NaOH (А) с С = 0,1 моль/л раствором HCl (В) с такой же концентрацией, когда прибавлено 99,9 мл HCl, равно:
| [..........10........] |
| Вопрос №513 |
Значение рН титриметрической системы при титровании 100 мл раствора KOH (А) с С = 0,1 моль/л раствором HСl (В) с такой же концентрацией, когда прибавлено 101,0 мл HCl, равно:
| [..........3........] |
| Вопрос №514 |
Значение рН титриметрической системы при титровании 100 мл раствора NaOH (А) с С = 0,1 моль/л раствором HCl (В) с такой же концентрацией, когда прибавлено 90 мл HCl, равно:
| [.........12.........] |
| Вопрос №515 |
Значение рН титриметрической системы при титровании 100 мл раствора HCl (А) с С = 0,1 моль/л раствором NaOH (В) с такой же концентрацией, когда прибавлен 101,0 мл NaOH, равно:
| [.........11.........] |
| Вопрос №516 |
Значение рН титриметрической системы при титровании 100 мл раствора HCl (А) с С = 0,1 моль/л раствором NaOH (В) с такой же концентрацией, когда прибавлено 99,0 мл NaOH, равно:
| [.........3.........] |
| Вопрос №517 |
Значение рН титриметрической системы при титровании 100 мл раствора KOH (А) с С = 0,1 моль/л раствором HNO3 (В) с такой же концентрацией, когда прибавлено 90,0 мл HNO3, равно:
| [.........12.........] |
| Вопрос №518 |
Объем 10% раствора гидроксида натрия (ρ = 1,05 г/мл) для приготовления 250 мл ≈ 0,1 н. раствора его равен (мл):
| [........9,5...9,6.......] |
| Вопрос №519 |
Рассчитайте теоретическую навеску KMnO4 (А) необходимую для приготовления 500 мл 0,1 н. раствора, который будет использоваться в окислительно-восстановительном титровании в кислой среде. Известно, что М (KMnO4)=158,03 г/моль.
| [........1,58..1,59........] |
| Вопрос №520 |
На титрование 10,00 мл 0,1000 н. раствора тетрабората натрия затрачено 8,00 мл раствора соляной кислоты Молярная концентрация эквивалента НCl (N) равна (моль/л)
| [.........0,125.........] |
| Вопрос №521 |
Навеску дихромата калия K2Cr2O7 (А) массой 5,0000 г растворили в мерной колбе вместимостью 1000 мл. Рассчитайте молярную концентрацию эквивалента (N) полученного раствора, если он будет использован как окислитель в кислой среде. Известно, что М (K2Cr2O7)=294 г/моль.
| [........0,101..0,103........] |
| Вопрос №522 |
Молярная концентрация тиосульфата натрия в растворе 1 М. Молярная концентрация эквивалента (N) тиосульфата натрия в этом же растворе равна
| a)p | 1 |
| b)p | 0,5 |
| c)p | 5 |
| d)p | 2 |
| Вопрос №523 |
Молярная концентрация серной кислоты в растворе равна 1 М. Молярная концентрация эквивалента (N) серной кислоты в этом же растворе равна
| [.........2.........] |
| Вопрос №524 |
1,5000 г дихромата калия растворили в мерной колбе вместимостью 500,0 мл. Титр полученного раствора равен (г/мл)
| a)p | 0,05000 |
| b)p | 0,3000 |
| c)p | 0,003000 |
| d)p | 0,03000 |
| Вопрос №525 |
Навеску сульфата железа (II) (А) массой 2,8000 г растворили в мерной колбе вместимостью 200 мл. Рассчитайте молярную концентрацию эквивалента (N) полученного раствора, если он будет использован как восстановитель в кислой среде. Известно, что М (FeSO4·7H2O)=278 г/моль.
| [.........0,05..0,06.......] |
| Вопрос №526 |
Молярная концентрация дихромата калия в растворе 1 М. Молярная концентрация эквивалента (N) дихромата калия в этом же растворе равна
| a)p | 6 |
| b)p | 2 |
| c)p | 5 |
| d)p | 1 |
| Вопрос №527 |
2,0000 г дихромата калия растворили в мерной колбе вместимостью 500,0 мл. Титр полученного раствора равен (г/мл)
| a)p | 0,4000 |
| b)p | 0,04000 |
| c)p | 0,05000 |
| d)p | 0,004000 |
| Вопрос №528 |
Рассчитайте теоретическую навеску KMnO4 (А) необходимую для приготовления 250 мл 0,05 н. раствора, который будет использоваться в окислительно-восстановительном титровании в кислой среде. Известно, что М (KMnO4)=158 г/моль.
| [........0,39..0,40........] |
| Вопрос №529 |
1,0000 г щавелевой кислоты растворили в мерной колбе вместимостью 100,0 мл. Титр полученного раствора равен:
| [........0,01......] |
| Вопрос №530 |
На титрование 10,00 мл 0,1000 н. раствора щавелевой кислоты затрачено 9,00 мл перманганата калия. Молярная концентрация эквивалента КМnО4 (N) равна (моль/л)
| a)p | 0,0111 |
| b)p | 0,1010 |
| c)p | 0,1001 |
| d)p | 0,1111 |
| e)p | 0,1101 |
| Вопрос №531 |
На титрование 10,00 мл 0,1000 н. раствора щавелевой кислоты затрачено 5,00 мл раствора гидроксида натрия. Молярная концентрация эквивалента NаОН (N) равна:
| [........0,2..........] |
| Вопрос №532 |
Навеску щавелевой кислоты H2C2O4·2H2O (А) массой 1,6000 г растворили в мерной колбе вместимостью 500 мл. Рассчитайте молярную концентрацию эквивалента (N) полученного раствора, если он будет использован как восстановитель в кислой среде. Известно, что М (H2C2O4·2H2O)=126 г/моль.
| [.....0,05...0,06..........] |
| Вопрос №533 |
Рассчитайте теоретическую навеску K2Cr2O7 (А) необходимую для приготовления 500 мл 0,05 н. раствора, который будет использоваться в окислительно-восстановительном титровании в кислой среде. Известно, что М (K2Cr2O7) = 294 г/моль.
| [........1,22...1,23.......] |
| Вопрос №534 |
1,0000 г тетрабората натрия растворили в мерной колбе вместимостью 200 мл. Титр полученного раствора равен (г/мл)
| [........0,005..........] |
| Вопрос №535 |
1,0000 г щавелевой кислоты растворили в мерной колбе вместимостью 200,0 мл. Титр полученного раствора равен (г/мл)
| a)p | 0,5000 |
| b)p | 0,05000 |
| c)p | 0,005000 |
| d)p | 0,01000 |
| e)p | 0,1000 |
| Вопрос №536 |
Объем 20% раствора соляной кислоты (ρ = 1,1 г/мл) для приготовления 200 мл ≈ 0,1 н. его равен (мл), если М(НСl) = 36,5 г/моль:
| [......3,3...3,4.........] |
| Вопрос №537 |
Объем 0,1000 н. раствора дихромата калия, затраченный на титрование 0,2780 г FeSO4.7H2O равен (Э(FeSO4.7H2O) =278 г/моль) (мл)
| a)p | 100,00 |
| b)p | 20,00 |
| c)p | 10,00 |
| d)p | 1,00 |
| Вопрос №538 |
Рассчитайте теоретическую навеску K2Cr2O7 (А) необходимую для приготовления 200 мл 0,1 н. раствора, который будет использоваться в окислительно-восстановительном титровании в кислой среде. Известно, что М (K2Cr2O7)=294,19 г/моль.
| [........0,98...0,99.......] |
| Вопрос №539 |
Молярная концентрация тетрабората натрия в растворе равна 1 М. Молярная концентрация эквивалента (N) тетрабората натрия в этом же растворе равна
| [.........2.........] |
| Вопрос №540 |
Навеску хлорида кальция растворили и довели до метки в мерной колбе вместимостью 250 мл, а 25,00 мл полученного раствора оттитровали 20,00 мл раствора комплексона III с Т (к.III/CaCl2) = 0,006000 г/мл. Рассчитайте массу хлорида кальция в анализируемом растворе.
| [........1,2..........] |
| Вопрос №541 |
Навеску бромида калия растворили в воде и довели до метки в мерной колбе вместимостью 250 мл, а 25,00 мл полученного раствора оттитровали 28,00 мл раствора AgNO3 с Т=0,01700 г/мл. Рассчитайте массу KBr (А) в анализируемом растворе. Известно, что М (KBr)=119,00 г/моль, а М (AgNO3)=170 г/моль.
| [........3,3...3,4.......] |
| Вопрос №542 |
Рассчитайте теоретическую навеску тиосульфата натрия Na2S2O3·5H2O(А) необходимую для приготовления 200 мл 0,1 н. раствора, который будет использоваться в иодиметрическом титровании. Известно, что М (Na2S2O3·5H2O) = 248 г/моль.
| [.........4,96.........] |
| Вопрос №543 |
На титрование 0,5000 г смеси карбоната и гидроксида натрия израсходовано 15,00 мл 0,1000 н. раствора HCl с индикатором фенолфталеином и 20,00 мл - с метиловым оранжевым. Массовая доля гидроксида натрия (М(NaOН) = 40 г/моль) в смеси равна:
| [........8..........] |
| Вопрос №544 |
Раствор серной кислоты с Т=0,009800 г/мл объемом 15,00 мл оттитровали 12,50 мл раствора NaOH (А). Рассчитайте молярную концентрацию эквивалента раствора NaOH. Известно, что М (H2SO4)=98,00 г/моль.
| [.........0,2400.........] |
| Вопрос №545 |
Навеску химически чистого K2Cr2O7(А) массой 0,08000 г растворили в воде. К полученному раствору прибавили серную кислоту, раствор йодида калия, а выделившийся йод оттитровали 17,00 мл раствора тиосульфата натрия Na2S2O3. Рассчитайте молярную концентрацию эквивалента (N) раствора тиосульфата натрия. Известно, что M (K2Cr2O7)=294 г/моль.
| [.......0,095..0,097.........] |
| Вопрос №546 |
К раствору соли олова (II) прибавили 30,00 мл 0,1000 н. раствора комплексона III, а на титрование избытка комплексона III затратили 17,00 мл 0,09000 н. раствора сульфата цинка. Рассчитайте массу олова (А) в анализируемом растворе. Известно, что М (Sn)=119 г/моль.
| [......0,087...0,088.......] |
| Вопрос №547 |
Навеску хлорида калия массой 0,06000 г растворили в воде. К полученному раствору прибавили 25,00 мл 0,1000 н. раствора нитрата серебра, а избыток AgNO3 оттитровали 15,50 мл раствора KNCS (К= 1,1000 к 0,1 н. раствору). Рассчитайте массовую долю в % хлорида калия (А) в образце. Известно, что М (КCl)=74,50 г/моль.
| [........98,7...98,8.......] |
| Вопрос №548 |
Для количественного определения нитрата серебра 20,00 мл его раствора оттитровали 15,25 мл раствора NH4NCS с Т = 0,01520 г/мл. Рассчитайте массу нитрата серебра (А) в анализируемом растворе. Известно, что М (AgNO3) = 170 г/моль, а М (NH4NCS) = 76 г/моль.
| [........0,51..0,52........] |
| Вопрос №549 |
Навеску сульфата магния массой 0,08000 г растворили в воде и оттитровали 12,00 мл раствора комплексона III с Т (к.III/MgSO4)=0,006000 г/мл. Рассчитайте массовую долю в % MgSO4 в образце.
| [.......90...........] |
| Вопрос №550 |
Навеску хлорида натрия (А) массой 1,7530 г растворили в воде и довели до метки в мерной колбе вместимостью 200 мл. Рассчитайте номинальную вместимость пипетки, которой следует отобрать номинальный объём приготовленного раствора, чтобы при титровании затратить приблизительно 15,00 мл 0,1000 н. раствора AgNO3. Известно, что М (NaCl)=58,44 г/моль.
| [.........10.........] |
| Вопрос №551 |
Навеску известняка массой 0,09000 г растворили в HCl. К полученному раствору прибавили избыток оксалата аммония (NH4)2C2O4, а образовавшийся осадок отфильтровали, промыли и растворили в серной кислоте. Весь полученный раствор оттитровали 15,00 мл 0,1100 н. раствора KMnO4. Рассчитайте массовую долю в % CaCO3 (А) в известняке. Известно, что М (CaCO3)=100 г/моль.
| [........91..92........] |
| Вопрос №552 |
На титрование раствора перманганата калия KMnO4(А) израсходовано 21,56 мл раствора щавелевой кислоты H2C2O4 с Т (H2C2O4/KMnO4)=0,003161 г/мл. Рассчитайте массу перманганата калия в граммах в анализируемом растворе.
| [........0,068..0,069........] |
| Вопрос №553 |
Навеску ацетата свинца массой 0,2000 г растворили в воде; к полученному раствору прибавили 20,00 мл раствора комплексона III (К=1,1000 к 0,1 н. раствору), а на титрование избытка комплексона III затратили 10,60 мл 0,1000 н. раствора ZnSO4. Рассчитайте массовую долю в % Pb(CH3COO)2 (А) в образце. Известно, что М ( Pb(CH3COO)2)=325 г/моль.
| [......92..93..........] |
| Вопрос №554 |
Навеску карбоната калия массой 0,05000 г растворили в воде; к полученному раствору прибавили 25,00 мл 0,05000 н. раствора сульфата магния, а на титрование избытка сульфата магния затратили 16,00 мл раствора комплексона III. 1,00 мл раствора сульфата магния эквивалентен 1,25 мл раствора комплексона III. Рассчитайте массовую долю в % К2CO3 (А) в образце. Известно, что М (К2CO3)=138 г/моль.
| [.........84,1...84,2......] |
| Вопрос №555 |
Навеску образца медного купороса массой 0,3800 г растворили в воде с добавлением серной кислоты. К полученному раствору прибавили раствор йодида калия, а выделившийся йод оттитровали 15,00 мл раствора тиосульфата натрия Na2S2O3 с К=1,010 к 0,1 н. раствору. Рассчитайте массовую долю в % CuSO4· 5H2O (А) в образце. Известно, что M (CuSO4·5H2O)=250 г/моль.
| [.....99,6...99,8..........] |
| Вопрос №556 |
Навеску образца медного купороса растворили и довели до метки в мерной колбе вместимостью 500 мл. К 20,00 мл полученного раствора прибавили серную кислоту, раствор йодида калия, а выделившийся йод оттитровали 19,00 мл раствора тиосульфата натрия с К=0,9890 к 0,1 н. раствору. Рассчитайте массу в граммах CuSO4·5H2O(А) в анализируемом растворе. Известно, что M (CuSO4·5H2O)=250 г/моль.
| [....11,7..11,8............] |
| Вопрос №557 |
Навеску сульфата меди (II) массой 0,2500 г растворили в воде и оттитровали 20,50 мл раствора комплексона III с Т (к.III/CuSO4·5H2O) = 0,01200 г/мл. Рассчитайте массовую долю в % CuSO4·5H2O в образце.
| [........98...99.......] |
| Вопрос №558 |
Раствор перманганата калия KMnO4 довели до метки в мерной колбе вместимостью 100 мл. К 10,00 мл полученного раствора прибавили серную кислоту и раствор йодида калия, а выделившийся йод оттитровали 13,50 мл раствора тиосульфата натрия Na2S2O3 с К=0,9995 к 0,1 н. раствору. Рассчитайте массу KMnO4 (А) в граммах в анализируемом растворе. Известно, что М (KMnO4)=158 г/моль.
| [.......0,42...0,43........] |
| Вопрос №559 |
К раствору соли никеля (II) прибавили 20,00 мл 0,09500 н. раствора комплексона III, а на титрование избытка комплексона III затратили 10,55 мл 0,1000 н. раствора сульфата магния. Рассчитайте массу никеля (А) в анализируемом растворе. Известно, что М (Ni) = 59 г/моль.
| [....0,024...0,025...........] |
| Вопрос №560 |
Навеску сплава серебра массой 3,6000 г растворили в кислоте и раствор довели до метки в мерной колбе вместимостью 1000 мл, а 15,00 мл полученного раствора оттитровали 20,00 мл раствора KNCS с Т=0,001940 г/мл. Рассчитайте массовую долю в % серебра (А) в сплаве. Известно, что М (Ag)=108 г/моль, а М (KNCS)=97 г/моль.
| [.......80...........] |
| Вопрос №561 |
Навеску бромида калия массой 0,3500 г растворили в воде. К полученному раствору прибавили 30,00 мл 0,1000 н. раствора нитрата серебра, а избыток AgNO3 оттитровали 5,00 мл раствора KNCS (К=0,9000 к 0,1 н. раствору). Рассчитайте массовую долю в % бромида калия (А) в образце. Известно, что М (KBr)=119,00 г/моль.
| [........86...87.......] |
| Вопрос №562 |
Навеску тиоцианата калия KNCS массой 4,5000 г растворили в воде и довели до метки в мерной колбе вместимостью 200 мл, а 10,00 мл полученного раствора оттитровали 15,00 мл раствора нитрата серебра (К= 1,2000 к 0,1 н. раствору). Рассчитайте массовую долю в % KNCS в образце. Известно, что М (KNCS)=97 г/моль.
| [.......77..78.........] |
| Вопрос №563 |
Навеску ацетата свинца массой 0,3000 г растворили в воде; к полученному раствору прибавили 30,00 мл 0,1000 н. раствора комплексона III, а на титрование избытка комплексона III затратили 12,00 мл 0,1000 н. раствора ZnSO4. Рассчитайте массовую долю в % Pb(CH3COO)2 (А) в образце. Известно, что М (Pb(CH3COO)2)=325,00 г/моль.
| [......97..98..........] |
| Вопрос №564 |
Раствор перманганата калия довели до метки в мерной колбе вместимостью 200 мл. К 20,00 мл полученного раствора прибавили серную кислоту и раствор йодида калия, а выделившийся йод оттитровали 15,45 мл раствора тиосульфата натрия (В) с Т (Na2S2O3·5H2O)=0,02480 г/мл. Рассчитайте массу KMnO4 (А) в граммах в анализируемом растворе. Известно, что М (KMnO4)=158 г/моль, а М (Na2S2O3·5H2O)=248 г/моль.
| [........0,48...0,50.......] |
| Вопрос №565 |
Навеску хлорида кадмия растворили и довели до метки в мерной колбе вместимостью 100 мл, а 20,00 мл полученного раствора оттитровали 25,00 мл раствора комплексона III с Т (к.III/CdCl2)=0,009000 г/мл. Рассчитайте массу хлорида кадмия в анализируемом растворе.
| [.......1,1..1,2.........] |
| Вопрос №566 |
Навеску йодида калия массой 0,1800 г растворили в воде. К полученному раствору прибавили 20,00 мл 0,1000 н. раствора нитрата серебра, а избыток AgNO3 оттитровали 11,50 мл 0,09000 н. раствора KNCS. Рассчитайте массовую долю в % KI (А) в образце. Известно, что М (KI)=166,00 г/моль.
| [.......88...89........] |
| Вопрос №567 |
Навеска х. ч. хлорида натрия (А) массой 1,7550 г помещена в мерную колбу и доведена водой до метки. Рассчитайте, какую реальную вместимость (номинальный объём) должна иметь мерная колба, чтобы на 10,00 мл полученного раствора было бы затрачено при титровании 15,00 мл 0,1000 н. раствора AgNO3? Известно, что М (NaCl)=58,5 г/моль.
| [......200............] |
| Вопрос №568 |
Раствор гидроксида натрия с концентрацией 0,1000 н. объемом 15,00 мл оттитровали 12,50 мл раствора серной кислоты. Рассчитайте титр раствора H2SO4 (А). Известно, что М (H2SO4)=98,00 г/моль.
| [.......0,058...0,0059........] |
| Вопрос №569 |
На титрование 10,00 мл раствора сульфата железа (II), отобранных из 100 мл исходного раствора, израсходовано 12,00 мл раствора K2Cr2O7 с Т (K2Cr2O7/FeSO4)=0,01519 г/мл. Рассчитайте массу сульфата железа (II)(А) в граммах в анализируемом растворе.
| [.........1,82..1,83.......] |
| Вопрос №570 |
На титрование 0,5000 г смеси карбоната и гидрокарбоната натрия израсходовано 5,00 мл 0,1000 н. раствора HCl с индикатором фенолфталеином и 20,00 мл - с метиловым оранжевым. Массовая доля карбоната натрия (М(Na2CO3) = 106 г/моль) в смеси равна:
| [........10...11.......] |
| Вопрос №571 |
Навеску сульфата железа (II) массой 0,2000 г растворили в воде и оттитровали 12,00 мл раствора комплексона III с Т (к.III/FeSO4·7H2O)=0,01400 г/мл. Рассчитайте массовую долю в % FeSO4·7H2O в образце.
| [........84..........] |
| Вопрос №572 |
Навеску известняка массой 0,07000 г растворили в HCl. К полученному раствору прибавили избыток оксалата аммония (NH4)2C2O4. Образовавшийся осадок отфильтровали, промыли и растворили в серной кислоте. Весь полученный раствор оттитровали 14,00 мл раствора KMnO4 с Т (KMnO4)=0,003160 г/мл. Рассчитайте массовую долю в % CaO (А) в известняке. Известно, что М (CaO)=56 г/моль; М(KMnO4) = 158 г/моль.
| [........5,6..........] |
| Вопрос №573 |
На титрование 0,5000 г смеси карбоната и гидрокарбоната натрия израсходовано 8,00 мл 0,1000 н. раствора HCl с индикатором фенолфталеином и 20,00 мл - с метиловым оранжевым. Массовая доля гидрокарбоната натрия (М(NaHCO3) = 84 г/моль) в смеси равна:
| [.........6,7...6,8......] |
| Вопрос №574 |
Навеску образца медного купороса растворили в воде и довели до метки в мерной колбе на 250 мл. К 15,00 мл полученного раствора прибавили серную кислоту и раствор йодида калия, а выделившийся йод оттитровали 16,25 мл 0,1000 н. раствора тиосульфата натрия Na2S2O3·5H2O. Рассчитайте массу в граммах CuSO4·5H2O (А) в анализируемом растворе. Известно, что M (CuSO4·5H2O)=250 г/моль.
| [.......6,77...6,78........] |
| Вопрос №575 |
К раствору соли хрома (III) прибавили 20,00 мл раствора комплексона III (К=0,9500 к 0,1 н. раствору), а на титрование избытка комплексона III затратили 8,50 мл 0,1000 н. раствора сульфата магния. Рассчитайте массу хрома (А) в анализируемом растворе. Известно, что М (Cr)=51,00 г/моль.
| [........0,026..0,027........] |
| Вопрос №576 |
На титрование 20,00 мл раствора оксалата натрия Na2C2O4 (А), отобранных из мерной колбы вместимостью 100 мл израсходовано 21,00 мл раствора KMnO4 с Т (KMnO4/Na2C2O4)=0,006540 г/мл. Рассчитайте массу оксалата натрия в граммах в анализируемом растворе.
| [.......0,68..0,69.........] |
| Вопрос №577 |
Навеску сульфата бария массой 0,1500 г растворили в 30,00 мл 0,05000 н. раствора комплексона Ш, а избыток комплексона Ш оттитровали 5,00 мл 0,04500 н. раствора сульфата магния. Рассчитайте массовую долю в % BaSO4 (А) в образце. Известно, что М (BaSO4)=233 г/моль.
| [.......99,0..99,1.........] |
| Вопрос №578 |
Навеску хлорида магния растворили и довели до метки в мерной колбе вместимостью 200 мл, а 10,00 мл полученного раствора оттитровали 11,25 мл раствора комплексона III с Т (к.III/MgCl2)=0,005000 г/мл. Рассчитайте массу хлорида магния в анализируемом растворе.
| [........1,1..1,2........] |
| Вопрос №579 |
Навеску карбоната натрия массой 0,04000 г растворили в воде; к полученному раствору прибавили 20,00 мл 0,05000 н. раствора сульфата магния, а на титрование избытка сульфата магния затратили 9,00 мл раствора комплексона III. 1,00 мл раствора сульфата магния эквивалентен 1,25 мл раствора комплексона III. Рассчитайте массовую долю в % Na2CO3 (А) в образце. Известно, что М (Na2CO3)=106 г/моль.
| [........84,80..........] |
| Вопрос №580 |
Навеску химически чистого K2Cr2O7 (А) массой 0,1000 г растворили в воде, к полученному раствору прибавили серную кислоту и раствор йодида калия, а выделившийся йод оттитровали 20,00 мл раствора тиосульфата натрия Na2S2O3. Рассчитайте молярную концентрацию эквивалента (N) раствора тиосульфата натрия. Известно, что M (K2Cr2O7)=294 г/моль.
| [.........0,1020.........] |
| Вопрос №581 |
На титрование 0,5000 г смеси карбоната и гидрокарбоната натрия израсходовано 8,00 мл 0,1000 н. раствора HCl с индикатором фенолфталеином и 20,00 мл - с метиловым оранжевым. Массовая доля карбоната натрия (М(Na2CO3) = 106 г/моль) в смеси равна:
| [.......16..17.........] |
| Вопрос № 582 |
Навеску х. ч. хлорида калия массой 0,7000 г растворили и довели до метки в мерной колбе вместимостью 200 мл, а 14,90 мл полученного раствора оттитровали 14,00 мл раствора нитрата серебра. Рассчитайте титр раствора AgNO3 (А). Известно, что М (AgNO3)=170 г/моль, а М (KCl)=74,5 г/моль.
| [.......0,008..0,009.........] |
| Вопрос №583 |
К раствору перманганата калия прибавили 20,00 мл 0,1000 н. раствора сульфата железа (II), а избыток FeSO4 оттитровали 8,00 мл 0,12500 н. раствора K2Cr2O7. Рассчитайте массу KMnO4 (А) в анализируемом растворе. Известно, что М (KMnO4)=158 г/моль.
| [.......0,031..0,032.........] |
| Вопрос №584 |
Навеску химически чистого K2Cr2O7 (А) массой 0,05000 г растворили в воде. К полученному раствору прибавили серную кислоту и раствор йодида калия, а выделившийся йод оттитровали 0,1000 н. раствором тиосульфата натрия Na2S2O3. Рассчитайте объём раствора тиосульфата натрия, пошедший на титрование. Известно, что M (K2Cr2O7)=294 г/моль.
| [.....10,2..10,3...........] |
| Вопрос №585 |
Навеску хлорида кобальта растворили и довели до метки в мерной колбе вместимостью 250 мл, а 20,00 мл полученного раствора оттитровали 10,5 мл раствора комплексона III с Т (к.III/CоCl2)=0,006400 г/мл. Рассчитайте массу хлорида кобальта в анализируемом растворе.
| [......0,8...0,9.........] |
| Вопрос №586 |
На титрование 0,5000 г смеси карбоната и гидроксида натрия израсходовано 18,00 мл 0,1000 н. раствора HCl с индикатором фенолфталеином и 20,00 мл - с метиловым оранжевым. Массовая доля карбоната натрия (М(Na2CO3) = 106 г/моль) в смеси равна:
| [......4..5..........] |
| Вопрос №587 |
Навеску сульфата железа (II) массой 1,5000 г растворили в воде и довели до метки в мерной колбе вместимостью 100 мл, а 15,00 мл полученного раствора оттитровали 12,75 мл раствора комплексона III с Т (к.III/FeSO4·7H2O)=0,01500 г/мл. Рассчитайте массовую долю в % FeSO4·7H2O в образце.
| [.......85...........] |
| Вопрос №588 |
Раствор хлорида железа (III) довели до метки в мерной колбе вместимостью 100 мл. К 15,00 мл полученного раствора прибавили серную кислоту и раствор йодида калия, а выделившийся йод оттитровали 14,52 мл 0,1 н. раствора тиосульфата натрия (К=0,9934 к 0,1 н. раствору). Рассчитайте массу FeCl3·6H2O (А) в граммах в анализируемом растворе. Известно, что М (FeCl3·6H2O)=270 г/моль.
| [........2,5..2,6........] |
| Вопрос №589 |
На титрование 0,5000 г смеси карбоната и гидрокарбоната натрия израсходовано 5,00 мл 0,1000 н. раствора HCl с индикатором фенолфталеином и 20,00 мл - с метиловым оранжевым. Массовая доля гидрокарбоната натрия (М(NaHCO3) = 84 г/моль) в смеси равна:
| [......16..17.........] |
| Вопрос №590 |
Навеску хлорида натрия растворили в воде и довели до метки в мерной колбе вместимостью 100 мл, а 10,00 мл полученного раствора оттитровали 14,00 мл раствора нитрата серебра с Т (AgNO3)=0,01700 г/мл. Рассчитайте массу NaCl (А) в анализируемом растворе. Известно, что М (NaCl)=58,5 г/моль, а М(AgNO3)= 170 г/моль.
| [......0,81...0,82.........] |
| Вопрос №591 |
Навеску нитрата свинца растворили и довели до метки в мерной колбе вместимостью 250 мл, а 25,00 мл полученного раствора оттитровали 22,00 мл раствора комплексона III с Т (к.III/Pb(NO3)2)=0,01600 г/мл. Рассчитайте массу нитрата свинца в анализируемом растворе.
| [......3,5...3,6.........] |
| Вопрос №592 |
Навеску бромида натрия растворили и довели до метки в мерной колбе вместимостью 250 мл, а 20,00 мл полученного раствора оттитровали 19,20 мл раствора нитрата серебра с Т (AgNO3/NaBr)=0,01056 г/мл. Рассчитайте массу бромида натрия (А) в анализируемом растворе.
| [......2,5..2,6..........] |
| Вопрос №593 |
Навеску сульфата марганца (II) массой 0,1400 г растворили в воде и оттитровали 17,00 мл раствора комплексона III с Т (к.III/MnSO4)=0,007700 г/мл. Рассчитайте массовую долю в % MnSO4 в образце.
| [......93..94..........] |
| Вопрос №594 |
К раствору соли железа (III) прибавили 20,00 мл 0,09000 н. раствора комплексона III, а на титрование избытка комплексона III затратили 11,50 мл 0,1000 н. раствора сульфата магния. Рассчитайте массу железа (А) в анализируемом растворе. Известно, что М (Fe)=56 г/моль.
| [.....0,018..0,019...........] |
| Вопрос №595 |
На титрование 0,5000 г смеси карбоната и гидроксида натрия израсходовано 8,00 мл 0,1000 н. раствора HCl с индикатором фенолфталеином и 10,00 мл - с метиловым оранжевым. Массовая доля карбоната натрия (М(Na2CO3) = 106 г/моль) в смеси равна:
| [......4..5..........] |
| Вопрос №596 |
К 20,00 мл раствора перманганата калия (А) прибавили серную кислоту и раствор иодида калия, а выделившийся йод оттитровали 18,00 мл 0,09900 н. раствора Na2S2O3. Рассчитайте массу в граммах KMnO4 в анализируемом растворе. Известно, что М (KMnO4)=158,00 г/моль.
| [........0,056..0,057........] |
| Вопрос №597 |
К раствору хлорида железа (III) прибавили серную кислоту и раствор йодида калия, а выделившийся йод оттитровали 15,00 мл раствора тиосульфата натрия с Т=0,01240 г/мл. Рассчитайте массу FeCl3·6H2O (А) в анализируемом растворе. Известно, что М (FeCl3·6H2O)=270,00 г/моль, а М (Na2S2O3·5H2O)=248 г/моль.
| [.......0,20..0,21.........] |
| Вопрос №598 |
Навеску соли алюминия массой 0,1000 г растворили в воде; к полученному раствору прибавили 25,00 мл 0,1000 н. раствора комплексона III, а на титрование избытка комплексона III затратили 14,80 мл 0,1000 н. раствора MgSO4. Рассчитайте массовую долю в % Al2(SO4)3 (А) в образце. Известно, что М (Al2(SO4)3)=342,15 г/моль.
| [........87...88.......] |
| Вопрос №599 |
На титрование 0,5000 г смеси карбоната и гидроксида натрия израсходовано 18,00 мл 0,1000 н. раствора HCl с индикатором фенолфталеином и 20,00 мл - с метиловым оранжевым. Массовая доля гидроксида натрия (М(NaOН) = 40 г/моль) в смеси равна:
| [......12...13.........] |
| Вопрос №600 |
На титрование 0,2000 г смеси карбоната и гидрокарбоната натрия израсходовано 5,00 мл 0,1000 н. раствора HCl с индикатором фенолфталеином и 20,00 мл - с метиловым оранжевым. Массовая доля гидрокарбоната натрия (М(NaHCO3) = 84 г/моль) в смеси равна:
| [......42...43.........] |
| Вопрос №601 |
На титрование 0,2000 г смеси карбоната и гидрокарбоната натрия израсходовано 8,00 мл 0,1000 н. раствора HCl с индикатором фенолфталеином и 20,00 мл - с метиловым оранжевым. Массовая доля гидрокарбоната натрия (М(NaHCO3) = 84 г/моль) в смеси равна:
| [.......16,8...........] |
| Вопрос №602 |
Навеску хлорида кальция растворили и довели до метки в мерной колбе вместимостью 200 мл, а 15,00 мл полученного раствора оттитровали 17,00 мл раствора комплексона III с Т (к.III/CaCl2)=0,006000 г/мл. Рассчитайте массу хлорида кальция в анализируемом растворе.
| [........1,3...1,4.......] |
| Вопрос №603 |
Навеску сульфата магния (А) массой 4,1000 г растворили и довели до метки в мерной колбе вместимостью 500 мл. Рассчитайте номинальную вместимость пипетки, которой следует отобрать номинальный объём приготовленного раствора, чтобы при титровании затратить приблизительно 20 мл 0,05000 н. раствора комплексона III. Известно, что М (MgSO4·7H2O)=246,48 г/моль.
| [.........15.........] |
| Вопрос №604 |
К 20,00 мл разбавленного раствора серной кислоты прибавили растворы KI и KIO3, а выделившийся йод оттитровали 19,5 мл 0,05000 н. раствора тиосульфата натрия. Рассчитайте титр раствора H2SO4 (А). Известно, что М (H2SO4)=98,08 г/моль.
| [..................] |
| Вопрос №605 |
Навеску хлорида железа (III) массой 4,65 г растворили и довели до метки в мерной колбе вместимостью 200 мл. К 20,00 мл полученного раствора прибавили серную кислоту и раствор йодида калия, а выделившийся йод оттитровали 18,00 мл 0,09500 н. раствора тиосульфата натрия Na2S2O3. Рассчитайте массовую долю в % FeCl3·6H2O (А) в анализируемом растворе. Известно, что М (FeCl3·6H2O)=270 г/моль.
| [..................] |
| Вопрос №606 |
Навеску хлорида цинка растворили и довели до метки в мерной колбе вместимостью 200 мл, а 15,00 мл полученного раствора оттитровали 10,00 мл раствора комплексона III с Т (к.III/ZnCl2)=0,006000 г/мл. Рассчитайте массу хлорида цинка в анализируемом растворе.
| [..................] |
| Вопрос №607 |
Навеску сульфата железа (II) массой 50,0000 г растворили и довели до метки в мерной колбе вместимостью 500 мл, а 10,00 мл полученного раствора оттитровали 13,00 мл 0,1000 н. раствора дихромата калия. Рассчитайте массовую долю в % FeSO4·7H2O (А) в образце. Известно, что М (FeSO4·7H2O)=278,00 г/моль.
| [..................] |
| Вопрос №608 |
Навеску образца медного купороса массой 0,3500 г растворили в воде с добавлением серной кислоты, к полученному раствору прибавили раствор йодида калия, а выделившийся йод оттитровали 12,75 мл раствора тиосульфата натрия с Т=0,02541 г/мл. Рассчитайте массовую долю в % CuSO4·5H2O (А) в образце. Известно, что M (CuSO4·5H2O)=250 г/моль, а М (Na2S2O3·5H2O)=248 г/моль.
| [..................] |
| Вопрос №609 |
Навеску нитрата свинца растворили в воде; к полученному раствору прибавили 20,00 мл раствора комплексона III, а на титрование избытка комплексона III затратили 11,50 мл 0,1000 н. раствора MgSO4. 1,00 мл раствора сульфата магния эквивалентен 1,25 мл раствора комплексона III. Рассчитайте массу Pb(NO3)2 (А) в анализируемом растворе. Известно, что М (Pb(NO3)2)=331 г/моль.
| [..................] |
| Вопрос №610 |
На титрование раствора оксалата натрия Na2C2O4(А) израсходовано 19,10 мл раствора KMnO4 с Т (KMnO4/Na2C2O4)=0,006700 г/мл. Рассчитайте массу оксалата натрия в граммах в анализируемом растворе.
| [..................] |
| Вопрос №611 |
К раствору хлорида аммония прибавили 25,00 мл 0,1800 н. раствора нитрата серебра, а избыток AgNO3 оттитровали 18,00 мл раствора NH4NCS с Т=0,01520 г/мл. Рассчитайте массу NH4Cl (А) в анализируемом растворе. Известно, что М (NH4Cl)=53,50 г/моль, а М (NH4NCS)=76 г/моль.
| [..................] |
| Вопрос №612 |
Раствор перманганата калия довели до метки водой в мерной колбе вместимостью 100 мл. К 15,00 мл полученного раствора прибавили серную кислоту и раствор йодида калия. Выделившийся йод оттитровали 16,70 мл раствора тиосульфата натрия с К= 1,1300 к 0,1 н. раствору. Рассчитайте массу KMnO4 (А) в граммах в анализируемом растворе. Известно, что М (KMnO4)=158 г/моль.
| [..................] |
| Вопрос №613 |
Навеску нитрата висмута (III) массой 0,1800 г растворили в воде; к полученному раствору прибавили 20,00 мл раствора комплексона III, а на титрование избытка комплексона III затратили 12,00 мл 0,1000 н. раствора MgSO4. 1,00 мл раствора сульфата магния эквивалентен 0,95 мл раствора комплексона III. Рассчитайте массовую долю в % Bi(NO3)3 (А) в образце. Известно, что М (Bi(NO3)3)=394,00 г/моль.
| [..................] |
| Вопрос №614 |
К раствору аммиака прибавили 25,00 мл 0,1000 н. раствора хлороводородной кислоты, а избыток кислоты оттитровали 12,50 мл раствора NaOH (К=0,9500 к 0,1 н. раствору). Рассчитайте массу NH3 (А) в анализируемом растворе. Известно, что М (NH3)=17,00 г/моль.
| [..................] |
| Вопрос №615 |
Навеску х.ч. NaCl массой 0,5850 г растворили и довели до метки в мерной колбе вместимостью 250 мл, а 25,00 мл полученного раствора оттитровали 0,05000 н. раствором AgNO3. Рассчитайте объём раствора AgNO3 (А), пошедший на титрование. Известно, что М (NaCl)=58,5 г/моль.
| [..................] |
| Вопрос №616 |
На титрование 15,00 мл раствора сульфата железа (II), отобранных из 100 мл исходного раствора, израсходовано 15,60 мл раствора KMnO4 с Т (KMnO4/FeSO4)=0,01600 г/мл. Рассчитайте массу сульфата железа (II) (А) в граммах в анализируемом растворе.
| [..................] |
| Вопрос №617 |
Навеску сульфата цинка массой 0,2000 г растворили в воде и оттитровали 20,00 мл раствора комплексона III с Т (к.III/ZnSO4)=0,008000 г/мл. Рассчитайте массовую долю в % ZnSO4 в образце.
| [..................] |
| Вопрос №618 |
К раствору соли кальция (А) прибавили 20,00 мл 0,1000 н. раствора комплексона III, а на титрование избытка комплексона III затратили 9,00 мл 0,1100 н. раствора сульфата магния. Рассчитайте массу кальция в анализируемом растворе. Известно, что М (Са)=40,00 г/моль.
| [..................] |
| Вопрос №619 |
На титрование 0,2500 г смеси карбоната и гидроксида натрия израсходовано 15,00 мл 0,1000 н. раствора HCl с индикатором фенолфталеином и 20,00 мл - с метиловым оранжевым. Массовая доля гидроксида натрия (М(NaOН) = 40 г/моль) в смеси равна:
| [..................] |
| Вопрос №620 |
Навеску сульфата цинка массой 0,2500 г растворили в воде и оттитровали 16,00 мл раствора комплексона III с Т (к.III/ZnSO4·7H2O)=0,01500 г/мл. Рассчитайте массовую долю в % ZnSO4·7H2O в образце.
| [..................] |
| Вопрос №621 |
Навеску ацетата свинца массой 12,0000 г растворили и довели до метки в мерной колбе вместимостью 1000 мл. К 20,00 мл полученного раствора прибавили растворы дихромата калия и ацетата натрия; выделившийся осадок отфильтровали, промыли и растворили в серной кислоте. Последний раствор оттитровали 18,00 мл 0,1000 н. раствора FeSO4. Рассчитайте массовую долю в % Pb(CH3COO)2 (А) в образце. Известно, что М (Pb(CH3COO)2)=325,30 г/моль.
| [..................] |
| Вопрос №622 |
На титрование раствора перманганата калия израсходовано 15,00 мл раствора щавелевой кислоты с Т (H2C2O4/KMnO4) = 0,003150 г/мл. Рассчитайте массу перманганата калия (А) в граммах в анализируемом растворе.
| [..................] |
| Вопрос №623 |
Навеску сульфата меди (II) массой 0,2000 г растворили в воде и оттитровали 15,00 мл раствора комплексона III с Т (к.III/CuSO4·5H2O)=0,01250 г/мл. Рассчитайте массовую долю в % CuSO4·5H2O в образце.
| [..................] |
| Вопрос №624 |
Навеску известняка массой 0,08500 г растворили в HCl. К полученному раствору прибавили избыток оксалата аммония (NH4)2C2O4. Образовавшийся осадок отфильтровали, промыли и растворили в серной кислоте. Весь полученный раствор оттитровали 15,60 мл 0,1030 н. раствора KMnO4. Рассчитайте массовую долю в % CaCO3 (А) в известняке. Известно, что М (CaCO3)=100 г/моль.
| [..................] |
| Вопрос № 625 |
К раствору хлорида бария прибавили растворы дихромата калия и ацетата натрия; выделившийся осадок отфильтровали, промыли и растворили в серной кислоте. Последний раствор оттитровали 22,65 мл 0,05000 н. раствора FeSO4. Рассчитайте массу хлорида бария (А) в анализируемом растворе. Известно, что М (BaCl2)=208,23 г/моль.
| [..................] |
| Вопрос №626 |
Навеска х. ч. Na2B4O7·10H2O (А) массой 6,3560 г помещена в мерную колбу и доведена водой до метки. Рассчитайте, какую реальную вместимость (номинальный объём) должна иметь мерная колба, чтобы на 15,00 мл полученного раствора было бы затрачено при титровании 20,00 мл 0,1000 н. раствора H2SO4? Известно, что М (Na2B4O7·10H2O)=381,37 г/моль.
| [..................] |
| Вопрос №627 |
Навеску хлорида кальция растворили и довели до метки в мерной колбе вместимостью 200 мл, а 10,00 мл полученного раствора оттитровали 9,00 мл раствора AgNO3 (К=1,1000 к 0,1 н. раствору). Рассчитайте массу хлорида кальция (А) в анализируемом растворе. Известно, что М (CaCl2)=111 г/моль.
| [..................] |
| Вопрос №628 |
К раствору соли алюминия прибавили 15,00 мл 0,1000 н. раствора комплексона III, а на титрование избытка комплексона III затратили 6,50 мл 0,09000 н. раствора сульфата магния. Рассчитайте массу алюминия (А) в анализируемом растворе. Известно, что М (Al)=27 г/моль.
| [..................] |
| Вопрос №629 |
Навеску ацетата ртути (II) массой 0,2000 г растворили в воде; к полученному раствору прибавили 25,00 мл 0,1000 н. раствора комплексона III, а на титрование избытка комплексона III затратили 13,50 мл 0,1000 н. раствора ZnSO4. Рассчитайте массовую долю в % Hg(CH3COO)2 (А) в образце. Известно, что М (Hg(CH3COO)2) = 319 г/моль.
| [..................] |
| Вопрос №630 |
К раствору хлорида алюминия прибавили 30,00 мл 0,09000 н. раствора комплексона Ш, а избыток комплексона Ш оттитровали 10,00 мл 0,1000 н. раствора сульфата магния. Рассчитайте массу AlCl3 (А) в анализируемом растворе. Известно, что М (AlCl3)=133 г/моль.
| [..................] |
| Вопрос №631 |
Навеску хлорида кобальта растворили и довели до метки в мерной колбе вместимостью 200 мл, а 10,00 мл полученного раствора оттитровали 11,50 мл раствора комплексона III с Т (к.III/CоCl2)=0,007500 г/мл. Рассчитайте массу хлорида кобальта в анализируемом растворе.
| [..................] |
| Вопрос №632 |
Навеску хлорида кальция массой 4,0000 г растворили в воде и довели до метки в мерной колбе вместимостью 500 мл. К 15,00 мл полученного раствора прибавили 25,00 мл 0,1000 н. раствора нитрата серебра, а избыток AgNO3 оттитровали 12,00 мл 0,09500 н. раствора KNCS. Рассчитайте массовую долю в % хлорида кальция (А) в образце. Известно, что М (CaCl2)=111 г/моль.
| [..................] |
| Вопрос №633 |
К раствору хлорида алюминия AlCl3 прибавили 25,00 мл 0,09800 н. раствора комплексона III, а на титрование избытка комплексона III затратили 16,50 мл 0,1000 н. раствора сульфата магния. Рассчитайте массу хлорида алюминия (А) в анализируемом растворе. Известно, что М (AlCl3)=133 г/моль.
| [..................] |
| Вопрос №634 |
Раствор хлорида железа (III) довели до метки в мерной колбе вместимостью 250 мл. К 20,00 мл полученного раствора прибавили серную кислоту и раствор йодида калия, а выделившийся йод оттитровали 19,20 мл раствора тиосульфата натрия (В) с Т (Na2S2O3·5H2O)=0,02480 г/мл. Рассчитайте массу FeCl3· 6H2O (А) в граммах в анализируемом растворе. Известно, что М (FeCl3·6H2O)=270 г/моль, а М (Na2S2O3·5H2O)=248 г/моль.
| [..................] |
| Вопрос №635 |
К раствору соли висмута (III) прибавили 25,00 мл 0,08500 н. раствора комплексона III, а на титрование избытка комплексона III затратили 11,50 мл 0,1000 н. раствора сульфата магния. Рассчитайте массу висмута (А) в анализируемом растворе. Известно, что М (Bi)=209 г/моль.
| [..................] |
| Вопрос №636 |
К раствору сульфата цинка прибавили 20,00 мл раствора комплексона III, а избыток комплексона III оттитровали 11,50 мл 0,05000 н. раствора сульфата магния. Известно, что 1,00 мл раствора MgSO4 эквивалентен 1,25 мл раствора комплексона III. Рассчитайте массу ZnSO4 в анализируемом растворе, если М (ZnSO4)=161,50 г/моль.
| [..................] |
| Вопрос №637 |
Навеску хлорида олова (II) массой 0,1000 г растворили в воде; к полученному раствору прибавили 30,00 мл 0,1100 н. раствора комплексона III, а на титрование избытка комплексона III затратили 24,00 мл 0,1000 н. раствора сульфата цинка. Рассчитайте массовую долю в % хлорида олова (А) в образце. Известно, что М (SnCl2) = 190 г/моль.
| [..................] |
| Вопрос №638 |
Значение коэффициента светопоглощения зависит:
| a)p | от концентрации раствора |
| b)p | от природы вещества |
| c)p | от интенсивности света |
| d)p | не зависит ни от чего |
| e)p | от толщины поглощающего слоя |
| Вопрос №639 |
Минимальная погрешность при измерении светопоглощения (А) наблюдается при А, равном:
| a)p | 1,0 |
| b)p | 0,01 |
| c)p | 0,8 |
| d)p | 0,12 |
| e)p | 0,434 |
| Вопрос №640 |
Расчетная формула, используемая при определении концентрации вещества с помощью фактора пересчета (F) в методе дифференциальной фотометрии:
| a)p | Сх = Ах * F – С0 |
| b)p | Сх = Ах * F/С0 |
| c)p | Сх = Ах * F + С0 |
| d)p | Сх = Ах + F * С0 |
| e)p | Сх = Ах * F * С0 |
| Вопрос №641 |
Метод дифференциальной фотометрии применяется для:
| a)p | анализа многокомпонентных систем |
| b)p | определения констант диссоциации слабых кислот и оснований |
| c)p | определения состава комплекса |
| d)p | проведения качественного анализа |
| e)p | анализа окрашенных растворов с большим содержанием вещества |
| Вопрос №642 |
Количественной характеристикой вещества в спектрофотометрии является:
| a)p | толщина поглощающего слоя |
| b)p | длина волны максимума светопоглощения |
| c)p | интенсивность падающего света |
| d)p | величина оптического светопоглощения |
| e)p | интенсивность прошедшего света |
| Вопрос №643 |
Оптимальный интервал значений величины светопоглощения (А) для фотометрических измерений:
| a)p | 0,01 – 2,0 |
| b)p | 0,12 – 1,0 |
| c)p | 1,0 – 2,0 |
| d)p | 0,4 – 1,2 |
| e)p | 0,01 – 1,0 |
| Вопрос №644 |
Ультрафиолетовой области спектра соответствует диапазон длин волн:
| a)p | 380 – 100000 нм |
| b)p | 100 – 750 нм |
| c)p | 100 – 380 нм |
| d)p | 380 – 750 нм |
| e)p | 750 – 100000 нм |
| Вопрос №645 |
Взаимосвязь между светопоглощением (А) и светопропусканием (Т):
| a)p | A = lgT |
| b)p | T = lgA |
| c)p | A = -lgT |
| d)p | T = 1/A |
| e)p | T = -lgA |
| Вопрос №646 |
Концентрация раствора при использовании удельного коэффициента поглощения выражается в:
| a)p | моль/л |
| b)p | г/100 г раствора |
| c)p | г/100 мл раствора |
| d)p | г/л |
| e)p | мг/мл |
| Вопрос №647 |
Фотоэлектроколориметрическим методом можно анализировать:
| a)p | коллоидные растворы |
| b)p | окрашенные растворы |
| c)p | эмульсии и суспензии |
| d)p | бесцветные растворы |
| e)p | аэрозоли |
| Вопрос №648 |
Вид градуировочного графика при соблюдении основного закона светопоглощения:

| a)p | b |
| b)p | d |
| c)p | c |
| d)p | a |
| e)p | e |
| Вопрос №649 |
Спектральной характеристикой вещества называется зависимость светопоглощения от:
| a)p | толщины слоя |
| b)p | длины волны света |
| c)p | концентрации |
| d)p | удельного коэффициента светопоглощения |
| e)p | молярного коэффициента светопоглощения |
| Вопрос №650 |
В фотометрическом титровании используется зависимость между:
| a)p | концентрацией и объемом титранта |
| b)p | светопоглощением и длиной волны |
| c)p | светопоглощением и объемом титранта |
| d)p | светопоглощением и концентрацией |
| e)p | длиной волны света и объемом титранта |
| Вопрос №651 |
Формула для расчета светопоглощения (Io-интенсивность падающего света; It-интенсивность прошедшего)
| a)p | Io/It |
| b)p | ln(Io/It) |
| c)p | It/Io |
| d)p | lg(Io/It ) |
| e)p | lg(It /Io) |
| Вопрос №652 |
Фотометрической реакцией называется реакция, при которой происходит:
| a)p | образование бесцветного малорастворимого соединения |
| b)p | растворение малорастворимого соединения |
| c)p | образование окрашенного растворимого соединения |
| d)p | образование малорастворимого соединения |
| e)p | образование газообразного соединения |
| Вопрос №653 |
Физический смысл удельного коэффициента светопоглощения - это поглощение раствора с толщиной слоя 1 см и концентрацией:
| a)p | 1 М |
| b)p | 1% |
| c)p | 1 н. |
| d)p | 1 г/л |
| e)p | 1 г/мл |
| Вопрос №654 |
Взаимосвязь между светопоглощением (А) и светопропусканием (Т):
| a)p | T = lgA |
| b)p | T = -lgA |
| c)p | T = 1/A |
| d)p | A = lgT |
| e)p | A = -lgT |
| Вопрос №655 |
Концентрация раствора при использовании в расчетах удельного коэффициента светопоглощения выражается в:
| a)p | моль/л |
| b)p | мг/мл |
| c)p | г/100 г раствора |
| d)p | г/л |
| e)p | г/100 мл раствора |
| Вопрос №656 |
Величина коэффициента светопоглощения зависит:
| a)p | не зависит ни от чего |
| b)p | от концентрации раствора |
| c)p | от природы вещества |
| d)p | от толщины поглощающего слоя |
| e)p | от интенсивности света |
| Вопрос №657 |
Толщина поглощающего слоя (l) кюветы в см, необходимая для получения светопоглощения 1,0 при фотометрировании 0,0002 М раствора цветного вещества, если e = 5.104, равна:
| a)p | 0,1 см |
| b)p | 5 см |
| c)p | 1 см |
| d)p | 2 см |
| e)p | 0,2 см |
| Вопрос №658 |
Фотоколориметрический метод анализа основан на явлении:
| a)p | преломление света |
| b)p | рассеяние света |
| c)p | поляризация молекул вещества |
| d)p | поглощение атомами вещества электромагнитного излучения |
| e)p | поглощение молекулами вещества электромагнитного излучения |
| Вопрос №659 |
ИК области спектра соответствует диапазон длин волн:
| a)p | 750-100000 нм |
| b)p | 100-750 нм |
| c)p | 100-380 нм |
| d)p | 380-750 нм |
| e)p | 380-100000 нм |
| Вопрос №660 |
Количественный анализ в фотометрических методах анализа основан на зависимости интенсивности светопоглощения от:
| a)p | интенсивности падающего света |
| b)p | природы вещества |
| c)p | количества поглощающих частиц |
| d)p | длины волны света |
| e)p | коэффициента светопоглощения |
| Вопрос №661 |
Видимой области спектра соответствует диапазон волн
| a)p | 750-100000 нм |
| b)p | 380-750 нм |
| c)p | 100-380 нм |
| d)p | 100-750 нм |
| e)p | 380-100000 нм |
| Вопрос №662 |
На молярный коэффициент светопоглощения влияют:
| a)p | концентрация вещества |
| b)p | длина волны света |
| c)p | толщина поглощающего слоя |
| d)p | величина оптического поглощения |
| e)p | никакие факторы не влияют |
| Вопрос №663 |
Формула основного закона светопоглощения Бугера-Ламберта-Бера:
| a)p | lgIt -lgIo = εCl |
| b)p | It /Io = 10 εCl |
| c)p | lgIo -lgIt = εCl |
| d)p | lgIo /It = 10 - εCl |
| e)p | lgIo -lgIt = 10 εCl |
| Вопрос №664 |
Концентрация раствора при использовании в расчетах молярного коэффициента светопоглощения выражается в:
| a)p | г/100 г раствора |
| b)p | г/л |
| c)p | мг/мл |
| d)p | моль-экв/л |
| e)p | моль/л |
| Вопрос №665 |
Фотоэлектроколориметрическим методом можно анализировать:
| a)p | окрашенные растворы |
| b)p | эмульсии и суспензии |
| c)p | аэрозоли |
| d)p | бесцветные растворы |
| e)p | коллоидные растворы |
| Вопрос №666 |
Качественной характеристикой вещества в спектрофотометрии является:
| a)p | длина волны максимума светопоглощения |
| b)p | интенсивность падающего света |
| c)p | толщина поглощающего слоя |
| d)p | интенсивность прошедшего света |
| e)p | величина оптического светопоглощения |
| Вопрос №667 |
Уравнение для расчета светопропускания:
| a)p | T=lg(Io /It) |
| b)p | T=Io /It |
| c)p | Т=It /Io |
| d)p | T=lg(It /Io) |
| e)p | T=It.e-kc |
| Вопрос №668 |
Области оптического диапазона, в которых применим метод спектрофотометрии:
| a)p | Ультрафиолетовая; видимая |
| b)p | Инфракрасная; видимая |
| c)p | Ультрафиолетовая; инфракрасная |
| d)p | Ультрафиолетовая; видимая; инфракрасная |
| e)p | Видимая |
| Вопрос №669 |
Концентрация анализируемого раствора при использовании метода одного стандарта равна:
| a)p | С = (Аст /Ах)*Сст |
| b)p | С = Аст*(Сст /Ах) |
| c)p | С = (Ах /Ех)*l |
| d)p | С = (Ах /Aст)*l |
| e)p | С = (Ах /Аст)*Сст |
| Вопрос №670 |
Минимальная определяемая концентрация вещества методом классической полярографии составляет (моль/л):
| a)p | 10-4 |
| b)p | 10-3 |
| c)p | 10-5 |
| d)p | 10-8 |
| e)p | 10-7 |
| Вопрос №671 |
Для амперометрического титрования можно использовать электрод:
| a)p | стеклянный |
| b)p | донную ртуть |
| c)p | водородный |
| d)p | ионселективный |
| e)p | платиновый |
| Вопрос №672 |
Одновременное определение двух веществ методом переменнотоковой полярографии возможно при разности Ер этих веществ не менее:
| a)p | 0,3 В |
| b)p | 0,4 В |
| c)p | 0,04 В |
| d)p | 0,1 В |
| e)p | 0,2 В |
| Вопрос №673 |
Вид кривой амперометрического титрования, если в электродную реакцию вступает продукт реакции:

| a)p | D |
| b)p | A |
| c)p | E |
| d)p | B |
| e)p | C |
| Вопрос №674 |
Вид кривой амперометрического титрования, если в электродную реакцию вступает определяемое вещество и титрант:

| a)p | C |
| b)p | D |
| c)p | B |
| d)p | A |
| e)p | E |
| Вопрос №675 |
Количественной характеристикой в полярографии является
| a)p | Количество электричества |
| b)p | Потенциал пика |
| c)p | Время накопления |
| d)p | Потенциал полуволны |
| e)p | Сила диффузионного тока |
| Вопрос №676 |
Инверсионную вольтамперометрию применяют для определения:
| a)p | больших концентраций ионов |
| b)p | органических соединений |
| c)p | трудновосстанавливающихся ионов |
| d)p | ионов с переменной степенью окисления |
| e)p | малых концентраций обратимо восстанавливающихся ионов |
| Вопрос №677 |
Уравнение полярографической волны:
| a)p | E = E1/2 - RT/nF . ln(Id -I)/I |
| b)p | E = E1/2 + RT/nF . lg(Id -I)/I |
| c)p | E = E1/2 + RT/nF . lnI/(Id -I) |
| d)p | E = E1/2 + RT/nF . ln(Id -I)/I |
| e)p | E = Eo + RT/nF . ln(Id -I)/I |
| Вопрос №678 |
На величину предельного диффузионного тока в полярографии не влияет:
| a)p | природа фонового электролита |
| b)p | площадь электрода |
| c)p | температура |
| d)p | концентрация вещества |
| e)p | потенциал электрода |
| Вопрос №679 |
Вид кривой амперометрического титрования, если в электродную реакцию вступает титрант:

| a)p | B |
| b)p | C |
| c)p | E |
| d)p | A |
| e)p | D |
| Вопрос №680 |
Одновременное определение двух веществ методом классической полярографии возможно при разности Е1/2 этих веществ не менее:
| a)p | 0,04 В |
| b)p | 0,3 В |
| c)p | 0,4 В |
| d)p | 0,2 В |
| e)p | 0,1 В |
| Вопрос №681 |
Потенциал индикаторного электрода при амперометрическом титровании должен быть:
| a)p | меньше Е1/2 |
| b)p | равен Е1/2 |
| c)p | больше Е1/2 |
| d)p | значительно меньше Е1/2 |
| e)p | любым |
| Вопрос №682 |
Качественной характеристикой в полярографии является
| a)p | Время накопления |
| b)p | Потенциал полуволны |
| c)p | Потенциал накопления |
| d)p | Количество электричества |
| e)p | Сила диффузионного тока |
| Вопрос №683 |
Вид кривой амперометрического титрования смеси двух веществ:

| a)p | A |
| b)p | Е |
| c)p | C |
| d)p | D |
| e)p | B |
| Вопрос №684 |
Вид кривой амперометрического титрования, если в электродную реакцию вступает определяемое вещество:

| a)p | B |
| b)p | A |
| c)p | E |
| d)p | D |
| e)p | C |
| Вопрос №685 |
Коэффициент диффузии (D) входит в уравнение Ильковича в степени:
| a)p | 2 |
| b)p | 2/3 |
| c)p | 1/2 |
| d)p | 1/6 |
| e)p | 1/3 |
| Вопрос №686 |
Измеряемым параметром в полярографии является:
| a)p | потенциал |
| b)p | электропроводимость |
| c)p | количество электричества |
| d)p | сопротивление раствора |
| e)p | сила тока |
| Вопрос №687 |
В полярографии не используется следующий метод определения концентрации веществ:
| a)p | расчет по уравнению Ильковича |
| b)p | градуировочного графика |
| c)p | отношения площадей пиков |
| d)p | стандартных растворов |
| e)p | добавок |
| Вопрос №688 |
На величину потенциала полуволны не влияет:
| a)p | природа фонового электролита |
| b)p | концентрация комплексообразователя |
| c)p | концентрация вещества |
| d)p | природа вещества |
| e)p | рН раствора |
| Вопрос №689 |
Координаты кривой амперометрического титрования:
| a)p | I = f(V) |
| b)p | E = f(I) |
| c)p | I = f(E) |
| d)p | E = f(V) |
| e)p | I = f(R) |
| Вопрос №690 |
Генераторным электродом в кулонометрическом титровании кислот является:
| a)p | платиновый анод |
| b)p | каломельный электрод |
| c)p | платиновый катод |
| d)p | графитовый анод |
| e)p | графитовый катод |
| Вопрос №691 |
Генераторным электродом в кулонометрическом титровании тиосульфата натрия является:
| a)p | платиновый катод |
| b)p | платиновый анод |
| c)p | каломельный электрод |
| d)p | графитовый катод |
| e)p | графитовый анод |
| Вопрос №692 |
Количество электричества при постоянной силе тока рассчитывают по формуле:
| a)p | Q = 10-It |
| b)p | Q = lgI . t |
| c)p | Q = I . t |
| d)p | Q = I/t |
| e)p | Q = t/I |
| Вопрос №693 |
В основе кулонометрии лежат законы:
| a)p | Ома |
| b)p | Ампера |
| c)p | Кулона |
| d)p | Фарадея |
| e)p | Вольта |
| Вопрос №694 |
Индикатором при кулонометрическом титровании кислот служит:
| a)p | метиловый оранжевый |
| b)p | фенолфталеин |
| c)p | мурексид |
| d)p | крахмал |
| e)p | дифениламин |
| Вопрос №695 |
Измеряемым параметром в кулонометрии является:
| a)p | потенциал |
| b)p | сопротивление раствора |
| c)p | количество электричества |
| d)p | электропроводимость |
| e)p | сила тока |
| Вопрос № 696 |
Индикатором при кулонометрическом титровании тиосульфата натрия служит:
| a)p | метиловый оранжевый |
| b)p | дифениламин |
| c)p | фенолфталеин |
| d)p | крахмал |
| e)p | мурексид |
| Вопрос №697 |
Скорость кулонометрического титрования можно изменять изменением:
| a)p | потенциала генераторного электрода |
| b)p | потенциала вспомогательного электрода |
| c)p | времени генерирования титранта |
| d)p | силы генераторного тока |
| e)p | скорости перемешивания раствора |
| Вопрос №698 |
Выражение объединенного закона Фарадея:
| a)p | m=nF/QM |
| b)p | m=QM/nF |
| c)p | m=QF/nM |
| d)p | m=MF/nQ |
| e)p | m=Qn/MF |
| Вопрос №699 |
В кулонометрическом титровании вместо объема титранта используется:
| a)p | скорость перемешивания раствора |
| b)p | потенциал генераторного электрода |
| c)p | время генерирования титранта |
| d)p | потенциал вспомогательного электрода |
| e)p | сила тока |
| Вопрос №700 |
Стеклянный электрод можно применять в потенциометрическом титровании при использовании реакций:
| a)p | комлексообразования |
| b)p | осаждения |
| c)p | кислотно-основных |
| d)p | окислительно-восстановительных |
| Вопрос №701 |
Серебряный электрод – это электрод:
| a)p | первого рода |
| b)p | третьего рода |
| c)p | мембранный |
| d)p | второго рода |
| Вопрос №702 |
Каломельный электрод – это электрод:
| a)p | мембранный |
| b)p | первого рода |
| c)p | третьего рода |
| d)p | второго рода |
| Вопрос №703 |
Вид дифференциальной кривой титрования, соответствующей титрованию смеси хлорида натрия и хлорида калия раствором нитрата серебра:

| a)p | B |
| b)p | C |
| c)p | D |
| d)p | A |
| Вопрос №704 |
К мембранным электродам относится:
| a)p | стеклянный |
| b)p | хлоридсеребряный |
| c)p | платиновый |
| d)p | водородный |
| Вопрос №705 |
Условие подготовки стеклянного электрода к работе:
| a)p | электрод выдерживают в разбавленной (0,1 н.) кислоте |
| b)p | электрод предварительно не подготавливают |
| c)p | электрод выдерживают в концентрированном растворе щелочи |
| d)p | электрод выдерживают в воде |
| Вопрос №706 |
К электродам второго рода относятся:
| a)p | платиновый, серебряный |
| b)p | медный, хингидронный |
| c)p | стеклянный, водородный |
| d)p | каломельный, хлоридсеребряный |
| Вопрос №707 |
Вид дифференциальной кривой титрования лимонной кислоты, имеющей К1 = 7,4.10-4 , К2 = 2,2.10-5 , К3 = 4,0.10-7:

| a)p | C |
| b)p | D |
| c)p | A |
| d)p | B |
| Вопрос №708 |
При потенциометрическом определении веществ точку эквивалентности устанавливают по дифференциальной, а не по интегральной кривой титрования потому, что:
| a)p | дифференциальная кривая позволяет более точно установить точку эквивалентности |
| b)p | преимуществ в установлении точки эквивалентности нет |
| c)p | предпочтение определяется выбором систем электродов |
| d)p | интегральную кривую титрования можно построить только для титрования сильных электролитов |
| Вопрос №709 |
Вид потенциометрической дифференциальной кривой титрования раствора карбоната натрия соляной кислотой
(КВ(СО32-) = 10-3, KB(HCO3-) = 10-7):

| a)p | B |
| b)p | A |
| c)p | C |
| d)p | D |
| Вопрос №710 |
В наибольшей степени потенциал каломельного электрода зависит от:
| a)p | концентрации хлорид-ионов |
| b)p | типа растворителя |
| c)p | температуры |
| d)p | концентрации ионов ртути |
| Вопрос №711 |
В качестве индикаторного при потенциометрическом определении железа (II) можно использовать электрод:
| a)p | стеклянный |
| b)p | серебряный |
| c)p | каломельный |
| d)p | платиновый |
| Вопрос №712 |
Хлоридсеребряный электрод – это электрод:
| a)p | первого рода |
| b)p | третьего рода |
| c)p | мембранный |
| d)p | второго рода |
| Вопрос №713 |
Вид интегральной кривой титрования уксусной кислоты гидроксидом натрия (Ка(СН3СООН) = 1,74.10-5):

| a)p | В |
| b)p | А |
| c)p | С |
| d)p | D |
| Вопрос №714 |
Роль “грубого” титрования в методе потенциометрического титрования:
| a)p | построение интегральной кривой титрования |
| b)p | определение приблизительного содержания вещества в растворе |
| c)p | проверка правильности показаний прибора |
| d)p | установление интервала объема титранта, в котором находится точка эквивалентности |
| Вопрос №715 |
Стеклянный электрод – это электрод:
| a)p | мембранный |
| b)p | второго рода |
| c)p | третьего рода |
| d)p | первого рода |
| Вопрос №716 |
Для какого электрода уравнение Нернста можно записать в виде: Е = Ео + 0,059 lg aН+
| a)p | хлоридсеребряный |
| b)p | стеклянный |
| c)p | каломельный |
| d)p | серебряный |
| Вопрос №717 |
Вид дифференциальной кривой титрования смеси иодида калия и хлорида калия нитратом серебра:

| a)p | C |
| b)p | A |
| c)p | D |
| d)p | B |
| Вопрос №718 |
Электроды I рода – это:
| a)p | металлическая пластинка, опущенная в раствор соли |
| b)p | металл в равновесии с раствором двух малорастворимых солей с одноименным ионом |
| c)p | металл в равновесии с насыщенным раствором малорастворимой соли |
| d)p | металл в равновесии с одноименными ионами |
| Вопрос №719 |
Осадки в хроматографической колонке при анализе смеси ионов Cl-, Br-, I- методом осадочной хроматографии распределятся (сверху вниз), если РAgI < PAgBr <PAgCl:
| a)p | AgI, AgBr, AgCl |
| b)p | AgBr, AgI, AgCl |
| c)p | AgCl, AgI, AgBr |
| d)p | AgBr, AgCl, AgI |
| e)p | AgI, AgCl, AgBr |
| Вопрос №720 |
Путь, пройденный веществом А, равен 4 см, растворителем - 8 см, а веществом-стандартом - 3,8 см. Значение Rf вещества А равно:
| a)p | 0,475 |
| b)p | 1,05 |
| c)p | 0,95 |
| d)p | 2,0 |
| e)p | 0,5 |
| Вопрос №721 |
Адсорбция - это процесс:
| a)p | разрыва связи между веществом и поверхностью сорбента |
| b)p | взаимодействия вещества с поверхностью твердой фазы |
| c)p | растворения вещества |
| d)p | поглощение вещества раствором |
| e)p | поглощение вещества жидкостью |
| Вопрос №722 |
Вещества А, В и С распределены на хроматограмме следующим образом:

Наибольший коэффициент распределения имеет вещество:
| a)p | “С” |
| b)p | концентрация всех веществ одинакова |
| c)p | “А” |
| d)p | “В” |
| Вопрос №723 |
Элюент - это:
| a)p | анализируемая смесь веществ |
| b)p | вымывающий растворитель |
| c)p | часть неподвижной фазы |
| d)p | часть подвижной фазы, содержащая индивидуальное вещество |
| e)p | смесь растворителей |
| Вопрос №724 |
Элюат - это:
| a)p | анализируемая смесь веществ |
| b)p | часть подвижной фазы, содержащая индивидуальное вещество |
| c)p | подвижный растворитель |
| d)p | смесь растворителей |
| e)p | вымывающее вещество |
| Вопрос №725 |
При проведении распределительной хроматографии величины коэффициентов распределения (К) веществ А, В и С имеют следующее соотношение: КВ > KA > KC. Наименьшую скорость движения имеет вещество:
| a)p | “В” |
| b)p | “С” |
| c)p | скорость одинаковая |
| d)p | “А” |
| Вопрос №726 |
Непромытая хроматограмма - это:
| a)p | пластинка, подготовленная для нанесения анализируемых веществ |
| b)p | пластинка с нанесенными растворами “свидетелей” |
| c)p | хроматограмма, обработанная раствором проявляющего вещества |
| d)p | хроматограмма, обработанная растворителем, являющимся подвижной фазой |
| e)p | исходная хроматограмма |
| Вопрос №727 |
На величину Rf не влияет:
| a)p | активность сорбента |
| b)p | длина пробега подвижного растворителя |
| c)p | химическая природа подвижного растворителя |
| d)p | температура |
| e)p | химическая природа анализируемого вещества |
| Вопрос № 728 |
Распределительная хроматография основана на:
| a)p | различной адсорбционной способности веществ |
| b)p | различной адсорбции веществ |
| c)p | различной растворимости в несмешивающихся жидкостях |
| d)p | одинаковой адсорбционной способности веществ |
| e)p | одинаковой растворимости веществ |
| Вопрос №729 |
Промытая хроматограмма - это:
| a)p | пластинка с нанесенными растворами “свидетелей” |
| b)p | хроматограмма, обработанная раствором проявляющего вещества |
| c)p | пластинка, подготовленная для нанесения анализируемых веществ |
| d)p | хроматограмма, обработанная растворителем, являющимся подвижной фазой |
| e)p | исходная хроматограмма |
| Вопрос №730 |
Разделение компонентов в адсорбционной хроматографии происходит из-за:
| a)p | разной скорости движения вдоль слоя сорбента |
| b)p | разной концентрации в слое сорбента |
| c)p | различного сродства к сорбенту |
| d)p | разной концентрации в подвижной фазе |
| e)p | всего перечисленного |
| Вопрос №731 |
Формула для расчета коэффициента распределения К:
| a)p | К = Сн.Сп |
| b)p | К = 1/Сн |
| c)p | К = Сн/Сп |
| d)p | К = 1/Сп |
| e)p | К = Сп/Сн |
| Вопрос №732 |
Элюирование – это процесс:
| a)p | экстрагирования анализируемого вещества из раствора |
| b)p | взаимодействия анализируемого вещества с ионитом |
| c)p | последовательного вымывания веществ растворителем, являющимся подвижной фазой |
| Вопрос №733 |
Тонкослойная хроматография относится к:
| a)p | распределительной хроматографии |
| b)p | ситовой хроматографии |
| c)p | окислительно-восстановительной хроматографии |
| d)p | адсорбционной хроматографии |
| e)p | ионообменной хроматографии |
| Вопрос №734 |
Для идентификации веществ в тонкослойной хроматографии предпочтительнее использовать:
| a)p | l растворителя |
| b)p | Rs |
| c)p | l стандарта |
| d)p | l вещества |
| e)p | Rf |
| Вопрос №735 |
Бумажная хроматография относится к:
| a)p | распределительной хроматографии |
| b)p | окислительно-восстановительной хроматографии |
| c)p | ионообменной хроматографии |
| d)p | ситовой хроматографии |
| e)p | адсорбционной хроматографии |
| Вопрос №736 |
Адсорбционная хроматография основана на:
| a)p | одинаковой растворимости веществ |
| b)p | различной растворимости в несмешивающихся жидкостях |
| c)p | одинаковой адсорбции веществ |
| d)p | различной адсорбции веществ |
| e)p | различной летучести веществ |
| Вопрос №737 |
В процессе хроматографического разделения обязательно наличие:
| a)p | только неподвижной фазы |
| b)p | только адсорбента |
| c)p | сорбента и адсорбента |
| d)p | только подвижной фазы |
| e)p | подвижной и неподвижной фазы |
| Вопрос №738 |
Если разделение веществ основано на различии коэффициента распределения компонентов между двумя несмешивающимися жидкостями, то это:
| a)p | ситовая хроматография |
| b)p | ионообменная хроматография |
| c)p | распределительная хроматография |
| d)p | осадочная хроматография |
| e)p | адсорбционная хроматография |
| Вопрос №739 |
Константы ионного обмена Mn2+, Co2+ и Ni2+ равны соответственно 0,62; 1,06; 2,16. Наиболее эффективно будут разделяться ионы:
| a)p | Co2+ и Ni2+ |
| b)p | Mn2+ и Ni2+ |
| c)p | Mn2+ и Co2+ |
| d)p | разделение не произойдёт |
| Вопрос №740 |
Ионообменник, содержащий группу - SO3H является:
| a)p | амфолитом |
| b)p | катионитом |
| c)p | анионитом |
| Вопрос №741 |
Укажите соль, анализ которой проводят по схеме:
NaOH
|
HR + KtAn = HAn + KtR
| a)p | Cu(NO3)2 |
| b)p | Сu(HCOO)2 |
| c)p | Сu(CH3COO)2 |
| d)p | Cu(NO2)2 |
| Вопрос №742 |
Константа ионного обмена (К0) равновесия 3HR + Al3+ = AlR3 + 3H+ характеризуется уравнением:
| a)p | К0 = a2H+ . aAlR3 /aAl3+ . a2HR |
| b)p | К0 = a3H+. aAlR3 / aAl3+ . a3HR |
| c)p | К0 = aH+.aAlR3/aAl3+ .aHR |
| d)p | К0 = aAl3+ .a2HR/a3H+. aAlR3 |
| Вопрос №743 |
Ионообменник, содержащий группу – NR3 H, является:
| a)p | амфолитом |
| b)p | анионитом |
| c)p | катионитом |
| Вопрос №744 |
Обменная ёмкость ионообменной смолы – это:
| a)p | количество молей иона на 1000 г смолы |
| b)p | количество молей эквивалентов иона на 1 г смолы |
| c)p | количество молей эквивалентов иона на 100 г смолы |
| d)p | количество молей иона на 1 г смолы |
| e)p | число г иона на 1 г смолы |
| Вопрос №745 |
Анионит, обладающий сильноосновными свойствами, содержит функциональную группу:
| a)p | - N(CH3)2H+ |
| b)p | – NH3+ |
| c)p | ≡N |
| d)p | = NH |
| e)p | - N(CH3)3+ |
| Вопрос №746 |
Сродство ионов к ионобменной смоле в ряду Na+ Сa2+ Al3+ Th4+:
| a)p | увеличивается |
| b)p | вначале увеличивается, потом уменьшается. |
| c)p | не изменяется |
| d)p | уменьшается |
| Вопрос № 747 |
Катионит, обладающий сильнокислотными свойствами, содержит функциональную группу:
| a)p | – N(CH2CO2)– |
| b)p | -SO3- |
| c)p | – COO– |
| d)p | _ PO3- |
| Вопрос №748 |
При элюентном вытеснении смеси ионов K+ Al3+ Ce4+ Ba2+ из ионообменной колонки первым вытесняется ион:
| a)p | Ba2+ |
| b)p | Ce4+ |
| c)p | Al3+ |
| d)p | вытесняются все одновременно. |
| e)p | K+ |
| Вопрос №749 |
Укажите соль, анализ которой проводят по схеме:
HCl
↓
ROH + KtAn = KtOH + RAn
| a)p | NaNO2 |
| b)p | Zn(NO2)2 |
| c)p | Al(NO2)3 |
| d)p | Cu(NO2)2 |
| e)p | Mn(NO2)2 |
| Вопрос №750 |
Ионообменная хроматография основана на реакции:
| a)p | окисления- восстановления |
| b)p | обмена |
| c)p | нейтрализации |
| d)p | соединения |
| e)p | осаждения |
| Вопрос №751 |
Чем больше значение коэффициента распределения, тем:
| a)p | медленнее вещество выходит из колонки |
| b)p | коэффициент распределения не влияет на скорость выхода вещества из колонки в ГЖХ |
| c)p | быстрее вещество выходит из колонки |
| Вопрос №752 |
Неподвижная жидкая фаза, используемая в ГЖХ, должна быть:
| a)p | достаточно селективной |
| b)p | иметь небольшую вязкость |
| c)p | все перечисленное |
| d)p | нелетучей |
| e)p | термически устойчивой |
| Вопрос №753 |
Зависимость площади хроматографического пика от концентрации вещества:
| a)p | обратно пропорциональна |
| b)p | прямо пропорциональна |
| c)p | нет зависимости |
| Вопрос №754 |
В газо-жидкостной хроматографии применяют газ-носитель:
| a)p | озон |
| b)p | кислород |
| c)p | азот |
| d)p | хлор |
| e)p | аммиак |
| Вопрос № 755 |
Основными характеристиками хроматограммы являются:
| a)p | m1/2 - ширина на половине высоты |
| b)p | t – время удерживания |
| c)p | h – высота пика |
| d)p | площадь пика |
| e)p | все перечисленное |
| Вопрос №756 |
Количественный анализ в ГЖХ проводят по:
| a)p | числу теоретических тарелок |
| b)p | ВЭТТ |
| c)p | времени удерживания |
| d)p | коэффициенту разделения |
| e)p | площади пика |
| Вопрос №757 |
По механизму разделения газо-жидкостную хроматографию относят к:
| a)p | ионообменной |
| b)p | гель-хроматографии |
| c)p | адсорбционной |
| d)p | распределительной |
| Вопрос №758 |
Уравнение Ван-Деемтера имеет вид:
| a)p | ВЭТТ = А + В/U + СU |
| b)p | ВЭТТ = А + В . U + СU |
| c)p | ВЭТТ = А + В/U + С/U |
| d)p | ВЭТТ = А + В/U – СU |
| e)p | ВЭТТ = А + ВU + С/U |
| Вопрос №759 |
Варианты газовой хроматографии:
| a)p | высокоэффективная жидкостная |
| b)p | газо-жидкостная |
| c)p | тонкослойная |
| d)p | ионообменная |
| e)p | жидкостная |
| Вопрос №760 |
Подвижной фазой в газо-жидкостной хроматографии является:
| a)p | смесь органических растворителей |
| b)p | вода |
| c)p | органический растворитель |
| d)p | газ |
| Вопрос №761 |
Твердый носитель, используемый в ГЖХ, должен быть:
| a)p | механически прочен |
| b)p | все перечисленное |
| c)p | инертен |
| d)p | иметь развитую поверхность |
| e)p | иметь одинаковый размер частиц |
| Вопрос №762 |
Распределительная хроматография основана на различии:
| a)p | в ВЭТТ |
| b)p | в коэффициентах разделения |
| c)p | в критериях разделения |
| d)p | в площадях пиков |
| e)p | в коэффициентах распределения |
| Вопрос №763 |
Коэффициент разделения в ГЖХ рассчитывают по формуле:
| a)p | a = t1. t2 |
| b)p | a = t1- t2 |
| c)p | 
|
| d)p | a = t1+ t2 |
| e)p | 
|
| Вопрос №764 |
Неподвижной фазой в ГЖХ является:
| a)p | твердый носитель |
| b)p | жидкость |
| c)p | газ |
| d)p | смесь газов |
| Вопрос №765 |
Эффективность колонки в ГЖХ характеризуется:
| a)p | площадью пика |
| b)p | числом теоретических тарелок |
| c)p | критерием разделения |
| d)p | коэффициентом разделения |
| e)p | временем удерживания |
| Вопрос №766 |
Качественный анализ в ГЖХ проводят по:
| a)p | ВЭТТ |
| b)p | коэффициенту разделения |
| c)p | числу теоретических тарелок |
| d)p | площади пика вещества |
| e)p | времени удерживания |
| Вопрос №767 |
Высоту колонки, эквивалентную теоретической тарелке (ВЭТТ), рассчитывают по формуле:
| a)p | ВЭТТ = 
|
| b)p | ВЭТТ = N · L 
|
| c)p | ВЭТТ = 
|
| d)p | ВЭТТ = N + L |
| e)p | ВЭТТ = N - L |
| Вопрос №768 |
Селективность колонки в ГЖХ характеризуется:
| a)p | критерием разделения |
| b)p | временем удерживания |
| c)p | приведенным временем удерживания |
| d)p | числом теоретических тарелок |
| e)p | ВЭТТ |
| Вопрос №769 |
В ГЖХ используют колонки с числом теоретических тарелок:
| a)p | 100 |
| b)p | 400 |
| c)p | 200 |
| d)p | 300 |
| e)p | более 500 |
| Вопрос №770 |
Температура испарителя в ГЖХ должна быть:
| a)p | равна температуре термостата |
| b)p | равна температуре детектора |
| c)p | больше температуры кипения наиболее высококипящего компонента смеси |
| d)p | равна температуре кипения наиболее высоко кипящего компонента смеси |
| Вопрос №771 |
Ввод жидкой пробы в хроматограф осуществляют:
| a)p | пипеткой на 5 мл |
| b)p | микрошприцом на 10 мкл |
| c)p | краном-дозатором |
| d)p | пипеткой на 1 мл |
| e)p | шприцом на 5 мл |
| Вопрос №772 |
Светопоглощение (А) раствора составляет 0,26. Рассчитайте светопропускание (Т в %) этого раствора
| [..................] |
| Вопрос №773 |
Светопоглощение (А) раствора составляет 0,6. Рассчитайте светопропускание (Т в %) этого раствора
| [..................] |
| Вопрос №774 |
Рассчитайте светопоглощение (А) раствора, если светопропускание (Т) его составляет 58%.
| [..................] |
| Вопрос №775 |
Светопоглощение (А) раствора составляет 0,3. Рассчитайте светопропускание (Т в %) этого раствора
| [..................] |
| Вопрос №776 |
Светопоглощение (А) раствора составляет 0,4. Рассчитайте светопропускание (Т в %) этого раствора
| [..................] |
| Вопрос №777 |
Рассчитайте светопоглощение (А) раствора, если светопропускание (Т) его составляет 40%.
| [..................] |
| Вопрос №778 |
Рассчитайте светопоглощение (А) раствора, если светопропускание (Т) его составляет 60%.
| [..................] |
| Вопрос №779 |
Рассчитайте светопоглощение (А) раствора, если светопропускание (Т) его составляет 80%.
| [..................] |
| Вопрос №780 |
Светопропускание исследуемого раствора равно 25%. Светопоглощение этого раствора составляет:
| a)p | 0,40 |
| b)p | 0,25 |
| c)p | 0,53 |
| d)p | 0,60 |
| e)p | 0,36 |
| Вопрос №781 |
Рассчитайте светопоглощение (А) раствора, если светопропускание (Т) его составляет 30%.
| [..................] |
| Вопрос №782 |
Светопоглощение (А) раствора составляет 0,35. Рассчитайте светопропускание (Т в %) этого раствора
| [..................] |
| Вопрос №783 |
Рассчитайте светопоглощение (А) раствора, если светопропускание (Т) его составляет 70%.
| [..................] |
| Вопрос №784 |
Светопоглощение (А) раствора составляет 0,75. Рассчитайте светопропускание (Т в %) этого раствора
| [..................] |
| Вопрос №785 |
Светопоглощение (А) раствора составляет 0,55. Рассчитайте светопропускание (Т в %) этого раствора
| [..................] |
| Вопрос №786 |
Светопоглощение (А) раствора составляет 0,25. Рассчитайте светопропускание (Т в %) этого раствора
| [..................] |
| Вопрос №787 |
Рассчитайте светопоглощение (А) раствора, если светопропускание (Т) его составляет 45%.
| [..................] |
| Вопрос №788 |
Рассчитайте светопоглощение (А) раствора, если светопропускание (Т) его составляет 50%.
| [..................] |
| Вопрос №789 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 2000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 160 мм, а ширина пика на половине высоты (полуширина пика) - 3 мм.
| [..................] |
| Вопрос №790 |
Вычислите концентрацию (г/л) уксусной кислоты в растворе, если при потенциометрическом титровании 10,00 мл этого раствора 0,1000 н. раствором гидроксида натрия были получены следующие данные (см. табл.) и построена дифференциальная кривая титрования. М(СН3СООН) = 60 г/моль.
V+1/2ΔV 7,00 7,45 7,70 7,75 7,78 7,88 8,03 8,28
ΔpH/ΔV 0,30 0,33 0,60 3,00 6,00 1,50 1,00 0,60
| [..................] |
| Вопрос №791 |
Рассчитайте массу Na2S2O3.5H2O, содержащуюся в 200 мл анализируемого раствора, если на кулонометрическое титрование 20 мл этого раствора продолжалось 2 мин при силе тока 1,5 мА, а М(Na2S2O3.5H2O) = 248 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №792 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 70 мм, а полуширина пика 5 мм, высота пика второго компонента смеси была равна 90 мм, полуширина 3 мм.
| [..................] |
| Вопрос №793 |
При определении меди в виде аммиаката меди светопоглощение (А) раствора, содержащего 0,15 мг меди в 50 мл составляет 0,42 при толщине поглощающего слоя = 2,0 см. Рассчитайте удельный коэффициент светопоглощения. М(Cu) = 64 г/моль; плотность раствора = 1,0 г/мл.
| [..................] |
| Вопрос №794 |
Вычислите концентрацию (г/л) муравьиной кислоты в растворе, если при потенциометрическом титровании 50,00 мл этого раствора 0,1000 н. раствором гидроксида натрия были получены следующие данные (см. табл.) и построена дифференциальная кривая титрования. М(НСООН) = 46 г/моль.
V+1/2ΔV 8,00 8,45 8,70 8,75 8,78 8,88 9,03 9,28 ΔpH/ΔV 0,50 0,56 1,00 5,00 10,00 2,50 1,67 1,00
| [..................] |
| Вопрос №795 |
Рассчитайте массу сульфата цинка (А) в растворе, если 25,00 мл этого раствора, отобранного из мерной колбы вместимостью 250 мл, пропущены через катионит, а выделившаяся кислота оттитрована 17,50 мл 0,1000 н. раствора NaOH. Известно, что М(ZnSO4) = 161 г/моль.
| [..................] |
| Вопрос №796 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 3000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 70 мм, а ширина пика на половине высоты (полуширина пика) - 2 мм.
| [..................] |
| Вопрос №797 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 50 мм, а полуширина пика 3 мм, высота пика второго компонента смеси была равна 90 мм, полуширина 5 мм.
| [..................] |
| Вопрос №798 |
Рассчитайте массу серной кислоты (г), содержащуюся в 100 мл анализируемого раствора, если на кулонометрическое титрование 10 мл этого раствора продолжалось 210 сек при силе тока 3 мА, а М(Н2SO4) = 98 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №799 |
Рассчитайте силу тока в амперах при кулонометрическом титровании 20 мл раствора Na2S2O3.5H2O с титром 0,00124 г/мл электрогенерированным иодом, если время титрования составляло 4 мин, а М(Na2S2O3.5H2O) = 248 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №800 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 30 мм, а полуширина пика 5 мм, высота пика второго компонента смеси была равна 70 мм, полуширина 3 мм.
| [..................] |
| Вопрос №801 |
Рассчитайте силу тока в амперах при кулонометрическом титровании 20 мл раствора серной кислоты с титром 0,000568 г/мл электрогенерированным гидроксид-ионом, если время титрования составляло 17 мин, а М(Н2SO4) = 98 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №802 |
Рассчитайте толщину поглощающего слоя для измерения величины светопоглощения (А) раствора нитрата никеля, содержащего 0,0281 мг кристаллической соли в 25 мл раствора, если удельный коэффициент поглощения равен 2000, а величина светопоглощения А = 0,45. М(Ni(NO3)2.6H2O) = 290,79 г/моль, плотность раствора равна 1 г/мл.
| [..................] |
| Вопрос №803 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 2000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 210 мм, а ширина пика на половине высоты (полуширина пика) - 5 мм.
| [..................] |
| Вопрос №804 |
Рассчитайте массу сульфата цинка (А) в растворе в г/л, если 25,00 мл этого раствора пропущены через катионит, а выделившаяся кислота оттитрована 12,50 мл 0,1000 н. раствора NaOH. Известно, что М(ZnSO4) = 161 г/моль
| [..................] |
| Вопрос №805 |
При определении Fe3+ c cульфосалициловой кислотой светопоглощение раствора, содержащего 0,42 мг в 50 мл раствора составляет 0,45. Молярный коэффициент светопоглощения равен 3.103. Рассчитайте толщину поглощающего слоя (см). М(Fe) = 56 г/моль.
| [..................] |
| Вопрос №806 |
Рассчитайте массу нитрата калия (А) в растворе, если его пропустили через анионит, а выделившуюся щелочь оттитровали 11,50 мл 0,1000 н. раствора H2SO4. Известно, что М(KNO3) = 101,1 г/моль
| [..................] |
| Вопрос №807 |
Рассчитайте время кулонометрического титрования раствора, содержащего 0,0525 мг соляной кислоты электрогенерированным гидроксид-ионом, если сила тока была 2 мА, а М(HСl) = 36,5 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №808 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 80 мм, а полуширина пика 6 мм, высота пика второго компонента смеси была равна 120 мм, полуширина 4 мм.
| [..................] |
| Вопрос №809 |
Рассчитайте концентрацию меди (в моль/л), если светопоглощение (А) раствора аммиаката меди в кювете с толщиной поглощающего слоя 2 см составляет 0,672, а молярный коэффициент светопоглощения равен 420.
| [..................] |
| Вопрос №810 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 50 мм, а полуширина пика 3 мм, высота пика второго компонента смеси была равна 70 мм, полуширина 5 мм.
| [..................] |
| Вопрос №811 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 2000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 105 мм, а ширина пика на половине высоты (полуширина пика) - 3 мм.
| [..................] |
| Вопрос №812 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 10 мм, а полуширина пика 3 мм, высота пика второго компонента смеси была равна 50 мм, полуширина 5 мм.
| [..................] |
| Вопрос №813 |
Рассчитайте концентрацию Fe3+ (моль/л), если светопоглощение его раствора с сульфосалициловой кислотой составляет 0,60 в кювете с толщиной 1,0 см, молярный коэффициент светопоглощения 4.103. М(Fe) = 56 г/моль, плотность раствора = 1 г/мл.
| [..................] |
| Вопрос №814 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 20 мм, а полуширина пика 3 мм, высота пика второго компонента смеси была равна 50 мм, полуширина 4 мм.
| [..................] |
| Вопрос №815 |
Рассчитайте титр раствора Na2S2O3.5H2O, если при кулонометрическом титровании 10 мл этого раствора электрогенерированным иодом при силе тока, равной 25 мА продолжительность титрования составила 10,5 мин, а М(Na2S2O3.5H2O) = 248 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №816 |
При определении меди в виде аммиаката меди светопоглощение (А) раствора, содержащего 0,25 мг меди в 100 мл составляет 0,36 при толщине поглощающего слоя 3,0 см. Рассчитайте удельный коэффициент светопоглощения, если М(Cu) = 64 г/моль, плотность раствора 1,0 г/мл.
| [..................] |
| Вопрос №817 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 40 мм, а полуширина пика 6 мм, высота пика второго компонента смеси была равна 80 мм, полуширина 4 мм.
| [..................] |
| Вопрос №818 |
Рассчитайте концентрацию Сu2+ (в моль/л), если светопоглощение (А) раствора аммиаката меди составляет 0,254 в кювете с толщиной поглощающего слоя = 2 см, а молярный коэффициент поглощения ε = 423,3.
| [..................] |
| Вопрос №819 |
Рассчитайте концентрацию раствора цветного вещества (моль/л), если светопоглощение (А) его составляет 0,48 при толщине поглощающего слоя l = 2,0 см. Удельный коэффициент светопоглощения равен 120. М (вещества)= 200 г/моль, ρ = 1 г/мл
| [..................] |
| Вопрос №820 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 2000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 50 мм, а ширина пика на половине высоты (полуширина пика) - 1 мм.
| [..................] |
| Вопрос №821 |
Вычислите концентрацию (г/л) муравьиной кислоты в растворе, если при потенциометрическом титровании 20,00 мл этого раствора 0,1000 н. раствором гидроксида натрия были получены следующие данные (см. табл.) и построена дифференциальная кривая титрования. М(НСООН) = 46 г/моль.
V+1/2ΔV 6,00 6,45 6,70 6,75 6,78 6,88 7,03 7,28
ΔpH/ΔV 0,40 0,44 0,80 4,00 8,00 2,00 1,33 0,80
| [..................] |
| Вопрос №822 |
Рассчитайте массовую долю в % сульфата магния (А), если навеска его массой 0,2500 г растворена в воде, полученный раствор пропущен через катионит, а выделившаяся кислота оттитрована 19,50 мл 0,2000 н. раствора NaOH. Известно, что М(MgSO4) = 120 г/моль
| [..................] |
| Вопрос №823 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 2000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 225 мм, а ширина пика на половине высоты (полуширина пика) - 5 мм.
| [..................] |
| Вопрос №824 |
Рассчитайте титр раствора (г/мл) перманганата калия, если при кулонометрическом титровании 15 мл этого раствора электрогенерированными ионами железа(II) при силе тока 26 мА продолжительность титрования составила 12,8 мин, а М(КMnO4) = 158 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №825 |
Вычислите концентрацию (г/л) муравьиной кислоты в растворе, если при потенциометрическом титровании 10,00 мл этого раствора 0,1000 н. раствором гидроксида натрия были получены следующие данные (см. табл.) и построена дифференциальная кривая титрования. М(НСООН) = 46 г/моль.
V+1/2ΔV 5,00 5,45 5,70 5,75 5,78 5,88 6,03 6,28
ΔpH/ΔV 0,20 0,22 0,40 2,00 4,00 1,00 0,67 0,40
| [..................] |
| Вопрос №826 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 3000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 120 мм, а ширина пика на половине высоты (полуширина пика) - 5 мм.
| [..................] |
| Вопрос №827 |
Светопоглощение (А) раствора дихромата калия, содержащего 0,096 мг хрома в 100 мл раствора, составляет 0,127. Толщина поглощающего слоя 2,0 см. Вычислите молярный коэффициет светопоглощения, если М(Cr) = 52 г/моль.
| [..................] |
| Вопрос №828 |
Рассчитайте концентрацию раствора цветного вещества (моль/л), если светопоглощение (А) его составляет 0,40 при толщине поглощающего слоя 2,0 см. Удельный коэффициент светопоглощения 125. М(вещества) = 250 г/моль, плотность раствора = 1 г/мл.
| [..................] |
| Вопрос №829 |
Рассчитайте массу нитрита натрия (А) в растворе, если 50,00 мл этого раствора, отобранного из мерной колбы вместимостью 250 мл, пропущены через анионит, а выделившаяся щелочь оттитрована 10,50 мл 0,1000 н. раствора H2SO4. Известно, что М(NaNO2) = 69 г/моль
| [..................] |
| Вопрос №830 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 1000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 90 мм, а ширина пика на половине высоты (полуширина пика) - 4 мм.
| [..................] |
| Вопрос №831 |
Рассчитайте массовую долю Fe3+ (%), если светопоглощение раствора его комплекса с сульфосалициловой кислотой составляет 0,6 в кювете с толщиной 2,0 см, молярный коэффициент светопоглощения 4.103. М(Fe) = 56 г/моль, плотность раствора 1 г/мл.
| [..................] |
| Вопрос №832 |
Рассчитайте массу хлорида кальция (А) в растворе в г/л, если 15,00 мл этого раствора пропущены через анионит, а выделившаяся щелочь оттитрована 15,50 мл 0,1000 н. раствора H2SO4. Известно, что М(CaCl2) = 111 г/моль
| [..................] |
| Вопрос №833 |
Рассчитайте массовую долю в % сульфата натрия (А), если навеска его массой 1,5000 г растворена в воде, раствор разбавлен в мерной колбе до 250 мл, а 25,00 мл полученного раствора пропущены через катионит. Выделившаяся кислота оттитрована 15,50 мл 0,1000 н. раствора NaOH. Известно, что М(Na2SO4) = 142 г/моль
| [..................] |
| Вопрос №834 |
Рассчитайте время (сек) кулонометрического титрования раствора, содержащего 0,00525 г перманганата калия электрогенерированными ионами железа(II), если сила тока была 50 мА, а М(КMnO4) = 158 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №835 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 60 мм, а полуширина пика 4 мм, высота пика второго компонента смеси была равна 100 мм, полуширина 6 мм.
| [..................] |
| Вопрос №836 |
Рассчитайте массу соляной кислоты, содержащуюся в 100 мл анализируемого раствора, если на кулонометрическое титрование 10 мл этого раствора затрачено 210 сек при силе тока 3 мА, а М(HСl) = 36,5 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №837 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 1000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 85 мм, а ширина пика на половине высоты (полуширина пика) - 2 мм .
| [..................] |
| Вопрос №838 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 90 мм, а полуширина пика 3 мм, высота пика второго компонента смеси была равна 130 мм, полуширина 5 мм.
| [..................] |
| Вопрос №839 |
Рассчитайте массу хлорида натрия (А) в растворе, если 50,00 мл этого раствора, отобранного из мерной колбы вместимостью 250 мл, пропущены через анионит, а выделившаяся щелочь оттитрована 15,50 мл 0,1000 н. раствора H2SO4. Известно, что М(NaCl) = 58,5 г/моль.
| [..................] |
| Вопрос №840 |
Рассчитайте массовую долю в % хлорида натрия (А), если навеска его массой 0,2515 г растворена в воде, а полученный раствор пропущен через анионит. Выделившаяся щелочь оттитрована 19,50 мл 0,1000 н. раствора H2SO4. Известно, что М(NaCl) = 58,5 г/моль
| [..................] |
| Вопрос №841 |
Рассчитайте массу перманганата калия (г), содержащуюся в 250 мл контрольного раствора, если на кулонометрическое титрование 4 мл этого раствора электрогенерированными ионами железа(II) затрачено 6,5 мин при силе тока 5 мА, а М(КMnO4) = 158 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №842 |
Рассчитайте массу сульфата магния (А) в растворе в г/л, если 25,00 мл этого раствора пропущены через катионит, а выделившаяся кислота оттитрована 8,25 мл 0,1000 н. раствора NaOH. Известно, что М(MgSO4) = 120 г/моль
| [..................] |
| Вопрос №843 |
При определении Fe3+ c cульфосалициловой кислотой светопоглощение раствора, содержащего 0,171 мг в 50 мл раствора составляет 0,29. Молярный коэффициент светопоглощения равен 2,3.103. Рассчитайте толщину поглощающего слоя (см). М(Fe) = 56 г/моль.
| [..................] |
| Вопрос №844 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 60 мм, а полуширина пика 4 мм, высота пика второго компонента смеси была равна 80 мм, полуширина 6 мм.
| [..................] |
| Вопрос №845 |
При определении марганца в виде перманганата светопоглощение раствора, содержащего 0,12 мг в 100 мл, составляет 0,152. Молярный коэффициент светопоглощения ( ε ) равен 2,3.103. Рассчитайте толщину поглощающего слоя (см), если М(Mn) = 55 г/моль.
| [..................] |
| Вопрос №846 |
Рассчитайте массу нитрата кальция (А) в растворе в г/л, если 20,00 мл этого раствора пропущены через анионит, а выделившаяся щелочь оттитрована 16,25 мл 0,1000 н. раствора H2SO4. Известно, что М(Ca(NO3)2) = 164,08 г/моль.
| [..................] |
| Вопрос №847 |
Рассчитайте титр раствора соляной кислоты, если при кулонометрическом титровании 5 мл этого раствора электрогенерированным гидроксид-ионом при силе тока 26 мА продолжительность титрования составила 12,8 мин, а М(HСl) = 36,5 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №848 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 2000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 300 мм, а ширина пика на половине высоты (полуширина пика) - 8 мм.
| [..................] |
| Вопрос №849 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 3000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 200 мм, а ширина пика на половине высоты (полуширина пика) - 6 мм.
| [..................] |
| Вопрос №850 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 3000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 148 мм, а ширина пика на половине высоты (полуширина пика) - 6 мм.
| [..................] |
| Вопрос №851 |
Рассчитайте силу тока при кулонометрическом титровании 20 мл раствора соляной кислоты с титром 0,001568 г/мл электрогенерированным гидроксид-ионом, если время титрования составляло 5 мин, а М(HСl) = 36,5 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №852 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 1000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 150 мм, а ширина пика на половине высоты (полуширина пика) - 5 мм.
| [..................] |
| Вопрос №853 |
Рассчитайте силу тока в амперах при кулонометрическом титровании 20 мл раствора перманганата калия с титром 0,001568 г/мл электрогенерированными ионами железа(II), если время титрования составляло 5 мин, а М(КMnO4) = 158 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №854 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 100 мм, а полуширина пика 4 мм, высота пика второго компонента смеси была равна 140 мм, полуширина 6 мм.
| [..................] |
| Вопрос №855 |
Рассчитайте массу бромида натрия (А) в растворе, если 10,00 мл этого раствора, отобранного из мерной колбы вместимостью 100 мл, пропущены через катионит, а выделившаяся кислота оттитрована 13,50 мл 0,1000 н. раствора NaOH. Известно, что М(NaBr) = 102,9 г/моль
| [..................] |
| Вопрос №856 |
Вычислите концентрацию (г/л) уксусной кислоты в растворе, если при потенциометрическом титровании 50,00 мл этого раствора 0,1000 н. раствором гидроксида натрия были получены следующие данные (см. табл.) и построена дифференциальная кривая титрования. М(СН3СООН) = 60 г/моль.
V+1/2ΔV 9,00 9,45 9,70 9,75 9,78 9,88 10,03 10,28
ΔpH/ΔV 0,60 0,67 1,20 6,00 12,00 3,00 2,00 1,20
| [..................] |
| Вопрос №857 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 80 мм, а полуширина пика 6 мм, высота пика второго компонента смеси была равна 100 мм, полуширина 4 мм.
| [..................] |
| Вопрос №858 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 2000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 180 мм, а ширина пика на половине высоты (полуширина пика) - 4 мм.
| [..................] |
| Вопрос №859 |
Рассчитайте время кулонометрического титрования раствора, содержащего 0,00525 г Na2S2O3.5H2O электрогенерированным иодом при силе тока, равной 25 мА. М(Na2S2O3.5H2O) = 248 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №860 |
Вычислите концентрацию (г/л) уксусной кислоты в растворе, если при потенциометрическом титровании 20,00 мл этого раствора 0,1000 н. раствором гидроксида натрия были получены следующие данные (см. табл.) и построена дифференциальная кривая титрования. М(СН3СООН) = 60 г/моль.
V+1/2ΔV 4,00 4,45 4,70 4,75 4,78 4,88 5,03 5,28
ΔpH/ΔV 0,10 0,11 0,20 1,00 2,00 0,50 0,33 0,20
| [..................] |
| Вопрос №861 |
Рассчитайте массу хлорида калия (А) в растворе, если 10,00 мл этого раствора, отобранного из мерной колбы вместимостью 100 мл, пропущены через катионит, а выделившаяся кислота оттитрована 12,00 мл 0,1000 н. раствора NaOH. Известно, что М(KCl) = 74,55 г/моль
| [..................] |
| Вопрос №862 |
Рассчитайте массу хлорида магния (А) в растворе, если 25,00 мл этого раствора отобраны из мерной колбы вместимостью 250 мл и пропущены через катионит, а выделившаяся кислота оттитрована 16,50 мл 0,1000 н. раствора NaOH. Известно, что М(MgCl2) = 95,2 г/моль
| [..................] |
| Вопрос №863 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 60 мм, а полуширина пика 4 мм, высота пика второго компонента смеси была равна 80 мм, полуширина 6 мм.
| [..................] |
| Вопрос №864 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 3000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 250 мм, а ширина пика на половине высоты (полуширина пика) - 6 мм.
| [..................] |
| Вопрос №865 |
Светопоглощение (А) раствора сульфата кобальта, содержащего 0,5 мг соли в 50 мл раствора составляет 0,49. Толщина поглощающего слоя 2,0 см. Рассчитайте удельный коэффициент светопоглощения, если М(CoSO4) = 155 г/моль, плотность раствора 1 г/мл.
| [..................] |
| Вопрос №866 |
Рассчитайте время кулонометрического титрования раствора, содержащего 0,1525 мг серной кислоты электрогенерированным гидроксид-ионом, если сила тока была 2 мА, а М(Н2SO4) = 98 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №867 |
Рассчитайте массовую долю в % хлорида калия (А), если навеска его массой 1,2500 г растворена в воде, раствор разбавлен в мерной колбе до 100 мл, а 10 мл этого раствора пропущено через анионит. Выделившаяся щелочь оттитрована 15,50 мл 0,1000 н. раствора H2SO4. Известно, что М(KCl) = 74,55 г/моль
| [..................] |
| Вопрос №868 |
Рассчитайте титр раствора серной кислоты, если при кулонометрическом титровании 15 мл этого раствора электрогенерированным гидроксид-ионом при силе тока 26 мА продолжительность титрования составила 12,8 мин, а М(Н2SO4) = 98 г/моль. Константа Фарадея F=96485 Кл/моль.
| [..................] |
| Вопрос №869 |
Навеску вещества массой 0,0162 г растворили в мерной колбе вместимостью 50,00 мл. Полученный раствор разбавили в 100 раз. Светопоглощение (А) разбавленного раствора составило 0,40 при толщине поглощающего слоя = 1,0 см. Рассчитайте молярный коэффициент светопоглощения данного вещества. М (вещества) = 138 г/моль.
| [..................] |
| Вопрос №870 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 70 мм, а полуширина пика 5 мм, высота пика второго компонента смеси была равна 110 мм, полуширина 3 мм.
| [..................] |
| Вопрос №871 |
Рассчитайте массу хлорида натрия (А) в растворе, если 50,00 мл этого раствора пропущены через анионит, а выделившаяся щелочь оттитрована 20,50 мл 0,1000 н. раствора H2SO4. Известно, что М(NaCl) = 58,5 г/моль
| [..................] |
| Вопрос №872 |
Рассчитайте массовую долю (в %) первого компонента смеси, если при газохроматографическом анализе высота пика его составила 20 мм, а полуширина пика 4 мм, высота пика второго компонента смеси была равна 60 мм, полуширина 6 мм.
| [..................] |
| Вопрос №873 |
Рассчитать высоту, эквивалентную теоретической тарелке (ВЭТТ), для колонки длиной 1000 мм, если при хроматографировании вещества время удерживания t (расстояние удерживания) составляет 40 мм, а ширина пика на половине высоты (полуширина пика) - 3 мм.
| [..................] |
| Вопрос №874 |
Рассчитайте концентрацию раствора цветного вещества (моль/л), если светопоглощение(А) его составляет 0,40 при толщине поглощающего слоя 2,0 см. Молярный коэффициент светопоглощения 400. М(вещества) 250 г/моль, плотность раствора 1 г/мл.
| [..................] |
Ответы на тест
[№ вопроса] (к-во баллов) правильный ответ,...
Вариант №1
[1] (1)c
[2] (1)e
[3] (1)b
[4] (1)e
[5] (1)a
[6] (1)a
[7] (1)b
[8] (1)d
[9] (1)d
[10] (1)d
[11] (1)b
[12] (1)c
[13] (1)d
[14] (1)b
[15] (1)c
[16] (1)d
[17] (1)c
[18] (1)e
[19] (1)d
[20] (1)d
[21] (1)e
[22] (1)c
[23] (1)d
[24] (1)b
[25] (1)a
[26] (1)c
[27] (1)b
[28] (1)c
[29] (1)b
[30] (1)a
[31] (1)c
[32] (1)b
[33] (1)b
[34] (1)c
[35] (1)c
[36] (1)b
[37] (1)c
[38] (1)b
[39] (1)b
[40] (1)c
[41] (1)e
[42] (1)b
[43] (1)e
[44] (1)e
[45] (1)d
[46] (1)c
[47] (1)c
[48] (1)a
[49] (1)b
[50] (1)a
[51] (1)b
[52] (1)c
[53] (1)a
[54] (1)b
[55] (1)c
[56] (1)f
[57] (1)f
[58] (1)a
[59] (1)c
[60] (1)b
[61] (1)c
[62] (1)b
[63] (1)e
[64] (1)a
[65] (1)c
[66] (1)d
[67] (1)e
[68] (1)a
[69] (1)d
[70] (1)c
[71] (1)c
[72] (1)d
[73] (1)c
[74] (1)b
[75] (1)d
[76] (1)d
[77] (1)a
[78] (1)b
[79] (1)e
[80] (1)a
[81] (1)b
[82] (1)c
[83] (1)d
[84] (1)b
[85] (1)d
[86] (1)c
[87] (1)e
[88] (1)c
[89] (1)c
[90] (1)e
[91] (1)a
[92] (1)b
[93] (1)b
[94] (1)c
[95] (1)c
[96] (1)d
[97] (1)b
[98] (1)b
[99] (1)b
[100] (1)d
[101] (1)d
[102] (1)c
[103] (1)b
[104] (1)e
[105] (1)c
[106] (1)d
[107] (1)c
[108] (1)d
[109] (1)b
[110] (1)b
[111] (1)c
[112] (1)e
[113] (1)a
[114] (1)a
[115] (1)a
[116] (1)c
[117] (1)d
[118] (1)e
[119] (1)c
[120] (1)d
[121] (1)e
[122] (1)e
[123] (1)b
[124] (1)d
[125] (1)d
[126] (1)c
[127] (1)d
[128] (1)a
[129] (1)b
[130] (1)e
[131] (1)0,05
[132] (1)b
[133] (1)0,20
[134] (1)d
[135] (1)b
[136] (1)a
[137] (1)a
[138] (1)d
[139] (1)b
[140] (1)e
[141] (1)b
[142] (1)0,15
[143] (1)c
[144] (1)d
[145] (1)0,09
[146] (1)c
[147] (1)c
[148] (1)b
[149] (1)c
[150] (1)0,4
[151] (1)0,3
[152] (1)0,016
[153] (1)0,6
[154] (1)0,16
[155] (1)0,06
[156] (1)0,24
[157] (1)1,5
[158] (1)0,16
[159] (1)0,12
[160] (1)0,15
[161] (1)0,16
[162] (1)0,012
[163] (1)0,06
[164] (1)e
[165] (1)a
[166] (1)c
[167] (1)0,027
[168] (1)0,025
[169] (1)0,2
[170] (1)0,25
[171] (1)0,03
[172] (1)0,01
[173] (1)0,6
[174] (1)0,2
[175] (1)0,175
[176] (1)0,9
[177] (1)0,02
[178] (1)0,024
[179] (1)0,12
[180] (1)0,2
[181] (1)0,4
[182] (1)0,04
[183] (1)0,35
[184] (1)0,08
[185] (1)0,04
[186] (1)0,02
[187] (1)0,02
[188] (1)a
[189] (1)d
[190] (1)d
[191] (1)a
[192] (1)b
[193] (1)c
[194] (1)d
[195] (1)d
[196] (1)d
[197] (1)a
[198] (1)d
[199] (1)a
[200] (1)b
[201] (1)b
[202] (1)a
[203] (1)b
[204] (1)c
[205] (1)a
[206] (1)b
[207] (1)b
[208] (1)b
[209] (1)c
[210] (1)b
[211] (1)c
[212] (1)b
[213] (1)a
[214] (1)a
[215] (1)a
[216] (1)b
[217] (1)b
[218] (1)a
[219] (1)a
[220] (1)c
[221] (1)b
[222] (1)b
[223] (1)d
[224] (1)a
[225] (1)c
[226] (1)d
[227] (1)d
[228] (1)b
[229] (1)c
[230] (1)b
[231] (1)c
[232] (1)c
[233] (1)d
[234] (1)b
[235] (1)d
[236] (1)a
[237] (1)d
[238] (1)a
[239] (1)b
[240] (1)c
[241] (1)a
[242] (1)b
[243] (1)c
[244] (1)a
[245] (1)c
[246] (1)c
[247] (1)d
[248] (1)c
[249] (1)c
[250] (1)a
[251] (1)c
[252] (1)a
[253] (1)a
[254] (1)b
[255] (1)a
[256] (1)a
[257] (1)c
[258] (1)2
[259] (1)3
[260] (1)3
[261] (1)10
[262] (1)9
[263] (1)4
[264] (1)4
[265] (1)13
[266] (1)5
[267] (1)10
[268] (1)9
[269] (1)10
[270] (1)7
[271] (1)11
[272] (1)4
[273] (1)3
[274] (1)3
[275] (1)9
[276] (1)11
[277] (1)3
[278] (1)3
[279] (1)11
[280] (1)4
[281] (1)3
[282] (1)11
[283] (1)4
[284] (1)5
[285] (1)11
[286] (1)7
[287] (1)11
[288] (2)9
[289] (2)6
[290] (2)7
[291] (2)12
[292] (2)3
[293] (2)10
[294] (2)9
[295] (2)10
[296] (2)3
[297] (2)5
[298] (1)b
[299] (1)c
[300] (1)b
[301] (1)c
[302] (1)a
[303] (1)a
[304] (1)c
[305] (1)d
[306] (1)d
[307] (1)a
[308] (1)c
[309] (1)b
[310] (1)e
[311] (1)a
[312] (1)e
[313] (1)1,77
[314] (1)0,77
[315] (1)1,71..1,72
[316] (1)1,88..1,89
[317] (1)1,65..1,66
[318] (1)0,82..0,83
[319] (1)0,65..0,66
[320] (1)0,88..0,89
[321] (1)0,71..0,72
[322] (1)1,82..1,84
[323] (1)4
[324] (1)4
[325] (1)4
[326] (1)2
[327] (1)1
[328] (1)2
[329] (1)4
[330] (1)2
[331] (1)1
[332] (1)a
[333] (1)e
[334] (1)d
[335] (1)1000
[336] (1)1000
[337] (1)c
[338] (1)10
[339] (1)e
[340] (1)b
[341] (1)e
[342] (1)c
[343] (1)a
[344] (1)d
[345] (1)a
[346] (1)d
[347] (1)a
[348] (1)e
[349] (1)d
[350] (1)d
[351] (1)b
[352] (1)c
[353] (1)a
[354] (1)b
[355] (1)c
[356] (1)a
[357] (1)b
[358] (1)c
[359] (1)b
[360] (1)c
[361] (1)d
[362] (1)c
[363] (1)c
[364] (1)b
[365] (1)d
[366] (1)b
[367] (1)a
[368] (1)d
[369] (1)a
[370] (1)c
[371] (1)2
[372] (1)a
[373] (1)2
[374] (1)d
[375] (1)b
[376] (1)e
[377] (1)c
[378] (1)c
[379] (1)e
[380] (1)c
[381] (1)d,(1)e
[382] (1)a
[383] (2)99..100
[384] (2)69..70
[385] (2)85..86
[386] (2)85..86
[387] (2)95..96
[388] (2)59..60
[389] (2)69..70
[390] (2)59..60
[391] (2)99..100
[392] (2)95..96
[393] (1)b
[394] (1)b
[395] (1)a
[396] (1)b
[397] (1)c
[398] (1)e
[399] (1)c
[400] (1)c
[401] (1)a
[402] (1)d
[403] (1)d
[404] (1)e
[405] (1)c
[406] (1)4
[407] (1)d
[408] (1)a
[409] (1)a
[410] (1)c
[411] (1)a
[412] (1)b
[413] (1)a
[414] (1)c
[415] (1)b
[416] (1)a
[417] (1)b
[418] (1)c
[419] (1)b
[420] (1)b
[421] (1)a
[422] (1)c
[423] (1)a
[424] (1)c
[425] (1)c
[426] (1)a
[427] (1)b
[428] (1)a
[429] (1)d
[430] (1)b
[431] (1)a
[432] (1)d
[433] (1)c
[434] (1)b
[435] (1)b
[436] (1)d
[437] (1)d
[438] (1)d
[439] (1)c
[440] (1)c
[441] (1)a
[442] (1)b
[443] (1)b
[444] (1)d
[445] (1)b
[446] (1)b
[447] (1)a
[448] (1)c
[449] (1)d
[450] (1)b
[451] (1)a
[452] (1)a
[453] (1)b
[454] (1)d
[455] (1)c
[456] (1)c
[457] (1)c
[458] (1)a
[459] (1)c
[460] (1)d
[461] (1)c
[462] (1)a
[463] (1)a
[464] (1)d
[465] (1)c
[466] (1)d
[467] (1)1
[468] (1)c
[469] (1)a
[470] (1)d
[471] (1)a
[472] (1)a
[473] (1)a
[474] (1)b
[475] (1)b
[476] (1)d
[477] (1)a
[478] (1)a
[479] (1)b
[480] (1)c
[481] (1)b
[482] (1)c
[483] (1)a
[484] (1)d
[485] (1)e
[486] (1)e
[487] (1)d
[488] (1)b
[489] (1)a
[490] (1)a
[491] (1)d
[492] (1)a
[493] (1)e
[494] (1)c
[495] (1)d
[496] (1)d
[497] (1)c
[498] (1)d
[499] (1)c
[500] (1)b
[501] (1)c
[502] (1)7
[503] (1)10
[504] (1)3
[505] (1)3,3..3,5
[506] (1)10
[507] (1)11,5..11,7
[508] (1)10,5..10,7
[509] (1)10
[510] (1)12
[511] (1)12
[512] (1)10
[513] (1)3
[514] (1)12
[515] (1)11
[516] (1)3
[517] (1)12
[518] (1)9,5..9,6
[519] (1)1,58..1,59
[520] (1)0,125
[521] (2)0,101..0,103
[522] (1)a
[523] (1)2
[524] (1)c
[525] (2)0,05..0,06
[526] (1)a
[527] (1)d
[528] (2)0,39..0,40
[529] (1)0,01
[530] (1)d
[531] (1)0,2
[532] (2)0,05..0,06
[533] (2)1,22..1,23
[534] (1)0,005
[535] (1)c
[536] (1)3,3..3,4
[537] (1)c
[538] (1)0,98..0,99
[539] (1)2
[540] (2)1,2
[541] (2)3,3..3,4
[542] (2)4,96
[543] (2)8
[544] (2)0,2400
[545] (2)0,095..0,097
[546] (2)0,087..0,088
[547] (2)98,7..98,8
[548] (2)0,51..0,52
[549] (2)90
[550] (2)10
[551] (2)91..92
[552] (2)0,068..0,069
[553] (2)92..93
[554] (2)84,1..84,2
[555] (2)99,6..99,8
[556] (2)11,7..11,8
[557] (2)98..99
[558] (2)0,42..0,43
[559] (2)0,024..0,025
[560] (2)80
[561] (2)86..87
[562] (2)77..78
[563] (2)97..98
[564] (2)0,48..0,50
[565] (2)1,1..1,2
[566] (2)88..89
[567] (2)200
[568] (2)0,0058..0,0059
[569] (2)1,82..1,83
[570] (2)10..11
[571] (2)84
[572] (2)5,6
[573] (2)6,7..6,8
[574] (2)6,77..6,78
[575] (2)0,026..0,027
[576] (2)0,68..0,69
[577] (2)99,0..99,1
[578] (2)1,1..1,2
[579] (2)84,80
[580] (2)0,1020
[581] (2)16..17
[582] (2)0,008..0,009
[583] (2)0,031..0,032
[584] (2)10,2..10,3
[585] (2)0,8..0,9
[586] (2)4..5
[587] (2)85
[588] (2)2,5..2,6
[589] (2)16..17
[590] (2)0,81..0,82
[591] (2)3,5..3,6
[592] (2)2,5..2,6
[593] (2)93..94
[594] (2)0,018..0,019
[595] (2)4..5
[596] (2)0,056..0,057
[597] (2)0,20..0,21
[598] (2)87..88
[599] (2)12..13
[600] (2)42..43
[601] (2)16,8
[602] (2)1,3..1,4
[603] (2)15
[604] (2)0,0023..0,0024
[605] (2)99,2..99,4
[606] (2)0,8
[607] (2)36,1..36,2
[608] (2)93..94
[609] (2)0,074..0,075
[610] (2)0,12..0,13
[611] (2)0,048..0,049
[612] (2)0,39..0,41
[613] (2)98,5..99,5
[614] (2)0,022..0,023
[615] (2)20
[616] (2)1,66..1,67
[617] (2)80
[618] (2)0,020..0,021
[619] (2)16
[620] (2)96
[621] (2)81..82
[622] (2)0,047..0,048
[623] (2)93,7..93,8
[624] (2)94..95
[625] (2)0,078..0,079
[626] (2)250
[627] (2)1,0..1,2
[628] (2)0,012..0,013
[629] (2)91..92
[630] (2)0,11..0,12
[631] (2)1,7..1,8
[632] (2)62..63
[633] (2)0,053..0,054
[634] (2)6,48
[635] (2)0,10..0,11
[636] (2)0,018..0,019
[637] (2)85..86
[638] (1)b
[639] (1)e
[640] (1)c
[641] (1)e
[642] (1)d
[643] (1)b
[644] (1)c
[645] (1)c
[646] (1)b
[647] (1)b
[648] (1)e
[649] (1)b
[650] (1)c
[651] (1)d
[652] (1)c
[653] (1)b
[654] (1)e
[655] (1)c
[656] (1)c
[657] (1)a
[658] (1)e
[659] (1)a
[660] (1)c
[661] (1)b
[662] (1)b
[663] (1)c
[664] (1)e
[665] (1)a
[666] (1)a
[667] (1)c
[668] (1)d
[669] (1)e
[670] (1)c
[671] (1)e
[672] (1)c
[673] (1)c
[674] (1)c
[675] (1)e
[676] (1)e
[677] (1)d
[678] (1)e
[679] (1)b
[680] (1)d
[681] (1)c
[682] (1)b
[683] (1)d
[684] (1)b
[685] (1)c
[686] (1)e
[687] (1)c
[688] (1)c
[689] (1)a
[690] (1)c
[691] (1)b
[692] (1)c
[693] (1)d
[694] (1)b
[695] (1)c
[696] (1)d
[697] (1)d
[698] (1)b
[699] (1)c
[700] (1)c
[701] (1)a
[702] (1)d
[703] (1)d
[704] (1)a
[705] (1)a
[706] (1)d
[707] (1)d
[708] (1)a
[709] (1)b
[710] (1)a
[711] (1)d
[712] (1)d
[713] (1)a
[714] (1)d
[715] (1)a
[716] (1)b
[717] (1)d
[718] (1)d
[719] (1)a
[720] (1)e
[721] (1)b
[722] (1)a
[723] (1)b
[724] (1)b
[725] (1)a
[726] (1)e
[727] (1)b
[728] (1)c
[729] (1)d
[730] (1)e
[731] (1)c
[732] (1)c
[733] (1)d
[734] (1)b
[735] (1)a
[736] (1)d
[737] (1)e
[738] (1)c
[739] (1)b
[740] (1)b
[741] (1)a
[742] (1)b
[743] (1)b
[744] (1)b
[745] (1)e
[746] (1)a
[747] (1)b
[748] (1)e
[749] (1)a
[750] (1)b
[751] (1)a
[752] (1)c
[753] (1)b
[754] (1)c
[755] (1)e
[756] (1)e
[757] (1)d
[758] (1)a
[759] (1)b
[760] (1)d
[761] (1)b
[762] (1)e
[763] (1)c
[764] (1)b
[765] (1)b
[766] (1)e
[767] (1)a
[768] (1)a
[769] (1)e
[770] (1)c
[771] (1)b
[772] (1)54..56
[773] (1)25..26
[774] (1)0,23..0,24
[775] (1)50..51
[776] (1)39..40
[777] (1)0,39..0,41
[778] (1)0,2..0,23
[779] (1)0,09..0,1
[780] (1)d
[781] (1)0,5..0,53
[782] (1)44..45
[783] (1)0,15..0,16
[784] (1)17..18
[785] (1)28..29
[786] (1)56..57
[787] (1)0,34..0,35
[788] (1)0,3..0,31
[789] (2)0,12..0,14
[790] (2)4,6..4,7
[791] (2)0,0045..0,0047
[792] (2)56..57
[793] (2)700
[794] (2)1,0..1,1
[795] (2)1,4..1,5
[796] (2)0,43..0,45
[797] (2)25
[798] (2)0,003..0,004
[799] (2)0,04..0,05
[800] (2)41..42
[801] (2)0,02..0,03
[802] (2)1,9..2,1
[803] (2)0,19..0,21
[804] (2)4..4,1
[805] (2)1
[806] (2)0,11..0,12
[807] (2)68..70
[808] (2)50
[809] (2)0,0008
[810] (2)30
[811] (2)0,28..0,31
[812] (2)10..11
[813] (2)0,00015
[814] (2)23..24
[815] (2)0,004..0,0042
[816] (2)480
[817] (2)42..43
[818] (2)0,00029..0,00031
[819] (2)0,0001
[820] (2)0,13..0,15
[821] (2)1,5..1,6
[822] (2)93..94
[823] (2)0,17..0,19
[824] (2)0,0004..0,0005
[825] (2)2,6..2,7
[826] (2)0,93..0,95
[827] (2)3400..3500
[828] (2)0,000064
[829] (2)0,36..0,37
[830] (2)0,35..0,37
[831] (2)0,0004..0,0005
[832] (2)5,7..5,8
[833] (2)73..74
[834] (2)300..350
[835] (2)28..29
[836] (2)0,002..0,003
[837] (2)0,09..0,11
[838] (2)29..30
[839] (2)0,45..0,46
[840] (2)45..46
[841] (2)0,03..0,05
[842] (2)1,9..2,1
[843] (2)1,9..2,1
[844] (2)33..34
[845] (2)3..3,1
[846] (2)6,6..6,8
[847] (2)0,001..0,002
[848] (2)0,25..0,27
[849] (2)0,48..0,5
[850] (2)0,88..0,9
[851] (2)0,25..0,29
[852] (2)0,19..0,21
[853] (2)0,3..0,4
[854] (2)32..33
[855] (2)1,3..1,5
[856] (2)1,1..1,2
[857] (2)54..55
[858] (2)0,17..0,19
[859] (2)81..82
[860] (2)1..1,2
[861] (2)0,88..0,92
[862] (2)0,7..0,9
[863] (2)33..34
[864] (2)0,3..0,32
[865] (2)240..250
[866] (2)140..160
[867] (2)92..93
[868] (2)0,0006..0,0007
[869] (2)16000..18000
[870] (2)51..52
[871] (2)0,11..0,13
[872] (2)18..19
[873] (2)1..1,1
[874] (2)0,0005
Дата добавления: 2018-09-22; просмотров: 735; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
