Взятие материала для фиксации.
Объекты, подлежащие исследованию, должны быть, прежде всего, свежими. Желательно брать живых или только что усыпленных животных. При необходимости применяется наркоз. Недопустимо никакое сдавливание кусочков, очистка поверхности механическим способом, использование плохих заточенных инструментов: это может привести к нарушениям структуры ткани и, как следствие, к артефактам. Большие куски для фиксации брать не рекомендуется: это ухудшает дальнейший процесс фиксации.
Фиксация.
Цель фиксации: сохранить тканевые структуры в том состоянии, в каком они находились в момент погружения ткани в фиксирующий раствор, и одновременное их предохранение от дальнейших разрушений. Именно поэтому процесс взятия материала и переноса его в фиксирующий раствор должен быть очень быстрым. Практически все фиксаторы относятся к токсичным веществам, некоторые даже ядовиты, поэтому при работе с ними необходимо соблюдать правила техники безопасности.
Требования, предъявляемыми к фиксаторам: 1) легкое и быстрое проникновение в ткани, 2) равномерное воздействие на все компоненты клетки, 3) фиксатор не должен препятствовать последующей обработке ткани. На результаты фиксации влияют: температура, время фиксации, кислотность, химические свойства фиксатора, время, прошедшее после взятия ткани. Полноценная фиксация материала обеспечивается при соблюдении следующих требований:
|
|
|
1) после вырезки кусочка ткани его немедленно погружают в фиксатор;
2) объем фиксатора должен превышать объем фиксируемого материала в 10-20 раз, так как тканевая жидкость может существенно изменить концентрацию фиксатора;
3) если цвет фиксатора изменяется после погружения в него кусочков ткани, то фиксатор следует немедленно сменить;
4) недопустимо повторное использование фиксаторов;
5) для каждого фиксатора следует соблюдать установлено время фиксации.

 фиксаторы
фиксаторы
Простые сложные
Простые фиксаторы состоят из одного вещества или его раствора. Например, формалин (40% раствор формальдегида), этиловый спирт (80%, 90%, 96%, 100%), ацетон, глутаровый альдегид (используется для электронной микроскопии, как правило, 2,5% раствор). Так например, механизм действия этилового спирта основан на осаждении белков; при этом происходит обезвоживание объекта, что значительно ускоряет процесс фиксации.
Сложные фиксаторы состоят из простых фиксатором. Например, фиксатор Буэна (состоит из пикриновой и ледяной уксусной кислот, формалина), фиксатор Карнуа (ледяная уксусная кислота, хлороформ, спирт 100% или 96%) и мн. др.
|
|
|
Обезвоживание.
После фиксации материал необходимо отмыть от фиксатора и обезводить. Обезвоживание необходимо, так большая часть фиксаторов представляет собой водные растворы. В дальнейшем, при заливке материала, вода не сможет смешаться с заливочной средой, а, значит, заливочная среда не сможет проникнуть внутрь ткани.
Самым распространенным способом является обезвоживание в спиртах восходящей концентрации, начиная 70% и заканчивая 100%: 70% → 80% → 96% (1-ая смена) → 96 % (2-ая смена) → 100% (1-ая смена) → 100% (2-ая смена).
Заливка материала.
После обезвоживания следует подготовка материала к заключению в заливочную среду. Для этого материал помещают в среду, которая одинаково хорошо смешивается и со спиртом, и с заливочной средой.
В качестве заливочной среды могут использоваться, например, парафин, полиэтиленгликоль, парапласт, желатин и др. Парафин – воскоподобное вещество, смесь предельных углеводородов состава С18Н38-С35Н72. tпл 40-65 °С; плотность 0,880-0,915 г/см3 (15 °С). Получают главным образом из нефти. Парапласт – гранулированный специализированный гистологический парафин (торговое наименование – Paraplast Plus) состоит из очищенного парафина и пластичного полимера с регулярным молекулярным весом, дважды отфильтрован и не имеет посторонних включений. Благодаря содержанию диметил сульфоксида (ДМСО) Парапласт Плюс быстро проникает в обработанную ткань (имеет высокую текучесть) и предназначен для заливки образцов с целью дальнейшего получения тонких – 2 микрона – серийных срезов. Диапазон температуры плавления – 55 – 57 С (оптимально - 56 С). Нельзя нагревать выше 62 С.
|
|
|
С целью подготовки материала к заливке кусочки из 100% помещают в смесь ксилола с абсолютным спиртом (1:1). Далее материал переносят в чистый ксилол (две смены). Из ксилола кусочки переносятся в «кашу» - смесь парафина (парапласта) и ксилола помещаются в термостат, отрегулированный на 37º С. С «каши» начинается этап пропитки материала парафином, что достигается постепенным замещением ксилола на парафин. Из «каши» кусочки переносятся в расплавленный парафин и помещаются в термостат, отрегулированный на 2-3 градуса выше точки плавления парафина (обычно на 60º С). Затем кусочки переносятся во второй парафин. Все манипуляции по переноске кусочков в парафин проводятся пинцетом, нагретым над пламенем горелки. После второго парафина проводят заливку материала в новый, третий, заливочный парафин. Для этого пропитанные в парафине кусочки выкладывают в специальные формочки и заливают расплавленным в термостате парафином. Дают остыть.
|
|
|
Работа на микротоме.
Для получения гистологических срезов применяют специальные приборы, называемые микротомами. Полученный ранее парафиновый блок наклеивают на специальную деревянную колодку, срезают лишний парафин и устанавливают в микротом. Микротомы позволяют получить срезы разной толщины; хорошей для светомикроскопического среза является толщина 3-4 мкм.
Полученные срезы при помощи смеси белка с глицерином прикрепляют к предметным стеклам. Вся дальнейшая работа связана с подготовкой срезов к окрашиванию. Целью окрашивания является более отчетливое выявление компонентов клеток и тканей.
Предметные стекла.
Предметные стекла должны имеют толщину 1,0 – 1,2 мм. Толщина стекла порядка 1 мм примерно соответствует длине световой волны, что обеспечивает низкие интерференцию и дифракцию волн, слабое отклонение светового пучка. Это способствует получению на подобных стеклах препаратов высокого оптического качества. Кроме того, постоянство толщины стекла по всей длине препарата снижает до минимума необходимость подстройки фокусного расстояния микроскопа, что особенно важно при микроскопии на иммерсионном объективе. Кроме того, предметные стекла не должны быть окрашены. Имеющее окраску стекло искажает оттенки окраски клеток и клеточных элементов в препарате, что особенно не желательно, когда тонкие оттенки цветов являются самым существенным фактором идентификации и диагностики.
Предметные стекла отличаются по состоянию бокового ребра – резанные или с зашлифованным краем. Стекла с зашлифованным краем используют при микроскопировании объектов, при котором блики на срезанном боковом ребре могут помешать идентификации объекта. Также стекла отличаются наличием или отсутствием матового окошка на поверхности стекла, использующегося для маркировки препарата. Размер окошка – 26 х 20 мм.
Депарафинирование срезов.
Парафиновые срезы перед окрашиванием освобождают от парафина с помощью любого его растворителя, как правило, это толуол. Депарафинирование осуществляют по следующей схеме: толуол (1 смена), толуол (2 смена), 100° спирт (1 смена), 100° спирт (2 смена), 96° спирт, 70° спирт, дистиллированная вода.
Окрашивание срезов.
Депарафинизированные срезы готовы к окрашиванию. При окраске водными красителями срезы переносят в краситель из водной среды, а при окраске спиртовыми – из соответствующего раствора спирта. Более подробно о красителях см. далее.
Обезвоживание срезов.
Перед следующим этапом срезы необходимо обезводить, так как среда, в которую потом будут заключаться срезы, не смешивается с водой. Также как и кусочки, срезы обезвоживают в спиртах восходящей концентрации и заканчивают процесс обезвоживания в толуоле. Последовательность обезвоживания: вода, 70° спирт, 96° спирт, 100° спирт (1 смена), 100° спирт (2 смена), толуол (1 смена), толуол (2 смена).
Заключение срезов.
Одним из условий, определяющих пригодность гистологических препаратов к микроскопическому исследованию, является их прозрачность. Кроме того, препараты должны быть защищены от высыхания и загрязнения. Все это обеспечивается просветлением и заключением в специальные среды. Тип среды зависит от вида исследования. Наиболее часто при изготовлении гистологических препаратов используют смолы растительного происхождения – бальзамы, в частности канадский бальзам. Все они хорошо растворяются в ксилоле и толуоле.
Для заключения на срез капают каплю бальзама и покрывают чистым и сухим покровным стеклом. Бальзам должен растечься между предметным и покровным стеклом так, чтобы было заполнено все пространство. Полученные таким образом препараты могут храниться в течение многих лет.
Покровные стекла.
Покровные стекла имеют квадратную или прямоугольную форму и толщину от 0,13 мм до 0,16 мм (толщина может варьировать от партии к партии). Стекла имеют постоянную толщину на уровне не только каждого стекла, но и серии. Они также должны быть бсолютно бесцветны.
Красители.
Классификация красителей.
По источникам получения.
§ Натуральные красители – получают из животных (кармин) или растений (гематоксилин).
§ Синтетические красители - получают путем химического синтеза; в частности гематоксилин и кармин могут быть и синтетическими.
По принципу окрашивания.
v Основные красители. Это основания или их соли, которые окрашивают структуры кислой природы (то есть реагируют с кислыми группами). Такие красители получили название базофильных. Базофилия – сродство клетки или ее участка к основным красителям. Другое название таких красителей – ядерные, так как именно в ядре содержится много кислых групп (нуклеиновые кислоты). К основным красителям относятся гематоксилин, тионин, кармин, азур, метиленовый зеленый и др.
v Кислотные красители. Это кислоты или их соли, с помощью которых выявляют вещества и структуры оснóвной природы (цитоплазматические структуры клеток, эритроциты и т.д.). Таковыми являются эозин, кислый фуксин, конго красный и др. Ацидофилия – способность клеточных культур окрашиваться кислыми красителями.
v Нейтральные красители. К ним относятся судан III, судан IV, метиленовый синий.
По способу окрашивания.
ü Прогрессивные красители. Такими красителями объект сразу окрашивается до необходимой степени.
ü Регрессивные красители. Объект сначала перекрашивается, а затем дифференцируется до нужного оттенка.
Виды красителей.
Ø Гематоксилин. Гематоксилин выделен в 1811г. французским химиком-органиком Мишелем Эженом Шеврёлем. Это краситель, получаемый из древесины (красно-коричневой) кампешевого дерева (сандальное дерево, родина – Центральная Америка). В процессе приготовления гематоксилина для использования в микроскопической технике происходит его "созревание" (окисление), он превращается в гематеин, красящий ядра клеток, хромосомы и клеточные оболочки в синий и сине-чёрный цвет.
Так как гематоксилин – базофильный краситель, то он преимущественно окрашивает ядро в оттенки фиолетового цвета (зависит от времени окрашивания). В ядре четко прокрашиваются ядрышки (как плотная структура).

Ø Эозин. (от греч. eós - утренняя заря). Эозины - триарилметановые красители, галогенопроизводные флуоресцеина. Наиболее известны собственно эозин (тетрабромфлуоресцеин, C20H8Br4O5 ) и эритрозин (тетраиодфлуоресцеин). Впервые эозин синтезирован в 1873г. немецким химиком Генрихом Каро
Эозины хорошо растворяются в воде (хуже - в спирте), образуя флуоресцирующие растворы. Эозины - кислотные красители: окрашивают шерсть и шелк в яркие розовые и красные цвета (отсюда название), но окраски малоустойчивы. Главные области применения: производство чернил, цветных карандашей, губной помады, румян, крашение бумаги, пищевых продуктов, окраска биологических препаратов.
Употребляется для окрашивания цитоплазмы после окраски ядерными красителями. На препаратах эозин дает окраску от ярко-красного до золотисто-желтого. Обычно употребляют 0,1% раствор
Ø Железный гематоксилин. Методика окраски была предложена немецким гистологом Мартином Гейденгайном в 1896г; таким образом, она и получила имя этого исследователя. Для окрашивания этим методом готовят 2 раствора: 1) протрава – 2,5% водный раствор железоаммиачных квасцов; 2) краситель гематоксилин. С протравой гематеин (см. выше) образует солеобразное соединение – так называемый лак, который и окрашивает ткани.
Ø Метод серебрения по Рамон-и-Кахалю. Рамон-и-Кахаль – испанский нейрогистолог, впервые применивший метод серебрения. В 1890г. он первым открыл отростки нервных клеток – дендриты. К 1894г. он создал учение о нейроне как структурной единице живого. За изучение строения нервной системы в 1906г. совместно с К. Гольджи получил Нобелевскую премию.
Принцип предложенного им метода основан на том, что свежее взятые кусочки ткани сразу или после фиксации спиртом пропитывают раствором нитрата серебра, а образовавшиеся при этом соединения серебра восстанавливают при последующей обработке пирогалловой кислотой или гидрохиноном.
Препараты.
v Кровь лягушки .
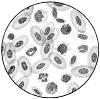 Кровь – жидкая соединительная ткань. Она состоит из плазмы и форменных элементов: красных кровяных клеток – эритроцитов, белых кровяных клеток – лейкоцитов и кровяных пластинок – тромбоцитов. Эритроциты в крови лягушки достигают 23 мкм в диаметре. Для сравнения диаметр большей части эритроцитов человека составляет 7,5 мкм. Другой отличительной особенностью эритроцитов крови лягушки является наличие ядер (эритроциты человека – безъядерные).
Кровь – жидкая соединительная ткань. Она состоит из плазмы и форменных элементов: красных кровяных клеток – эритроцитов, белых кровяных клеток – лейкоцитов и кровяных пластинок – тромбоцитов. Эритроциты в крови лягушки достигают 23 мкм в диаметре. Для сравнения диаметр большей части эритроцитов человека составляет 7,5 мкм. Другой отличительной особенностью эритроцитов крови лягушки является наличие ядер (эритроциты человека – безъядерные).
В мазке крови эритроцит лягушки имеет овальную форму, хотя на самом деле он немного двояковыпуклый. Следует заметить, что в большинстве клеток ядро повторяет форму самой клетки (эритроцит лягушки является тому подтверждением). Препарат окрашен гематоксилин-эозином.
Кроме эритроцитов на препарате можно увидеть и лейкоциты, но в значительно меньшем количестве.

 Лейкоциты
Лейкоциты
зернистые (гранулоциты) незернистые (агранулоциты)
Признаки гранулоцитов: сегментированные ядра и наличие зернистости в цитоплазме. К гранулоцитам относятся: нейтрофилы, эозинофилы, базофилы.
Признаки агранулоцитов: не содержат зернистости в цитоплазме, их ядра не сегментированы. К агранулоцитам относятся лимфоциты и моноциты.
Кроме того, на препарате крови лягушки можно обнаружить и тромбоциты (кровяные пластинки). Они представляют собой безъядерные фрагменты цитоплазмы, отделившиеся от мегакариоцитов – гигантских клеток костного мозга. Имеют вид мелких бесцветных телец округлой или овальной формы.
Дата добавления: 2018-09-22; просмотров: 722; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
